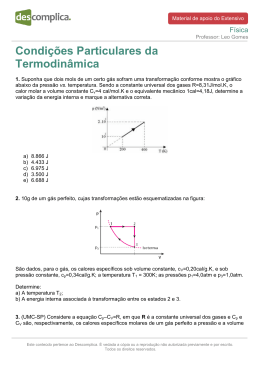
Material de apoio do Extensivo Química Professor: Allan Rodrigues Estudo da Velocidade das Reações 1. Alguns fatores podem alterar a rapidez das reações químicas. A seguir, destacam-se três exemplos no contexto da preparação e da conservação de alimentos: 1. A maioria dos produtos alimentícios se conserva por muito mais tempo quando submetidos à refrigeração. Esse procedimento diminui a rapidez das reações que contribuem para a degradação de certos alimentos. 2. Um procedimento muito comum utilizado em práticas de culinária é o corte dos alimentos para acelerar o seu cozimento, caso não se tenha uma panela de pressão. 3. Na preparação de iogurtes, adicionam-se ao leite bactérias produtoras de enzimas que aceleram as reações envolvendo açúcares e proteínas lácteas. Com base no texto, quais são os fatores que influenciam a rapidez das transformações químicas relacionadas aos exemplos 1, 2 e 3, respectivamente? a) Temperatura, superfície de contato e concentração. b) Concentração, superfície de contato e catalisadores. c) Temperatura, superfície de contato e catalisadores. d) Superfície de contato, temperatura e concentração. e) Temperatura, concentração e catalisadores. 2. A reação química entre o gás hidrogênio e o monóxido de nitrogênio, representada a seguir, foi analisada em duas séries de experimentos. 2 H2 (g) 2 NO(g) N2 (g) 2 H2O (g) Na primeira série, a velocidade de reação foi medida em função da concentração de hidrogênio, mantendo-se a concentração de monóxido de nitrogênio constante em 1 mol.L -1. Na segunda série, determinou-se a velocidade em função da concentração de monóxido de nitrogênio, mantendo-se a concentração de hidrogênio constante em 1 mol.L-1. Os resultados dos experimentos estão apresentados nos gráficos. Determine a ordem de reação de cada um dos reagentes e calcule o valor da constante cinética. Este conteúdo pertence ao Descomplica. É vedada a cópia ou a reprodução não autorizada previamente e por escrito. Todos os direitos reservados. Material de apoio do Extensivo Química Professor: Allan Rodrigues 3. O processo de remoção de enxofre em refinarias de petróleo é uma prática que vem sendo cada vez mais realizada com o intuito de diminuir as emissões de dióxido de enxofre de veículos automotivos e o grau de envenenamento de catalisadores utilizados. A dessulfurização é um processo catalítico amplamente empregado para a remoção de compostos de enxofre, o qual consiste basicamente na inserção de hidrogênio. A reação química do composto etanotiol é mostrada a seguir: C2H5SH(g) H2 (g) C2H6 (g) H2S(g) a) Suponha que a reação de dessulfurização seja realizada em laboratório, na presença de concentrações diferentes de etanotiol e hidrogênio, conforme quadro a seguir: Experiências 1 2 3 4 [Etanotiol] (mol/L) 2 2 3 6 [Hidrogênio] (mol/L) 1 2 6 6 Velocidade inicial (mol/min) 4 8 8 16 Com base nos dados apresentados nessa tabela, determine a lei da velocidade e a ordem da reação. b) Considerando que a velocidade média da reação de dessulfurização, em certo intervalo de tempo, é de 10 mol/s em relação ao etanotiol, determine a velocidade da reação em relação ao gás sulfídrico dada em g/s, no mesmo intervalo de tempo. 4. Alguns tipos de vidros destinados à construção civil são autolimpantes devido à presença de filmes nanoestruturados depositados em sua superfície. Vidros com filmes de TiO2, que apresentam propriedades fotocatalíticas, quando submetidos à radiação ultravioleta proveniente do sol, auxiliam na decomposição de compostos orgânicos aderidos na superfície do vidro. A reação a seguir é um exemplo de decomposição de um composto orgânico na presença de radiação ultravioleta (UV) catalisado por TiO2. luz UV TiO 2 18CO Composto orgânico s 26O2 g 2 g 18H2O Com respeito a essa reação, considere as afirmativas a seguir. I. Na reação de decomposição, observa-se a oxidação dos átomos de carbono presentes no composto orgânico. II. O composto orgânico é o ácido octadecanoico. III. O catalisador TiO2 diminui a energia de ativação da reação de decomposição do composto orgânico. IV. O catalisador TiO2 aumenta o rendimento da reação. Assinale a alternativa correta: Este conteúdo pertence ao Descomplica. É vedada a cópia ou a reprodução não autorizada previamente e por escrito. Todos os direitos reservados. Material de apoio do Extensivo Química Professor: Allan Rodrigues a) Somente as afirmativas I e II são corretas. b) Somente as afirmativas I e IV são corretas. c) Somente as afirmativas III e IV são corretas. d) Somente as afirmativas I, II e III são corretas. e) Somente as afirmativas II, III e IV são corretas. 5. Durante a manifestação das reações químicas, ocorrem variações de energia. A quantidade de energia envolvida está associada às características químicas dos reagentes consumidos e dos produtos que serão formados. O gráfico abaixo representa um diagrama de variação de energia de uma reação química hipotética em que a mistura dos reagentes A e B levam à formação dos produtos C e D. Com base no diagrama, no sentido direto da reação, conclui-se que a a) energia de ativação da reação sem o catalisador é igual a 15 KJ. b) energia de ativação da reação com o catalisador é igual a 40 KJ. c) reação é endotérmica. d) variação de entalpia da reação é igual a 30 KJ. 6. A reação entre os íons brometo e bromato, em meio aquoso e ácido, pode ser representada pela seguinte equação química balanceada: 5Br aq BrO3 aq 6H aq 3Br2aq 3H2O Sabendo que a velocidade de desaparecimento do íon bromato é igual a 5,63 106 mol L1 s1, assinale a alternativa que apresenta o valor CORRETO para a velocidade de aparecimento do bromo, Br2, expressa em mol L1 s1. a) 1,69 105 b) 5,63 106 c) 1,90 106 d) 1,13 106 e) 1,80 1016 Este conteúdo pertence ao Descomplica. É vedada a cópia ou a reprodução não autorizada previamente e por escrito. Todos os direitos reservados. Material de apoio do Extensivo Química Professor: Allan Rodrigues 7. O diagnóstico de doenças tropicais pode ser realizado por meio do uso de biossensores. Esses dispositivos monitoram a reação entre antígenos e anticorpos, que normalmente resultam na formação de um complexo colorido. A tabela a seguir apresenta as concentrações do complexo AB formado em função do tempo em uma reação entre um antígeno A e um anticorpo B na proporção estequiométrica de 1:1. Tempo (s) [AB] (x10–6 mol/L) 0 0 5 40 10 65 15 80 20 87 A2 + B2 AB A partir dos dados apresentados: a) Esboce o gráfico que represente a cinética de formação do complexo AB colorido; b) Calcule a velocidade média da reação. Este conteúdo pertence ao Descomplica. É vedada a cópia ou a reprodução não autorizada previamente e por escrito. Todos os direitos reservados.
Download