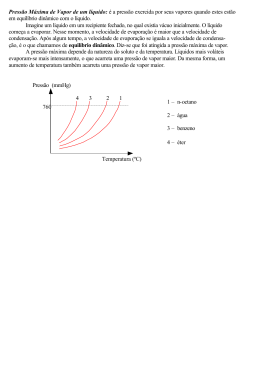
Exercícios 4 – Diagramas de Fase 1. É dado o diagrama de fases de uma substância: 10 5 a) O que representam os pontos x, y, w e z assinalados no gráfico? b) Sob pressão normal (1 atm) e à temperatura ambiente (200C), em que fase se encontra a substância? c) Assinale no diagrama as regiões correspondentes às fases sólida, líquida e de vapor. 2. Dado o diagrama de fases de uma substância, pergunta-se: a) Que mudança de fase ocorre quando a substância passa do estado A para o estado B? b) Que mudança de fase ocorre na passagem do estado B para o estado C? c) Em que fase pode encontrar-se a substância no estado representado pelo ponto D? d) E nos estados representados pelos pontos E, F e G? e) Qual dos pontos assinalados no diagrama é o ponto triplo ou tríplice e por que recebe esse nome? 3. (Unemat-MT) Dado o diagrama de fases de uma determinada substância abaixo com pressão medida em atm e temperatura em graus Celsius, avalie as afirmações: 5 35 01) Na passagem do estado X para o Y ocorre a vaporização. 02) Na passagem do estado Y para o Z ocorre a fusão. 04) Sob pressão de 5 atm e temperatura de 350C, a substância se encontra no estado líquido. 08) Se a substância for expandida isotermicamente, a partir do estado X, ela poderá sofrer sublimação. 16) O ponto A está sobre a curva de sublimação. Dê como resposta a soma dos números que precedem as afirmações corretas. 1 4. (UEL – PR) O gráfico abaixo representa o diagrama de fases da água. A linha A representa a pressão na cidade de Paranaguá, no litoral paranaense. A linha B, na cidade de Londrina, e a linha C, no pico Paraná (ponto culminante do estado do Paraná). Com base nesse gráfico são feitas as seguintes afirmativas: I. Utilizando-se sistemas de aquecimento idênticos para aquecer massas iguais de água, com as mesmas temperaturas iniciais, até o ponto de vapor, gasta-se mais energia na cidade de Londrina que no pico Paraná. II. Nas três localidades, o gasto de energia para aquecer quantidades iguais de água, do ponto de gelo até o ponto de vapor, é o mesmo. III. A temperatura do ponto de gelo em Paranaguá é maior que a temperatura do ponto de gelo em Londrina. Assinale a alternativa correta: a) Apenas a afirmativa I é correta. b) Apenas a afirmativa II é correta. c) Apenas as afirmativas I e III são corretas. d) Todas as afirmativas são corretas. e) Apenas as afirmativas II e III são corretas. 5. (UFMG) A figura mostra o diagrama de fase de uma substância hipotética. Observando o gráfico, responda às questões que seguem. a) Associe as regiões I, II e III com as fases sólida, líquida e vapor dessa substância. Justifique sua resposta. b) Estime a temperatura de ebulição da substância, quando ela se encontra à pressão constante de 0,6 atm. Explique o raciocínio utilizado. c) Responda se essa substância pode ser sublimada à pressão atmosférica normal. Justifique sua resposta com base nos dados apresentados no gráfico. d) Conceitue ponto triplo e estime-o para essa substância. 6. Considere que o diagrama de fases abaixo pertença a uma substância hipotética. a) Em que fase se apresenta esta substância nas condições normais de temperatura e pressão? b) Se certa massa de vapor desta substância à temperatura de 300 0C for comprimida isotermicamente, que mudança de estado poderá sofrer? Por quê? c) Localize o ponto triplo e o ponto crítico da substância, explicando as características desses dois estados. 2 7. (Enem) A panela de pressão permite que os alimentos sejam cozidos em água muito mais rapidamente do que em panelas convencionais. Sua tampa possui uma borracha de vedação que não deixa o vapor escapar, a não ser através de um orifício central sobre o qual assenta um peso que controla a pressão. Quando em uso, desenvolve-se uma pressão elevada no seu interior. Para a sua operação segura, é necessário observar a limpeza do orifício central e a existência de uma válvula de segurança, normalmente situada na tampa. O esquema da panela de pressão e um diagrama de fase da água são apresentados abaixo. A vantagem do uso de panela de pressão é a rapidez para o cozimento de alimentos e isto se deve à a) pressão no seu interior, que é igual à pressão externa. b) temperatura de seu interior, que está acima da temperatura de ebulição da água no local. c) quantidade de calor adicional que é transferida à panela. d) quantidade de vapor que está sendo liberada pela válvula. e) espessura da sua parede, que é maior que a das panelas comuns. 8. (Mackenzie - SP) Local Altitude em Relação ao Nível do Mar (m) Rio de Janeiro 0 Cidade do México 2240 São Paulo 750 Monte Everest 8845 Nos locais relacionados na tabela, foram colocadas batatas para cozinhar em panelas abertas idênticas, contendo o mesmo volume de água. É de se esperar que as batatas fiquem cozidas em menos tempo: a) No Rio de Janeiro, pois a temperatura de ebulição da água é menor do que nos outros locais. b) No Monte Everest, pois quanto maior for a altitude, maior é a temperatura de ebulição da água. c) Em São Paulo, pois quanto maior for a poluição atmosférica, menor será a temperatura de ebulição da água. d) Na Cidade do México, por estar mais próxima do equador. e) No Rio de Janeiro, pois, ao nível do mar, a água ferve a uma temperatura mais elevada. 9. Numa panela de pressão, a água entra em ebulição a 1200C. Quantas calorias são necessárias para aquecer e depois vaporizar totalmente 70 g de água, cuja temperatura inicial é 500C? O calor latente de vaporização da água a 1200C vale 523,1 cal/g e o calor específico médio da água líquida é igual a 1 cal/g0C. Resp: 41517 cal 10. Em um recipiente termicamente isolado do exterior, coloca-se uma mistura de gelo e água a 00C, sob pressão normal. Fornecendo certa quantidade de calor à mistura, verifica-se que a temperatura não varia e o volume do sistema diminui 0,5 cm3. (Dadas as densidades dgelo = 0,92 g/cm3 e dágua = 1 g/cm3 e o calor latente de fusão do gelo LF = 80 cal/g) a) Explique a diminuição do volume do sistema. b) Calcule a massa de gelo que se transforma em água líquida. c) Determine a quantidade de calor recebida pela mistura. Resp: b) m = 5,75 g; c) Q = 460 cal 3 11. Ao fundir, o gelo se contrai. A variação de volume é proporcional à massa de gelo que derrete. Sendo dgelo = 0,92 g/cm3 a densidade do gelo a 00C e dágua = 1 g/cm3 a densidade da água à 00C e LF = 80 cal/g o calor latente de fusão do gelo, determine: a) A massa de gelo que deve derreter para reduzir de 2 cm3 o volume de certa mistura de água e gelo a 00C. b) A quantidade de calor recebida durante o processo. Resp: a) 23 g; b) 1840 cal 12. Numa experiência de Biologia, um animal foi introduzido numa mistura de água e gelo, sob pressão normal. Decorrido certo tempo, houve contração de 0,64 cm3 na mistura. No mesmo tempo, a contração teria sido 0,42 cm3 sem a presença do animal. a) Determine a quantidade de calor que a mistura recebe do animal no intervalo de tempo considerado, sendo dados dgelo = 0,92 g/cm3 e dágua = 1 g/cm3 e o calor latente de fusão do gelo LF = 80 cal/g. b) Admitamos que o referido tempo seja o necessário para que o animal, inicialmente a 300C, entre em equilíbrio térmico com a mistura à 00C. Consideremos ainda que o animal não produza calor por processos metabólicos e que 20% do calor que ele cede se perca para o ambiente. Determine a capacidade térmica do animal. Resp: a) 202,4 cal; b) 8,43 cal/0C 13. No interior de um cilindro provido de êmbulo está um líquido volátil (por exemplo, éter) em equilíbrio com seu vapor. A temperatura se mantém constante. Responda: a) O equilíbrio entre o líquido e o vapor é estático ou é dinâmico? b) Como é chamada a pressão exercida pelo vapor, nesta caso? c) O que ocorre com o sistema se elevarmos o êmbolo sem variarmos a temperatura? d) Que sucede ao sistema se baixarmos o êmbolo sem variarmos a temperatura? 14. Um cilindro com pistão contém 30 cm3 de vapor seco de certa substância, sob pressão normal. Se o pistão for movimentado, de modo que o vapor continue seco e o volume passe a 75 cm3, qual será a nova pressão do vapor? A temperatura se mantém constante durante o processo. Resp: 0,4 atm 15. Um cilindro de volume variável contém, inicialmente, 20 cm3 de vapor saturante de uma substância a 10 0C, exercendo uma pressão de 15 cmHg. Se o volume for reduzido à metade, sem alteração de temperatura, considerando-se que ainda haja vapor presente, o que sucede à pressão exercida pelo vapor? Justifique. Resp: 15 cmHg 16. Num dia em que a temperatura ambiente é 200C, a pressão parcial do vapor d’água na atmosfera é 7,0 mmHg. Sabendo que a pressão máxima de vapor d’água a 200C é igual a 17,5 mmHg, determine a umidade relativa do ar. Resp: 0,4 17. Sob pressão normal, o gelo-seco (CO2, na fase sólida) sublima-se a -78,50C. Determine a quantidade de calor necessária para sublimar 50 g de gelo-seco à temperatura de sublimação. O calor latente de sublimação do CO2 sob pressão normal é 142 cal/g. Resp: 7100 cal 18. No Rio de Janeiro (ao nível do mar), uma certa quantidade de feijão demora 40 minutos em água fervente para ficar pronta. A tabela abaixo fornece o valor da temperatura de fervura da água em função da pressão atmosférica, enquanto o gráfico fornece o tempo de cozimento dessa quantidade de feijão em função da temperatura. A pressão atmosférica ao nível do mar vale 760 mm Hg e ela diminui 10 mm de mercúrio para cada 100 m de altitude. Temperatura de fervura da água em função da pressão Pressão em mmHg 600 640 680 720 760 800 840 880 920 960 1000 1040 Temperatura em 0C 94 95 97 98 100 102 103 105 106 108 109 110 a) Se o feijão fosse colocado em uma panela de pressão a 880 mmHg, em quanto tempo ele ficaria pronto? b) Em uma panela aberta, em quanto tempo o feijão ficará pronto na cidade de Gramado (RS) na altitude de 800 m? c) Em que altitude o tempo de cozimento do feijão (em uma panela aberta) será o dobro do tempo de cozimento ao nível do mar? Resp: a) 20 min; b) 60 min; c) 1200 m 4 19. (Unifesp) Os líquidos podem se transformar em vapor por evaporação ou por ebulição. Enquanto a evaporação é um fenômeno espontâneo, restrito à superfície do líquido e que pode ocorrer a temperatura e pressão ambientes, a ebulição ocorre em todo o líquido, sob condições de pressão e temperatura determinadas para cada líquido. Mas ambas as transformações, para se efetivarem, exigem o consumo da mesma quantidade de calor por unidade de massa transformada. a) Quando as roupas são estendidas nos varais, ou a água no piso molhado de um ambiente é puxada pelo rodo, tem-se por objetivo apressar a secagem – transformação da água em vapor – dessas roupas ou do piso. Qual a causa comum que se busca favorecer nesses procedimentos? Justifique. b) Avalia-se que a área da superfície da pele de uma pessoa adulta seja, em média, da ordem de 1,0 m2. Suponha que, ao sair de uma piscina, uma pessoa retenha junto à pele uma camada de água de espessura média 0,50 mm. Qual a quantidade de calor que essa camada de água consome para evaporar? Que relação tem esse cálculo com a sensação de frio que sentimos quando estamos molhados, mesmo em dias quentes? Justifique. (Dados: densidade da água = 1000 kg/m3; calor latente de vaporização da água = 2300 kJ/kg.) Resp: b) 1150 kJ 20. (UFF-RJ) Marque a opção que representa a afirmativa falsa: a) Uma substância não existe na fase líquida quando submetida a pressões abaixo daquela de seu ponto triplo. b) A sublimação de uma substância é possível se esta estiver submetida a pressões mais baixas que a de seu ponto triplo. c) Uma substância só pode existir na fase líquida se a temperatura a que estiver submetida for mais elevada que a sua temperatura crítica. d) Uma substância não sofre condensação a temperaturas mais elevadas que sua temperatura crítica. e) Na Lua, um bloco de gelo pode passar diretamente para a fase gasosa. 21. (Unifra – RS) Assinale verdadeiro (V) ou falso (F) e marque a opção com a sequência que julgar correta. ( ) A pressão máxima de vapor de uma substância cresce com a temperatura da substância. ( ) O ponto triplo de uma substância é caracterizado por um par de valores de pressão e temperatura, para os quais coexistem, em equilíbrio, o sólido, o líquido e o vapor da substância. ( ) É possível que a água ferva à temperatura de 700C. A sequência correta é: a) V – V – V b) V – F – V c) V – F – F d) F – V – F e) F – F – V 5
Download