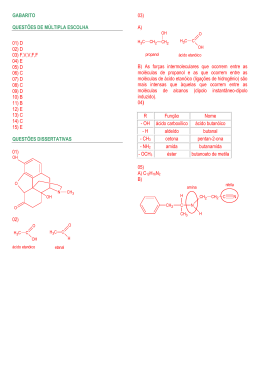
Curso Prático & Objetivo Direitos Autorais Reservados REAÇÕES ORGÂNICAS – ALCANOS H H HALOGENAÇÃO H H + H CXC H obscuridade [O] + HOH H C C H OH OH CH4 + Cl2 H + H C H H luz Cl Cl + H C Cl HCl O KMnO4 constitui uma solução violeta intensa. Quando ele passa a MnO2 precipita esse óxido marrom escuro. Quando o KMnO4 reage, a cor violeta desaparece. Já em meio ácido, o KMnO4 o oxidante é bastante energético e produz ruptura na posição da dupla ligação. H H CRACKING (ou pirólise) Δ R C C C C R' R' R C C C C H H R C X C R' COMBUSTÃO 1 CnH2n+2 + (3n+1)/2 O2 Æ n CO2 + (n+1) H2O Δ H3C – (H + HO) – NO2 H O Δ SO3H + H2O H3C SO3H OH HC CH H2C CH2 + Cl2 + HCN H2C CH2 Cl Cl OH REAÇÃO COM HX H H H H H H C C CH3 + H Br HC CH H C C CH3 Hidratação HC CH H H3C CH2 OSO3H OSO3H Polimerização H H H C C H H H cat C C * pressão, Δ n * H H Combustão dos Alcenos 3n/2 O2 n CO2 + n H 2O Oxidação dos alcenos - Ozonólise H2C C CH3 + O3+ H O 2 H H C O CH3 O + + H2O2 H3C C H3C C Cl 2 HCl HgSO4 + H2O H2SO4 H H2C C OH enol O enol tautomeriza-se na forma aldeídica pela transposição do átomo de H. H H H C C H2C C 3 O OH acetaldeído REAÇÕES PARTICULARES DOS ALCINOS VERDADEIROS O alcino verdadeiro possui H polarizado que pode ser substituiído por um metal, conforme já foi visto. Temos então compostos denominados ACETILETOS. Em especial, os acetiletos Ag e Cu são sólidos insolúveis na água e que quando secos são altamente explosivos, sendo susceptíveis até a choques. Para a obtenção de acetiletos podemos utilizar como reagente Na (metálico), AgNO3 amoniacal, Cu2Cl2 amoniacal. R C C H + Na R C C Na +1/2 H2 Reação com HClO, H2SO4 + + Cl HIDRATAÇÃO DOS ALCINOS A hidratação catalítica produz cetonas; no caso particular do acetileno temos a produção do acetaldeído. H Br brometo de isopropila + C H2C C C N H acrilonitrila Reação com HX CnH2n R' REAÇÃO COM HCN Reação com Halogênios: Cl2, Br2 e I2 n + Cl Cl REAÇÕES ORGÂNICAS – ALCENOS H2C CH2 O R C Dentre as reações são importantes as dos alcinos verdadeiros, principalmente a acetileno em virtude da importância industrial. Nos alcinos falsos as reações são praticamente análogas às dos alcenos, em doses duplicadas. CLORAÇÃO Cl Cl HC CH + 2Cl2 HC CH H2O + H3C – NO2 SULFONAÇÃO – H2SO4 conc. + HO + REAÇÕES ORGÂNICAS – ALCINOS NITRAÇÃO – HNO3 conc. H 3C H KMnO4 + 4 [O] R C C H CH3 - Reação com KMnO4 O permanganato em meio básico ou neutro é um oxidante brando; não chega a romper a dupla, mas reage introduzindo radicais –OH na cadeia. A decomposição do permanganato é: R C C H + AgNO3 NH4OH + 1/2 Cu2Cl2 NH4OH + HNO3 R C C Cu + HCl R C C Ag REAÇÕES ORGÂNICAS – ALCADIENOS Reações de Adição Nos alcadienos de duplas acumuladas e isoladas as reações são as mesmas dos alcenos. A grande diferença está nos alcadienos eritrênicos (duplas conjugadas). Temos a reação de adição 1-4: básico / neutro 2KMnO4 ⎯⎯⎯⎯⎯ ⎯ → K 2O + 2MnO2 + 3[O] Diante de um alceno a atuação será do [O] 1 Curso Prático & Objetivo Direitos Autorais Reservados H2C C C CH2 H H + REAÇÕES ORGÂNICAS – HIDROCARBONETOS AROMÁTICOS H3C C C C Br H H H2 HBr O anel benzênico é muito estável e precisa de condições bastante energéticas para sofrer ruptura do anel. As principais substituições são: Reações de Diels-Alder Sempre temos um alcadieno ciclando-se com um outro composto (dienófilo). HC HC H C C CH2 + C C H CH2 Halogenação H2 O C H C C HC O C C HC C H O H O O O H dienófilo + + HNO3 Cl + HCl + H2O + H2O + HCl Nitração 2 dieno FeCl3 Cl2 H aduto H2SO4 NO2 CICLANOS Nitrobenzeno Sulfonação Os ciclanos com 3 e 4 átomos de carbono dão reações de adição com abertura da cadeia, enquanto que os de 5 ou mais carbonos dão reações de substituição. H SO3H H2SO4 Ni + H2 + Br2 Ácido Benzeno-sulfônico 120°C Alquilação H Br Br + HBr + Br H + H2 + Br2 R C R AlCl3 R C Cl Ni + AlCl3 R Cl Acilação Com 4 C a reação é mais difícil: O Br HBr + Ni 3 H2 Br 300°C 200 atm Cl Ni H2 + NÃO OCORRE Δ Em anéis com 6 átomos de carbono a reação de adição ocorre somente com superaquecimento, com Br2 ocorre substituição e com HBr a reação não ocorre. + super aquecimento Br2 + + HBr não ocorre H2 + Br2 HBr + HBr + Cl Cl Calor Cl2 Luz Reações de Oxidação É muito difícil oxidar os carbonos do anel benzênico. Isto só ocorre em condições muito energéticas e produz a ruptura e conseqüentemente o desaparecimento desse anel benzênico. Nos radicais do anel as reações são menos difíceis. Essa reação sempre resulta em ácido benzóico para aromáticos com apenas 1 radical . muito difícil Br + Cl Reações Fora do Anel Podem ocorrer reações no radical ligado ao anel benzênico, semelhante às estudadas anteriormente. Por exemplo, no ataque do tolueno, na presença de luz e calor, temos a reação no metil. Este radical se comporta como um alcano. H2C Cl CH3 Com 6 átomos a estabilidade é máxima, tornando a reação de adição muito difícil de ocorrer. Da mesma maneira que o ciclopentano, o ciclohexano faz reação de substituição com o Br2 e não reage com o HBr. + luz Cl Cl Br + 3 Cl2 Δ Essa última reação é utilizada para se obter o BHC (benzeno hexa clorado), composto utilizado como inceticida. Pt H2 HCl Cetona Aromática A reação de adição ocorre em condições muito energéticas: 200°C Já com 5 fica ainda mais complicado: + + O Br + + HBr não ocorre C CH3 H2 Enfim, os ciclanos com 3 e 4 C rompem facilmente o ciclo enquanto que com os ciclanos com mais carbonos é muito difícil de ocorrer rompimento do ciclo. Isso é explicado através da Teoria das Tensões de Bayer. + [O] KMnO4 H2SO4 O C + CO2 + OH ácido benzóico 2 H2O Curso Prático & Objetivo Direitos Autorais Reservados Influência de um Radical no Anel a) Radicais orto-para dirigentes ⎯NH2 ⎯OH ⎯OCH3 H3C O H H2C CH2 R O Na H2C CH2 + H2C CH2 Na éter Estas reações exigem aquecimento (temperaturas mais altas favorecem a primeira reação) e catalisadores (em fase líquidas são utilizados catalisadores ácidos como H2SO4 e H3PO4; em fase vapor são utilizados catalisadores sólidos, como Al2O3 e SiO2) 1/2 H2 H2SO4 + HO C R' R O C R' R O H + Cl C R' R O C R' + R' R O H C O C R'' + O O R' MgX 140ºC + HCl R O C R'' + R' C OH O O + R O MgX R'H Exemplo: + R' R O MgBr + R'H MgBr brometo de alcóxi magnésio Substituição da Hidroxila Essas reações revelam a característica básica (liberação de OH) dos álcoois. Entretanto deve-se lembrar que esse caráter básico é FRACO. Contudo no item anterior vimos que os álcoois também possuem um caráter ácido fraco, são portanto, compostos ANFÓTEROS. Segue abaixo algumas dessas reações: R X + H 2O R O H + H X + PX3 3 RX + +H O NO2 Reação com Halogênios a frio H3C C O C CH3 H2 H2 P(OH)3 ou H3PO3 R O NO2 + H2O + H2O Exemplo: +H O NO2 H3C O NO2 + Cl2 ausência de Luz H H3C C O C CH3 H2 Cl + HCl Cisão por Ácidos A molécula de um éter é rompida quando aquecida com H2SO4, ácidos halogenídricos (a reatividade é HI>HBr>HCl) H3C C O C CH3 + HI C2H5OH + C2H5I H2 H2 Nitrato Orgânico H3C O H H2O REAÇÕES ORGÂNICAS – ÉTERES ácido fosforoso R O H + Reações de Redução São obtidas somente com redutores energéticos. A mais importante é conhecida como reação de Berthelot: Δ RH + H2O + I2 ROH + 2 HI haleto ácido A velocidade dessa reação diminui na ordem: álcool terciário > secundário > primário HI > HBr > HCl R O H C2H5 O C2H5 R R [O] HC OH + C O - H2O R' R' álcool cetona secundário R [O] R" C OH + NÃO OCORRE - H2O R' álcool terciário haleto de alcóxi magnésio H3C O H H2O Reações de Oxidação Na presença de KMnO4 ou K2Cr2O7, em meio sulfúrico, teremos: O O [O] [O] R CH2 OH + R C R C - H2O H OH álcool ácido aldeído primário O O R O H + H2O O O + C2H5OH etóxido de sódio R O H H2C CH2 170ºC + H 2O intermolecular + 1/2 H2 C2H5 O Na + H3C C O C CH3 H2 H2 HO H H2SO4 + H2O intramolecular alcóxido de sódio Exemplo: C2H5 O H + H OH H OH + H3C O SO3H + H2O O SO3H H2C CH2 Substituição do Hidrogênio da Hidroxila Essas reações mostram que o álcool tem um caráter ácido (libera H), entretanto é um caráter ácido FRACO. A ordem de reatividade é: Álcool Primário>Secundário>Terciário metais alcalinos e alcalinos terrosos +H Desidratação de Álcoois ⎯SO3H REAÇÕES ORGÂNICAS – ÁLCOOIS Na H2O Sulfato Ácido de Metila ⎯COOH ⎯COH ⎯CN A maioria desses radicais possuem ligações duplas, triplas ou dativas. R O H + R O SO3H Sulfato Ácido Orgânico H O SO3H Exemplo: ⎯CH3 ⎯Cl ⎯C2H5 A maioria desses radicais só possuem ligações simples entre os átomos. b) Radicais Meta Dirigentes ⎯NO2 + R O H Reações de Oxidação Os éteres são lentamente oxidados pelo oxigênio do ar, dando origem à peróxidos de estruturas complexas. H3C C O O C CH3 H3C C O C CH3 + 1/2 O2 H2 H2 H2 H2 Nitrato de metila peróxido 3 Curso Prático & Objetivo Direitos Autorais Reservados O REAÇÕES ORGÂNICAS – ALDEÍDOS E CETONAS R C Adição à Carbonila + R C H OH O + NaHSO3 R C R C SO3Na H NOTA: Uma maneira de diferenciar aldeídos de cetonas é que somente os aldeídos reduzem os reativos de Tollens e de Fehling. a) Reativo de Tollens: é uma solução amoniacal de nitrato de prata, que, em presença de aldeído (teste positivo), tem seus íons Ag+ reduzidos a prata metálica; a prata deposita-se nas paredes internas do tubo de ensaio formando um “espelho de prata”; as cetonas não reagem. b) Reativo de Fehling (ou licor de Fehling): que é uma solução que possui íons de Cu2+ (azul) e em presença de aldeído (teste positivo) tem seus íons reduzidos a Cu+, formando um precipitado vermelho tijolo de Cu2O H OH O + R C HOH R C OH H H instável OH O + R C R'OH OH ácidos aldeídos Já as cetonas não reagem na presença de oxidantes fracos ou quebram sua cadeia por oxidantes muito fortes. R – CO – R’ + [O] Æ não reage R C CN HCN H R C H OH O O [O] R C OR' H REAÇÕES ORGÂNICAS – ÁCIDOS CARBOXÍLICOS H excesso R'OH Reação de Salificação R – COOH + NaOH Æ R- COONa + H2O ÁCIDO BASE SAL ÁGUA OR' Reação de Esterificação R – COOH + R’ – OH Æ R – COOR’ + H2O Ácido álcool éster água Essa reação é catalisada por ácidos minerais fortes (H2SO4 ou HCl conc.) R C OR' H OH O + R C R'C CH R C C CR' H Reações de Desidratação H OMgX O + R'MgX R C O R C R' H H R COOH aquecim. R C R COOH P2O5 R C O + H2O O ácido Eliminação do Oxigênio da Carbonila anidrido Diácidos formam anidridos cíclicos. R CHO + H2 N R C N OH H OH + H 2O Halogenação em α Os Hidrogênios do carbono α são muito reativos e facilmente substituídos por halogênios, a quente na presença de fósforo vermelho. R C N NH2 + H2O H Reações dos Hidrogênios em posição α Os carbonos vizinhos da carbonila são denominados carbonos em posição α e são mais reativos que os demais. Podem ocorrer: - reações de substituição por halogênios. R CHO + H2N NH2 H H3C C C + Br2 OH Br Cl Cl2 H3C C C C CH3 H H2 O H3C C C C CH3 H2 H2 O O H3C C C H2 + O + HBr OH Reações de Oxi-Redução Os ácidos só se oxidam (a peróxidos – COOOH) ou se reduzem (a hidrocarbonetos) na presença de reagentes especiais. HCl -condensação aldólica. H H3C C C H2 O + H2 O C C H H REAÇÕES ORGÂNICAS – ÉSTERES O H H3C C C C C H2 H OH 2 H Hidrólise e Saponificação O O O + R C H2 H Δ Ni + H3C C Reações de Redução OH O CH3 R C H H2O ácido ou base + H3C C OH CH3 OH Podemos empregar “a catálise básica” (saponificação), usando uma base forte, como por exemplo NaOH. Ela reagirá como o ácido formado, deslocando o equilíbrio completamente para a direita. O O H3C C + CH3 + NaOH H3C C ONa O CH OH H Em geral temos: aldeído + H2 Æ álcool primário cetona + H2 Æ álcool secundário 3 Reações de Oxidação Diante de oxidantes fracos, os aldeídos se oxidam a ácidos carboxílicos. 4 Curso Prático & Objetivo Direitos Autorais Reservados O H2C O C R O HC O C R' O H2C O C R'' O H2C OH + 3 NaOH Δ catal. + HC OH Hidrólise ácida ONa O R' C ONa O R'' C ONa H2C OH O + R C O R' R'' OH H+ + O Δ Alcoólise O + R C NH3 + R C NH2 O R' R' O OH O O + 2 H2 + R C OH + R CH2OH + R'OH Amonólise O R' O O O O R C O C R Essa redução é efetuada com: - H2 e catalisador (Ni) a quente; - [H] nascente produzido pela reação do sódio com etanol; ou - hidreto de lítio e alumínio (LIAlH4) + H2N R C OH + α-halogenação O O Hidrólise: R CH2 C O + R C R C Cl + + O Cl2 R CH2 C HCl OH H OH C R H NH2 REAÇÕES ORGÂNICAS – CLORETOS DE ÁCIDOS O R'O C R H OR' Redução R C O O R C O C R amida éster O R C OH + Amonólise O + NaO C R O H ONa OH OR'' HO C R O R' + R C + Hidrólise básica R C O C R O O O R C OH H OH Alcooólise (transesterificação) O O R C O C R misturas de sais de sódio de ácidos graxos (sabões) glicerina óleo ou gordura (éster) REAÇÕES ORGÂNICAS – ANIDRIDOS R C R CH2 C O + H Cl R CH C Cl O O α ácidos Alcoólise Redução a álcoois O O Cl + HCl R C OR' H OR' OH O + R C R C LiAlH4 O ésteres R CH2 R C Amonólise H + O H OH O O O + R C R C Cl R CH2 + H NH2 HCl REAÇÕES ORGÂNICAS – AMINAS NH2 Reações de alquilação (Reações de Hoffmann) N N + R X H R H H H H amidas Reação om alcóxidos: O O + R C R C Cl + Na OR' NaCl + HX + HX amina primária amônia OR' ésteres N Fenólise O O + R C R C Cl H + R + R X H R R' HCl amina secundária OAr H OAr N H ésteres Reação com hidrogênio – redução (Reação de Rosenmund) O R C Cl + H H N H O + R C R R' + R X N R'' R R' amina terciária HCl H aldeídos 5 + HX Curso Prático & Objetivo Direitos Autorais Reservados + R''' N R'' + R''' R X Substituição no carbono vizinho ao grupo nitro a) halogenação X N R' REAÇÕES ORGÂNICAS – NITROCOMPOSTO R'' R H R' R C NO2 sal de amina quaternária + H3C C CH3 + + O H2O N OH H3C C OH + H5C2 R' R' O H NH C2H5 R C NO2 R C NO2 NH C CH3 REAÇÕES ORGÂNICAS – AMIDAS Reação de Hidrólise H N O + + OH H2O Δ + NH4 R C O - Se o carbono vizinho ao radical nitro for terciário, a reação não acontece. R' A reação deve ser feita em meio ácido ou básico. - Em meios ácidos teremos a seguir: R C NO2 - + O HCl H2O N O O NH2 O N OH H + + NH4 R C R C NO2 R C NO2 HCl O H3C C O C CH3 O Br Br NH O + R C NO2 H - Utilizando um anidrido: R C R C NO2 H O CH3 O Br Br2 b) reação com ácido nitroso Reações de Acilação - Utilizando um cloreto de ácido: O H3C C Cl + H NH O H Br2 R C OH + não reage com HNO2 R'' NH4Cl c) alquilação R–CH2–NO2 + AgOH Æ Ag(R–CH–NO2) + H2O - Em meio básico é liberado um gás (amônia) O O + NH4 R C R C + NaOH + NH4OH O ONa R' Ag(R–CH–NO2) + R’–Cl Æ R CH NO2 + AgCl Redução R–NO2 + 6 [H] Æ R–NH2 + 2 H2O NH3 + Exemplo: H2O NH2 NO2 gás O mesmo ocorre se partirmos de uma amida N-substituída, chegandose no final a uma amina (ou seu sal) no lugar de NH3 (ou do NH4Cl) REAÇÕES ORGÂNICAS – NITRILAS E ISONITRILAS + a) Nitrilas Hidrólise (origina ácidos carboxílicos) Temos inicialmente: R–CN + H2O Æ R–CONH2 Redução (produz aminas primárias): R-CN + H2 Æ R-CH=NH (imina) R-CH=NH + H2 Æ R-CH2-NH2 (amina prim.) b) Isonitrilas Hidrólise (origina ácidos carboxílicos e aminas): R-NC + 2 H2O Æ HCOOH + R-NH2 Redução (produz aminas secundárias): R-CN + H2 Æ R-N=CH2 (imina) R-N=CH2 + H2 Æ R-NH-CH3 (amina sec.) Reações de adição: R-NC + 1/2 O2 Æ R-C=N=O (isocianato) R-NC + S Æ R-C=N=S (isotiocianato) 6 Fe/HCl 6 [H] + 2 H2O
Download