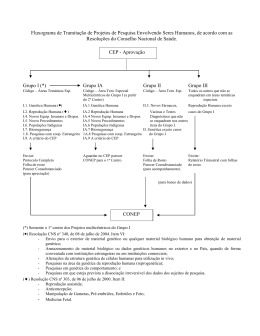
The First Latin American Pharmaceutical and Medical Device Compliance Congress Clinical Reseach in Brazil and the United States Angela Kung São Paulo, 10 de Setembro de 2012 Pesquisa Clínica no Brasil Clinical trials in Brazil • Regulamentação • Regulation • Processo de Aprovação • Approval of Processes • Principais Pontos de Atenção • Main Points of Concern Regulamentação Regulation • Regulamentação baseada na Declaração de Helsinque e CIOMS/OMS 1982 e 1993 • Regulation based on Helsink Declaration and CIOMS/OMS 1982 and 1993 • Regulada pelas seguintes autoridades: • Regulated by these authorities: – Conselho Nacional de Saúde – CNS – Agência Nacional de Vigilância Sanitária - ANVISA – Conselho Federal de Medicina – CFM – National Health Council – CNS – National Sanitary Surveillance Agency – ANVISA – Federal Council of Medicine – CFM Regulamentação Conselho Nacional de Saúde – CNS • • • Regulation National Health Council – CNS • Resoluções que estabelecem as diretrizes éticas da pesquisa clínica Resolutions setting ethical guidelines for clinical research • Sets rules for ethical approval process for protocols Define regras do processo de aprovação ética dos protocolos • Created the National Ethics Commission on Research Criou a Comissão Nacional de Ética em Pesquisa Clínica CONEP Regulamentação Regulation Agência Nacional de Vigilância Sanitária - ANVISA National Sanitary Surveillance Agency – ANVISA Regula os aspectos operacionais da pesquisa clínica Regulates operational aspects of clinical trials • • Authorizes import of investigational drugs • Regulates expanded access • Regulates Good Practices on Clinical Trials • Regulates system for notifications of adverse effects • • • Aprova os processos de importação de medicamento experimental Regula o acesso expandido Regula Boas Práticas na Pesquisa Clínica Regula sistema de notificação de evento adverso Regulamentação Regulation Conselho Federal de Medicina - CFM Federal Council of Medicine – CFM • Regula a prática dos médicos investigadores sob o ponto de vista ético • Regulates the practice of investigator physicians from the ethical point of view Processo de Aprovação Approval Process CEP CEP • • Protocolo de pesquisa deve ser submetido ao Comitê de Ética em Pesquisa (CEP) da Instituição para aprovação. The protocol must be submitted to the Ethics Committee on Research (CEP) of the institution for approval. CONEP CONEP • • Após revisão do CEP deverá ser encaminhado para aprovação da CONEP, se a pesquisa envolver área temáticas especiais ANVISA After CEP has reviewed the protocol, it must be submitted to CONEP’s approval, if the trial classified as “special areas”. ANVISA Pontos de Atenção • Áreas temáticas especiais: – genética humana ou reprodução humana; – fármacos, medicamentos, vacinas e testes diagnósticos novos (fases I, II e III) ou não registrados no país; – equipamentos, insumos e dispositivos para a saúde novos, ou não registrados no país; – novos procedimentos ainda não consagrados na literatura; – populações indígenas; – projetos que envolvam aspectos de biossegurança; – pesquisas coordenadas do exterior ou com participação estrangeira e pesquisas que envolvam remessa de material biológico para o exterior; e – projetos que, a critério do CEP, devidamente justificado, sejam julgados merecedores de análise pela CONEP. Main Points of Concern • Special areas: – human genetics and human reproduction; – new pharmaceuticals, medicines, vaccines and diagnosis tests (phases I, II and III) or drugs not registered in Brazil; – new health equipment, inputs and devices not registered in Brazil; – Indigenous population; – projects involving Biosafety; – research coordinated abroad or with foreign participation and trials that require dispatching of biological material abroad; and – project which CEP deems necessary to be reviewed by CONEP. Pontos de Atenção • • • • • • • legalidade de contrato de pesquisa clínica com entidades públicas proibição de uso de placebo em determinadas pesquisas obrigação de fornecimento do medicamento investigacional e comparador após conclusão ou encerramento da pesquisa obrigação de fornecimento de métodos anticoncepcionais para as mulheres proibição de limitação ou exclusão de responsabilidade proibição de acesso ao prontuário do sujeito pelos monitores da pesquisa morosidade no processo de aprovação Main Points of Concern • • • • • • • lawfulness of the clinical trial contracts with public entities; prohibition of use of placebo for certain trials; obligation to provide the investigational and comparator drugs after the trail is completed; obligation to provide women with contraceptive methods; prohibition to limit or exempt from liability; prohibition for the research monitors to access the subject’s medical records; slow approval process. Obrigada / Thank you! ANGELA KUNG TEL. (11) 3247 8622 [email protected]
Download