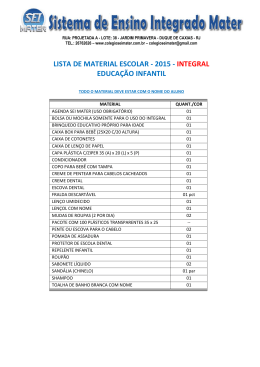
artigo original Efeito antimicrobiano de diferentes substâncias químicas associadas ao preparo mecânico e da medicação intracanal em dentes de cães portadores de lesões periapicais induzidas Frederico C. Martinho, DDS, MSc1 Luciano T. A. Cintra, DDS, MSc, PhD2 Alexandre A. Zaia, DDS, MSc, PhD3 Caio C. R. Ferraz, DDS, MSc, PhD3 José F. A. Almeida, DDS, MSc, PhD4 Brenda P. F. A. Gomes, DDS, MSc, PhD3 Resumo Objetivo: avaliar o efeito antimicrobiano de diferentes substâncias químicas auxiliares durante o preparo mecânico de canais radiculares e de uma medicação intracanal. Métodos: foram utilizadas 55 raízes de dentes de cães portadores de lesões periapicais, divididas em cinco grupos experimentais de acordo com a substância química empregada durante o preparo mecânico: GI – solução salina; GII – natrosol gel; GIII – NaOCl 2,5%; GIV – CHX 2% gel; GV – CHX 2% solução. Foram realizadas coletas microbiológicas antes (s1) e após (s2) o preparo químico-mecânico e após o emprego de uma medicação à base de hidróxido de cálcio por 14 dias (s3). Após cada coleta, as amostras foram processadas e realizadas as contagens das unidades formadoras de colônias (UFC). Resultados: em s1, a contagem de UFCs variou de 5,5 x105 a 1,5 x 106. Esses valores diminuíram significativamente (p<0,05) em s2. Não foi encontrada diferença significativa entre a coleta s2 e s3 (p>0,05). Conclusões: dentre as substâncias testadas, NaOCl 2,5% e CHX gel 2% demonstraram maior potencial antimicrobiano contra patógenos endodônticos in vivo. Palavras-chave: Hipoclorito de sódio. Clorexidina. Hidróxido de cálcio. Infecção endodôntica. Martinho FC, Cintra LTA, Zaia AA, Ferraz CCR, Almeida JFA, Gomes, BPFA. Efficacy of chemo-mechanical preparation with different substances and the use of a root canal medication in dog’s teeth with induced periapical lesion. Dental Press Endod. 2011 apr-june;1(1):37-45. Recebido: janeiro de 2011 / Aceito: fevereiro 2011. Pós-graduando- Departamento de Odontologia Restauradora, Área de Endodontia, Faculdade de Odontologia de Piracicaba – Universidade Estadual de Campinas –UNICAMP, Piracicaba, SP, Brasil. 1 2 Professor Assistente, Departamento de Odontologia Restauradora, Área de Endodontia, Faculdade de Odontologia de Araçatuba, Universidade Estadual Paulista –UNESP, Araçatuba, SP, Brasil. 3 Professor Associado, Departamento de Odontologia Restauradora, Área de Endodontia, Faculdade de Odontologia de Piracicaba – Universidade Estadual de Campinas –UNICAMP, Piracicaba, SP, Brasil. 4 Professor Assistente, Departamento de Odontologia Restauradora, Área de Endodontia, Faculdade de Odontologia de Piracicaba – Universidade Estadual de Campinas –UNICAMP, Piracicaba, SP, Brasil. © 2011 Dental Press Endodontics Endereço para correspondência: Brenda P. F. A. Gomes Área de Endodontia – Faculdade de Odontologia de Piracicaba, UNICAMP Avenida Limeira, 901 – Piracicaba, São Paulo, Brasil – CEP: 13.414-018 E-mail: [email protected] 37 Dental Press Endod. 2011 apr-june;1(1):37-45 [ artigo original ] Efeito antimicrobiano de diferentes substâncias químicas associadas ao preparo mecânico e da medicação intracanal em dentes de cães portadores de lesões periapicais induzidas Introdução A periodontite apical é uma doença infecciosa causada por microrganismos que colonizam o sistema de canais radiculares1. O sucesso do tratamento endodôntico depende da eliminação ou da redução significativa da população bacteriana presente no sistema de canais radiculares para que o processo de reparo periapical possa se estabelecer2. A atividade antimicrobiana oriunda dos procedimentos endodônticos pode ser avaliada por meio de cultura3,4,5,6,7 e de técnicas moleculares8,9. O preparo do canal radicular consiste de uma fase mecânica e uma fase química. Isso porque, devido à complexidade anatômica do sistema de canais radiculares3,4,10 e a ação restrita de instrumentos dentro do canal radicular principal, a fase mecânica não elimina as bactérias de todo o sistema de canais radiculares3,11,12, requerendo um fase química proporcionada pelo uso de potentes agentes antimicrobianos, a fim de agir profundamente nos túbulos dentinários3,4. Várias substâncias químicas auxiliares foram propostas ao longo dos anos para o preparo químico-mecânico, mas o hipoclorito de sódio (NaOCl) continua sendo a mais amplamente utilizada. Recentemente, a clorexidina (CHX) tem sido testada como uma substância alternativa ao NaOCl5,9,13,14. Comparações frente à atividade antimicrobiana das duas substâncias químicas auxiliares foram feitas in vitro13,14,16-19 sobre microrganismos selecionados. Entretanto, modelos in vitro não reproduzem o quadro real de uma infecção polimicrobiana, como a existente nos canais radiculares. Estudos in vivo apresentaram resultados inconsistentes quando compararam NaOCl e CHX, com o hipoclorito de sódio sendo mais efetivo9,20 ou sem diferença significativa existente entre eles14,15. Apesar do efeito das substâncias químicas auxiliares, uma medicação intracanal à base de hidróxido de cálcio (Ca (OH)2) tem sido recomendada com o propósito de se potencializar ainda mais o processo de desinfecção, atuando em regiões estratégicas onde as bactérias possam estar presentes4,10,21,22,23. Essa medicação é indicada principalmente em casos de ápice aberto, sintomatologia periapical e exsudato persistente. Em alguns estudos4,11,12,24 pode-se observar uma maior redução da quantidade bacteriana após a colocação de Ca(OH)2, já em outros10,21,22, ficou demonstrado um aumento de unidades formadoras de colônias (UFCs). © 2011 Dental Press Endodontics Desta forma, fica evidente a necessidade de maiores estudos relativos ao tema, a fim de prestar maiores esclarecimentos à literatura científica11,21,23,25. Além disso, a maioria dos estudos in vivo7,9,13,23 que investigaram os efeitos antibacterianos do tratamento endodôntico forneceram apenas dados quantitativos, não caracterizando o tipo de microbiota envolvida, que é fundamental para o estabelecimento de estratégias terapêuticas. Assim, o presente estudo foi conduzido para avaliar o efeito da ação da instrumentação endodôntica, do emprego de soluções químicas irrigadoras e do uso do hidróxido de cálcio sobre a microbiota presente em dentes de cães com necrose pulpar e lesão periapical. Material e métodos Seleção dos canais radiculares Foram empregadas 55 raízes de dentes de cães com lesões periapicais induzidas contendo um único canal principal. Dentes menores que 12mm e com rizogênese incompleta foram descartados. Fase de indução das lesões periapicais Todas as etapas operatórias e de coletas microbiológicas foram feitas com o uso de um microscópio clínico operatório (DF Vasconcelos, Modelo M 900, São Paulo, SP). Os animais foram anestesiados com uma injeção intravenosa de Xilazina (Rompum, Bayer S. A. Saúde Animal, São Paulo, SP - 1mg/Kg de peso corporal) e Ketamina (Francotar, Virbac do Brasil Ind. e Com. Ltda, São Paulo, SP - 15mg/Kg de peso corporal). Após anestesia, foi realizado acesso coronário com broca esférica diamantada em alta rotação sob refrigeração, as polpas dentárias foram extirpadas e limas tipo K #20 estéreis foram empregadas para arrombar o platô apical e padronizar o diâmetro do forame apical principal. Em seguida, os canais radiculares permaneceram abertos e expostos ao meio bucal por 6 meses, para permitir a contaminação microbiana. Os procedimentos experimentais foram previamente submetidos e aprovados pelo Comitê de Ética da Faculdade de Odontologia de Piracicaba – UNICAMP. Fase de tratamento e divisão em grupos Decorrido o período de indução das lesões, tomadas radiográficas foram realizadas para se confirmar sua presença e dar continuidade ao estudo. Os animais foram 38 Dental Press Endod. 2011 apr-june;1(1):37-45 Martinho FC, Cintra LTA, Zaia AA, Ferraz CCR, Almeida JFA, Gomes BPFA novamente anestesiados, os dentes em estudo foram isolados com lençol de borracha e o campo de trabalho foi desinfectado com peróxido de hidrogênio (H2O2) a 30 vol. por 30 segundos, seguido do uso do NaOCl 2,5% por mais 30 segundos. As soluções desinfetantes foram neutralizadas com tiossulfato de sódio a 5% a fim de se evitar interferência dessas com a coleta microbiológica9. Em seguida, foram coletas amostras microbiológicas com cones de papel absorventes para confirmação da condição estéril do campo de trabalho (amostras controle). Após esses procedimentos iniciais, foi realizada a cavidade de acesso com brocas diamantadas estéreis em alta rotação e sob irrigação com solução salina estéril. Antes de adentrar a câmara pulpar, a cavidade de acesso foi desinfetada pelo mesmo protocolo descrito acima e novas amostras controle foram coletadas a partir da superfície da cavidade e semeadas em placas de ágar sangue. Como critérios de inclusão, as amostras controle deviam ser negativas. Todos os procedimentos subsequentes foram realizados assepticamente. A câmara pulpar foi acessada com brocas e irrigada com solução salina estéril, que foi aspirada com cânula aspiradora. Foram realizadas 3 coletas em momentos diferentes do tratamento. A primeira delas (s1) foi obtida da seguinte forma: cinco pontas de papel estéreis foram colocadas no interior do conduto radicular, atingindo o comprimento de trabalho previamente determinado pela radiografia pré-operatória, permanecendo em posição por 1 minuto cada e, em seguida, levadas para um tubo tipo Eppendorf estéril contendo 1ml de Viability Medium Göteborg Agar (VMGA III). Em seguida, esses tubos contendo as amostras iniciais (s1) foram levados ao laboratório para o seu processamento. Após a coleta s1, os dentes foram divididos aleatoriamente de acordo com as substâncias químicas empregadas durante o preparo de canais, conforme segue: I) solução salina (SSL) (n = 11); II) natrosol gel (n = 11); III) NaOCl 2,5% (n = 11); IV) CHX gel 2% (Endogel, Itapetininga, SP, Brasil) (n = 11) e V) solução de CHX 2% (n = 11). Inicialmente, a câmara pulpar dos dentes de cada grupo foi cuidadosamente irrigada com a substância química auxiliar correspondente, os canais foram irrigados e explorados com uma lima tipo K #10 (Dentsply Maillefer, Ballaigues, Suíça). Em seguida, foram preparados os 2/3 cervicais dos canais com instrumentos rotatórios GT® Rotary #20 de conicidade 0,06 a 350rpm (Dentsply Maillefer, Ballaigues, Suíça). Na sequência, uma lima © 2011 Dental Press Endodontics tipo K #15 foi levada até o platô apical e, por meio de um localizador apical (Novapex, Fórum Technologies, Rishon Le-Zion, Israel), determinou-se o comprimento real de trabalho (comprimento do dente menos 1mm). O preparo apical foi realizado utilizando-se limas tipo K sequencialmente até o instrumento de número 40, seguido por uma instrumentação “step-back”, que terminou após o uso de três instrumentos maiores (45, 50 e 55) do que o último utilizado no preparo apical. O tempo de trabalho gasto com o preparo químico-mecânico foi em torno de 20 minutos para cada canal radicular. Nos grupos em que se empregou uma substância na forma gel, foi utilizada alternadamente a solução salina, para remoção da mesma. Na sequência, os canais eram novamente preenchidos pelo gel antes do emprego de cada instrumento. Os volumes foram padronizados em 5ml para cada substância, previamente a todos os instrumentos empregados. Nos grupos onde foram usadas substâncias à base de gel, foi empregado 1ml da mesma para preenchimento do canal e 4ml de solução salina para remoção. Após o término do preparo, tanto o hipoclorito de sódio como a clorexidina foram inativados. Para o grupo do hipoclorito de sódio, foi empregada a solução de tiosulfato de sódio a 5% por um período de 1min para inativação do mesmo. Para inativação da clorexidina, foram empregadas as soluções Tween 80 e 0,07% (w/v) de lecitina de soja. Em seguida, uma nova coleta foi realizada (s2) da mesma forma que a anterior. Após a segunda coleta (s2), os canais foram totalmente secos com cones de papel estéreis e os dentes receberam uma medicação intracanal composta de hidróxido de cálcio (Merck, Darmstad, Alemanha) e solução salina estéril inserida com auxílio de uma espiral lentulo. Em seguida, tomadas radiográficas foram realizadas para verificar o completo preenchimento dos canais. Ao final, as cavidades de acesso foram restauradas com cimento temporário Cavit™ (3M Dental Products, St. Paul, MN, EUA) e resina™ Filtek Z250 (3M Dental Products), a fim de evitar a microinfiltração coronária. Após 14 dias, os dentes foram acessados novamente de forma asséptica e a pasta de hidróxido de cálcio removida empregando-se a lima de referência (#40) e irrigação abundante com solução salina. Após a remoção da medicação, confirmada pelo microscópio clínico, uma nova coleta microbiológica foi realizada (s3). 39 Dental Press Endod. 2011 apr-june;1(1):37-45 [ artigo original ] Efeito antimicrobiano de diferentes substâncias químicas associadas ao preparo mecânico e da medicação intracanal em dentes de cães portadores de lesões periapicais induzidas Processamento laboratorial Os tubos tipo Eppendorf contendo as amostras foram imediatamente transferidos ao Laboratório de Microbiologia Endodôntica para o processamento microbiológico. No interior da câmara de anaerobiose (Don Whitley Scientific, Bradford, UK), os tubos foram agitados utilizando o vortex (MA 162, Marconi, São Paulo, SP) por 60 segundos para facilitar a dispersão dos microrganismos. Em seguida, foram realizadas diluições seriadas a 1/10, 1/100, 1/1.000 e 1/10.000, utilizando Fastidious Anaerobe Broth (FAB, Lab M, Bury, UK). Foram inoculados 50µL da amostra armazenada em VMGA III, sem diluição e das diluições 1/100 e 1/10.000 em placas pré-reduzidas contendo Fastidious Anaerobe Ágar (FAA, Lab M, Bury, UK) + 5% de sangue de carneiro desfibrinado + 600μL de Menadiona 1mg/l (Vitamin K3; 2-Methyl-1,4-naphthoquinone – SIGMA M5625) + 600μl de Hemina 1mg/l (Hemin Bovine Minimum 80% – SIGMA H5533) as quais foram incubadas na câmara de anaerobiose a 37ºC, numa atmosfera de 10% H2, 10% CO2 e 80% N2 até 14 dias, para permitir a detecção de microrganismos anaeróbios estritos de crescimento lento. Foram também inoculados 50μl da amostra original em uma placa de Brain Heart Infusion (BHI, Oxoid, Basingstoke, UK) + 5% de sangue de carneiro desfibrinado, a qual foi incubada aerobicamente em estufa a 37°C por 2 dias, para permitir o crescimento de microrganismos aeróbios ou facultativos. Após a incubação, o valor total de UFC foi contado utilizando-se uma lupa com ampliação de 16x (Zeiss, Oberkoren, Alemanha). Caracterização microbiológica A caracterização preliminar das espécies microbianas foi baseada nas características das colônias (ou seja, tamanho, cor, forma, altura, borda, superfície, textura, consistência, brilho e hemólise) visualizadas sob lupa estereoscópica (Lambda Let 2, instruments Co., Hong Kong). As bactérias isoladas foram purificadas através de subcultura. A coloração de Gram e os requerimentos gasosos foram estabelecidos após verificação do crescimento microbiano em aerobiose e anaerobiose. Baseados nas características de colônias microbianas, na coloração de Gram e nos requerimentos gasosos, foi possível determinar o perfil da microbiota dos canais radiculares em momentos diferentes (s1, s2, s3). Forma de análise dos resultados Foram realizadas comparações estatísticas de todos os grupos (I a V) nos mesmos momentos de amostragem (s1, s2, s3) e entre s1, s2 e s3 em cada % Redução bacteriana d 100% d c c c c c d s2 s3 99,5% 99% 98,5% 98% a* b 97,5% 97% 96,5% 96% 95,5% 95% Solução Salina Gel Natrosol 2,5% NaOCI CHX-gel 2% CHX-solução 2% Figura 1. Valores percentuais médios de redução bacteriana (UFC) das amostras do canal radicular obtida após instrumentação (s2) e após a medicação (s3). *Letras diferentes representam diferenças do ponto de vista estatístico (P<0,05). © 2011 Dental Press Endodontics 40 Dental Press Endod. 2011 apr-june;1(1):37-45 Martinho FC, Cintra LTA, Zaia AA, Ferraz CCR, Almeida JFA, Gomes BPFA Resultados As amostras de controle de esterilidade coletadas do dique de borracha, da coroa e suas estruturas adjacentes foram testadas antes e após o acesso à câmara pulpar, não apresentando crescimento microbiano. A média de unidades formadoras de colônias (UFC) nas amostras da primeira coleta (s1) variou de 5,5 x105 a 1,5 x 106 (Tab. 1). grupo, utilizando o teste Kruskall-Wallis para dados não-paramétricos. Quando foram encontradas diferenças significativas no teste de Kruskall-Wallis, realizou-se com o teste de Mann-Whitney as comparações a cada dois grupos, para demonstrar onde as diferenças foram localizadas. O nível de significância considerado foi de 5% (P<0,05). Tabela 1. Quantidade bacteriana em UFC de 55 canais radiculares com necrose pulpar e lesões periapicais induzidas nas amostras iniciais (s1), após a instrumentação de canais radiculares (s2) e após a medicação intracanal (s3). Solução salina (GI) Amostras s1 s2 H1 2,2 Natrosol gel (GII) s3 s1 s2 8,0 A 3,0 3,94 NaOCl 2,5% (GIII) CHX gel 2% (GIV) CHX solução 2% (GV) s3 s1 s2 s3 s1 s2 s3 s1 s2 s3 1,26 6,0 A 6,8 D A 4,0 2,0 A 4,2 D 4,0 A 2,0 A 3,6 5,8 8,0A 2,6 1,88 8,0 A 3,4 D 1,0 B 2,0 A 5,4 D 4,0 A 2,0 A 2,4 3,6 1,2B 2,46 C H2 D 8,6 1,96 C H3 4,2D 9,0B 1,66C 3,2D 2,88C 1,0B 3,8D 2,0A 2,0A 5,4D 2,0A 2,0A 6,0D 2,4C 3,92B H4 4,0 2,9 1,0 3,6 D 1,08 4,0 6,8 8,0 2,0 3,0 2,0 2,0 5,8 3,6 2,14B H5 5,2D 2,08C 1,0B 3,8D 8,6B 1,0B 4,2D 6,0A 0 H6 2,12 E 1,36 2,0 5,6 1,44 C 3,08 1,22 4,0 H7 1,78E 1,7C 1,6B 2,8D 1,16C 1,9C 8,4D H8 3,0 1,84 2,4 1,52 2,04 2,0 B H9 5,6 1,3 1,8 B 1,08 1,64 1,6 B H10 1,64E 9,0B 5,6B 4,2D 4,6B H11 1,48 1,12 2,4 6,4 Médias 9,3Da* 6,7Be 5,5Da D D C C D D B C B C B C E C 1,6Cb B D D D E E D C C C A D A A D A A D B D B D B 9,4D 2,0A 2,0A 6,2D 2,6B 6,0A 2,0 6,4 2,0 0 4,4 2,2 B 1,0B 2,0B 2,0A 3,8D 4,0B 2,0A 6,2D 2,4B 1,0B 4,8 1,2 B 2,0 4,6 C 2,0 B 2,0 5,0 6,2 1,0 B 1,66 2,0 B 1,8B 1,22E 4,0A 2,0A 1,28E 7,4 4,0 9,0 4,0 2,0 1,4Cc 5,3Be C C B C E E E A D 6,7Da A A E 7,6Ad 1,8B 1,0B 0 6,8 1,4B 4,0A 8,0A 6,0A 6,2E 2,4B 8,0A 3,0 4,0 0 3,6 1,8B 4,0B 6,4Da 3,2Ad 1,8Ad 1,5Ea 2,6Be 1,2Bd A 1,4Ad E E A 0 A A E D A A D D *Letras minúsculas diferentes, em negrito, representam diferenças do ponto de vista estatístico (p < 0,05). A =102 , B =103, C = 104 , D = 105, E = 106. Tabela 2. Frequência (em valores médios percentuais) do perfil da microbiota de canais radiculares com necrose pulpar e lesão periapical nas amostras iniciais (s1), após a instrumentação de canais radiculares (s2) e após a medicação do canal radicular (s3) de acordo com os grupos testados (GI, GII, GIII, GIV, GV). s1 s2 s3 GI GII GIII GIV GV Média GI GII GIII GIV GV Média GI GII GIII GIV GV Média Cocos gram-positivos 100 81,8 90,9 90,9 100 92,7 72,7 81,8 81,8 81,8 81,8 79,98 79,98 72,7 72,7 45,5 100 76,4 Cocos gram-negativos 27,3 72,7 63,6 36,4 72,7 54,54 54,5 18,2 27,3 0 45,5 29,1 29,1 27,3 0 0 0 7,28 Bastonetes gram-positivos 27,3 72,7 36,4 27,3 72,7 47,28 27,3 45,5 27,3 18,2 9,1 25,48 25,48 36,4 9,1 27,3 18,2 21,8 Bastonetes gram-negativos 36,4 18,2 9,1 45,5 81,8 38,2 100 90,9 54,5 45,5 100 78,18 78,18 27,3 0 18,2 0 21,8 Anaeróbios estritos 55,5 58,2 69,4 62,3 37,7 56,62 5,8 18,7 100 100 80 60,9 60,9 16,6 0 100 80 36,4 Anaeróbios facultativos 44,5 41,8 30,6 36,8 62,3 43,2 94,2 81,3 0 0 20 39,1 39,1 83,4 100 0 20 72,7 © 2011 Dental Press Endodontics 41 Dental Press Endod. 2011 apr-june;1(1):37-45 [ artigo original ] Efeito antimicrobiano de diferentes substâncias químicas associadas ao preparo mecânico e da medicação intracanal em dentes de cães portadores de lesões periapicais induzidas O perfil da microbiota nos diferentes tempos de amostragem (s1, s2 e s3), de acordo com os grupos testados (GI, GII, GIII, GIV e GV), está apresentado na Tabela 2. Em s1, não houve diferença estatisticamente significativa entre a quantidade de UFCs presente nos diferentes grupos: GI) 9,3 x 105; GII) 5,5 x 105; GIII) 6,7 x 105, GIV) 6,4 x 105 e GV) 1,5 x 106 (todos p>0,05) (Tab. 1). Esses valores diminuíram significativamente com a instrumentação químico-mecânica do canal radicular (s2): GI) 1,6 x 104, GII) 1,4 x 104, GIII) 7,6 x 102, GIV) 3,2 x 102 e GV) 2,6 x 103 (Tab. 1). A análise comparativa entre todos os valores médios de UFC nos diferentes grupos obtida em s2 demonstrou diferenças do ponto de vista estatístico entre todos os grupos (p<0,05), exceto entre GIII (NaOCl 2,5%) e GIV (CHX-gel) (p>0,05) (Tab. 1), sendo que em ambas as substâncias a carga bacteriana foi reduzida a quase 100% (Fig. 1). Após a aplicação de Ca(OH)2 durante duas semanas, foi realizada a terceira coleta (s3). Os valores médios de UFC em s3 foram menores do que aqueles no final da primeira visita (s2): GI) 6,7 x 103, GII) 5,3 x 103, GIII) 1,4 x 102, GIV) 1,8 x 102 e GV) 1,2 x 103 (Tab. 1). Após análise comparativa entre os grupos em s2 e s3, observaram-se apenas diferenças estatisticamente significativas entre os Grupos I (SSL), II (natrosol-gel) e V (CHX-solução) (p<0,05) (Fig. 1). No entanto, não houve diferença estatisticamente significativa na redução da carga bacteriana nos grupos III (NaOCl) e IV (CLX-gel) (Fig. 1) na comparação entre s2 e s3. Em contraste com s2, não houve diferença estatisticamente significativa entre a solução de CHX (GV) e hipoclorito de sódio (GIII) ou CHX gel (GIV) em s3 (p>0,05) (Tab. 1). Os valores percentuais médios de redução da carga bacteriana após instrumentação do canal radicular (s2) e medicação intracanal (s3) apresentam-se expostos na Figura 1. Em s1 observou-se microbiota mista composta predominantemente por bactérias anaeróbias estritas (Tab. 2). Em s1, houve predominância de cocos gram-positivos em todos os grupos (GI, GII, GIII, GIV e GV). Após o preparo químico-mecânico (s2), uma alta frequência de cocos gram-positivos e bastonetes gram-negativos foi encontrada. Em s3, independentemente da substância química auxiliar aplicada durante o preparo químico-mecânico, houve predominância de cocos gram-positivos em todas as amostras do canal radicular (Tab. 2). © 2011 Dental Press Endodontics Discussão No presente estudo optou-se pelo procedimento de cultura, em vez de técnicas contemporâneas (métodos moleculares)8,9 para avaliar a efetividade antimicrobiana durante os procedimentos endodônticos, devido à sua capacidade de detectar bactérias viáveis. Além disso, ao longo dos anos22,25,26 procurou-se estabelecer uma correlação entre as bactérias viáveis e o sucesso do tratamento endodôntico. A maior parte da quantidade de bactérias (mais de 97%) foi removida apenas pela instrumentação mecânica e uso de solução irrigante (solução salina). Entretanto, foram observadas as maiores médias de redução (quase 100%) quando se empregou NaOCl a 2,5% ou CHX 2% gel, demonstrando a sua potente atividade antimicrobiana contra microrganismos envolvidos nas infecções primárias do canal radicular. A carga bacteriana em canais radiculares infectados foi reduzida de 105 a 102 UFC/ml após o preparo químico-mecânico usando tanto com NaOCl 2,5% quanto com CHX gel 2%. Resultados semelhantes foram observados por Vianna et al.9, que detectaram reduções de 105 a 101 UFC/ml no grupo do NaOCl a 2,5%; e de 105 a 102 UFC/ml no grupo da CHX gel 2%. De forma semelhante, Siqueira et al.15 relataram reduções 105 a 103 UFC/ml no grupo NaOCl 2,5% e 105 a 102 UFC/ml no grupo de CHX a 0,12%. Quanto à atividade antimicrobiana, o presente estudo não encontrou nenhuma diferença significativa entre NaOCl e CHX gel como substância química auxiliar, o que está de acordo com trabalhos in vivo14,15 e in vitro13,16,19. Em contraste, Vianna et al.9 compararam a eficácia antibacteriana in vivo dessas duas substâncias através da técnica molecular (RTQ-PCR), observando que o hipoclorito de sódio a 2,5% foi mais eficaz do que a clorexidina gel a 2%. No entanto, o significado clínico na redução de DNA bacteriano de canais radiculares infectados após os procedimentos de preparo químico-mecânico permanece incerto, uma vez que as células mortas detectadas por DNA não podem implicar no insucesso do tratamento endodôntico. 42 Dental Press Endod. 2011 apr-june;1(1):37-45 Martinho FC, Cintra LTA, Zaia AA, Ferraz CCR, Almeida JFA, Gomes BPFA Parece razoável supor que o NaOCl 2,5% e a CHX gel 2% têm uma potente atividade antimicrobiana na prática clínica, e a escolha entre eles deve considerar suas propriedades particulares e individuais. A clorexidina gel possui uma atividade antimicrobiana residual que ajuda a prevenir a reinfecção do canal radicular27,28. Além disso, sua biocompatibilidade faz com com que seja a melhor escolha para dentes com ápices abertos13 e para os pacientes que são alérgicos às soluções de hipoclorito de sódio27. Por outro lado, não possui a capacidade de dissolver os tecidos orgânicos, o que é uma importante vantagem do hipoclorito de sódio29. A atividade antimicrobiana da medicação de Ca(OH)2 por 14 dias foi notável em dentes irrigados com uma substância inerte (SSL e natrosol). A redução bacteriana foi significativamente maior após a instrumentação, de 1,6 x 104 a 6,7 x 103 UFC/ml no grupo com SSL e 1,4 x 104 a 5,3 x 103 UFC/ml no grupo natrosol. No entanto, a eficácia do preparo químico-mecânico foi semelhante, mas não estatisticamente significativa, nos dentes irrigados com substância química auxiliar, ou seja, reduziu-se de 7,6 x 10 2 a 1,4 x 10 2 UFC/ml no grupo do NaOCl a 2,5%; e de 3,2 x 10 2 a 1,8 x 10 2 UFC/ml no grupo da CHX gel 2%. Apesar de diferentes períodos de aplicação de Ca(OH)2 terem sidos encontrados na literatura4,6,23,25, a maioria dos resultados sobre a redução média da quantidade bacteriana é semelhante aos do presente estudo em 14 dias, especialmente em dentes irrigados com NaOCl 2,5% e CHX gel 2%. Assim, o intervalo de valores dos percentuais de redução da carga bacteriana, que ocorre após a colocação de uma medicação de Ca(OH)2, é de 97,42% para 99,90%, corroborando com outros relatos (91,0 a 99,9%)3,11,12. Após a colocação da medicação de Ca(OH)2 por 14 dias, o número de canais radiculares com cultura negativa aumentou, enquanto em 4 amostras houve aumento no número de UFCs em comparação com os valores de s2. Alguns estudos21,22,23,30 têm demonstrado valores elevados nas contagens de bactérias após o uso do Ca(OH)2 como medicação intracanal. Essa ocorrência pode ser explicada pela presença de bactérias remanescentes nos túbulos dentinários, que poderia ficar livre da ação direta de Ca(OH)210, além do efeito © 2011 Dental Press Endodontics tampão da dentina, fatores que prejudicariam a ação do Ca(OH)2 e ocasionariam a reinfecção no espaço do canal principal. É razoável supor que a medicação de Ca(OH)2 tem pouca habilidade para promover a redução significativa da carga bacteriana na prática clínica, principalmente em dentes irrigados com NaOCl a 2,5% ou CHX gel 2%, e para ajudar a eliminar as bactérias, na maioria dos canais radiculares infectados, principalmente no canal principal. Entretanto, sua aplicação clínica não deve ser apenas com base na sua atividade antimicrobiana, mas também em suas outras propriedades, como a capacidade de alterar o pH da dentina e cemento, a capacidade de despolimerizar LPS de bactérias gram-negativas e sua ação higroscópica para eliminar exsudatos. Vale ressaltar que a eficácia dos procedimentos endodônticos não é devida apenas às propriedades antimicrobianas das substâncias químicas, mas também à suscetibilidade da microbiota presente nos canais radiculares envolvidos. Portanto, o conhecimento dessa e da sua suscetibilidade, associado a uma terapia endodôntica efetiva, é importante para alcançar a desinfecção dos canais radiculares. Independentemente da substância química auxiliar aplicada (inerte ou não) durante a instrumentação, a predominância de cocos gram-positivos e bastonetes gram-negativos foi encontrada em canais radiculares, sugerindo um potencial não-seletivo exercido pelas substâncias químicas testadas (NaOCl ou CHX). Em contrapartida, após o uso do Ca(OH) 2, a predominância de cocos gram-positivos foi observada em todas as amostras positivas do canal radicular. Esses achados devem ser considerados na prática clínica, pois os cocos gram-positivos, particularmente E. faecalis , estão frequentemente presentes em infecções persistentes do canal radicular devido ao seu alto nível de resistência ao hidróxido de cálcio. Conclusão Considerando a metodologia empregada, pode-se concluir que, independentemente da utilização do hidróxido de cálcio como medicação intracanal, o hipoclorito de sódio a 2,5% e a clorexidina gel a 2% demonstraram uma potente atividade antimicrobiana contra patógenos endodônticos in vivo. 43 Dental Press Endod. 2011 apr-june;1(1):37-45 [ artigo original ] Efeito antimicrobiano de diferentes substâncias químicas associadas ao preparo mecânico e da medicação intracanal em dentes de cães portadores de lesões periapicais induzidas Agradecimentos Agradecemos a Fernanda Barrichello Tosello, Thais Mageste Duque e Geovania Caldas Almeida pela contribuição no estudo. Este trabalho foi financiado pelas agências brasileiras FAPESP (07/58518-4, 08/582993, 08/57551-0, 08/57954-8, 10/51113-1) e CNPq (3470820/2006-3; 471631/2008-6; 302575/2009-0). Abstract Results: At s1, the mean CFU counts ranged from 5.5 x105 to 1.5 x 106. These values dropped significantly at s2 (p<0.05). Objective: To evaluate the effect of instrumentation, irriga- No statistical significant difference was found between s2 and tion with different substances and the use of calcium hydrox- s3. Changes in root canal microbiota were found at s2 and s3. ide on bacterial load and microbiota profile in dog’s teeth Conclusion: Regardless the use of calcium hydroxide as a with pulp necrosis and periapical lesion. Methods: Fifty five root canal medication, 2.5% NaOCl and 2% CHX-gel dem- root canals were divided into groups: I) Saline (SSL) (n=11); onstrated a potent antimicrobial activity against endodontic II) natrosol gel (n=11); III) 2.5% NaOCl (n=11); IV) 2% pathogens in vivo. CHX-gel (n= 11); V) 2% CHX-solution (n=11). Endodontic samples were cultured, microorganisms counted and the mi- Keywords: Sodium hypochlorite. Chlorhexidine. Calcium hy- crobiota analyzed at different sampling times, s1, s2 and s3. droxide. Endodontic infection. Root canal medication. Referências 1. Kakehashi S, Stanley HR, Fitzgerald RJ. The effects of surgical exposures of dental pulps in germ-free and conventional rats. Oral Surg Oral Med Oral Pathol 1965 Sep;30(05):340-9. 2. Takahashi K. Microbiological, pathological, inflammatory, immunological and molecular biological aspects of periradicular disease. Int Endod J. 1998;31(5):311-25. 3. Byström A, Sundqvist G. Bacteriologic evaluation of the efficacy of mechanical root canal instrumentation in endodontic therapy. Scand J Dent Res 1981;89(4):321-8. 4. Byström A, Claesson R, Sundqvist G. The antibacterial effect of camphorated paramonochlorophenol, camphorated phenol and calcium hydroxide in the treatment of infected root canals. Endod Dent Traumatol 1985;1(5):170-5. 5. Vianna ME, Horz HP, Conrads G, Zaia AA, Souza-Filho FJ, Gomes BP. Effect of root canal procedures on endotoxins and endodontic pathogens. Oral Microbiol Immunol. 2007;22(6):411-8. © 2011 Dental Press Endodontics 6. Manzur A, González AM, Pozos A, Silva-Herzog D, Friedman S. Bacterial quantification in teeth with apical periodontitis related to instrumentation and different intracanal medications: a randomized clinical trial. J Endod. 2007;33:114-8. 7. Martinho FC, Gomes BP. Quantification of endotoxins and cultivable bacteria in root canal infection before and after chemomechanical preparation with 2.5% sodium hypochlorite. J Endod. 2008;34:268-72. 8. de Souza CA, Teles RP, Souto R, Chaves MA, Colombo AP. Endodontic therapy associated with calcium hydroxide as an intracanal dressing: microbiologic evaluation by the checkerboard DNA-DNA hybridization technique. J Endod. 2005;31(2):79-83. 9. Vianna ME, Horz HP, Gomes BPFA, Conrads G. In vivo evaluation of microbial reduction after chemo-mechanical preparation of human root canals containing necrotic pulp tissue. Int Endod J. 2006;39:484-92. 44 Dental Press Endod. 2011 apr-june;1(1):37-45 Martinho FC, Cintra LTA, Zaia AA, Ferraz CCR, Almeida JFA, Gomes BPFA 10.Ørstavik D, Haapasalo M. Disinfection by endodontic irrigants and 21.Peters LB, Winkelhoff AJ Van, Buijs JF, Wesselink PR. Effects of dressings of experimentally infected dentinal tubules. Endod Dent instrumentation, irrigation and dressing with calcium hydroxide on Traumatol. 1990;6(4):142-9. infection in pulpless teeth with periapical bone lesions. Int Endod J. 11.Shuping GB, Orstavik D, Sigurdsson A, Trope M. Reduction of 2002;35:13-21. intracanal bacteria using nickel-titanium rotary instrumentation and 22.Waltimo T, Trope M, Haapasalo M, Ørstavik D. Clinical efficacy of various medications. J Endod. 2000;26(12):751-5. treatment procedures in endodontic infection control and one year 12.McGurkin-Smith R, Trope M, Caplan D, Sigurdsson A. Reduction of follow-up of periapical healing. J Endod. 2005;31:863-6. intracanal bacteria using GT rotary instrumentation, 5.25% NaOCl, 23.Siqueira JF Jr. Guimarães-Pinto T, Rôças IN. Effects of EDTA, and Ca(OH)2. J Endod. 2005;31:359-63. chemomechanical preparation with 2.5% sodium hypochlorite and intracanal medication with calcium hydroxide on cultivale bacteria in 13.Jeansonne MJ, White RR. A comparison of 2.0% chlorhexidine infected root canals. J Endod. 2007;33(7);800-5. gluconate and 5.25% sodium hypochlorite as antimicrobial 24.Sjögren U, Fidgor D, Spandberg L, Sundqvist G. The antimicrobial endodontic irrigants. J Endod. 1994;20(6):276-8. effect of calcium hydroxide as a short-term intracanal dressing. Int 14.Ercan E, Ozekinci T, Atakul F, Gul K. Antibacterial activity of 2% Endod J. 1991;24:119-25. chlorhexidine gluconate and 5.25% sodium hypochlorite in infected 25.Sjögren U, Figdor D, Persson S, Sundqvist G. Influence of infection root canal: in vivo study. J Endod. 2004;30:84-7. at the time of root filling on the outcome of endodontic treatment 15.Siqueira JF, Rôças IN, Paiva SSM, Guimarães-Pinto T, Magalhães of teeth with apical periodontitis. Int Endod J. 1997 Sep;30(5):297- KM, Lima KC. Bacteriologic investigation of the effects of sodium 306. hypochlorite and chlorhexidine during the endodontic treatment of 26.Siqueira JF Jr, Rôças IN, Riche FN, Provenzano JC. Clinical teeth with apical periodontitis. Oral Surg Oral Med Oral Pathol Oral outcome of the endodontic treatment of teeth with apical Radiol Endod. 2007;104(1):122-30. periodontitis using an antimicrobial protocol. Oral Surg Oral Med 16.Heling I, Chandler NP. Antimicrobial effect of irrigant combinations Oral Pathol Oral Radiol Endod. 2008;106(5):757-62. within dentinal tubules. Int Endod J. 1998;31(1):8-14. 27.Tanomaru M Filho, Leonardo MR, Silva LAB, Aníbal FF, Faccioli LH. 17.Vianna ME, Gomes BPFA, Berber VB, Zaia AA, Ferraz CCR, SouzaFilho FJ. In vitro evaluation of the antimicrobial activity of chlorhexidine Inflamatory response to different endodontic irrigants solutions. Int and sodium hypochlorite. Oral Surg Oral Med Oral Pathol Oral Radiol Endod J. 2002;35(9):735-9. 28.Kuruvilla JR, Kamath MP. Antimicrobial activity of 2.5% sodium Endod. 2004;97:79-84. hypoclorite and 0.2% chlorhexidine gluconate separately and 18.Gomes BPFA, Ferraz CCR, Vianna ME, Berber VB, Teixeira FB, combined, as endodontic irrigants. J Endod. 1998;24(7):472-6. Souza-Filho FJ. In vitro antimicrobial activity of several concentrations 29.Gordon TM, Dammato D, Christner P. Solvent effect of various of sodium hypoclorite and chlorhexidine gluconate in the elimination dilutions of sodium hypochlorite on vital and necrotic pulp tissue. J of Enterococcus faecalis. Int Endod J. 2001;34(6):424-8. Endod 1981;7(10):466-9. 19.Ruff ML, McClanahan SB, Babel BS. In vitro antifungal efficacy of four 30.Ørstavik D. Radiographic evaluation of apical periodontitis and irrigants as a final rinse. J Endod. 2006;32(4):331-3. endodontic treatment results: a computer approach. Int Dent J. 20.Ringle AM, Patterson SS, Newton CW, Miller CH, Mulherm JM. In vivo 1991;41(2):89-98. evaluation of chlorhexidine gluconate solution and sodium hypochlorite solution as root canal irrigants. J Endod. 1982;8(5):200-4. © 2011 Dental Press Endodontics 45 Dental Press Endod. 2011 apr-june;1(1):37-45
Download