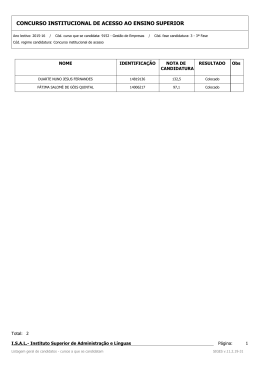
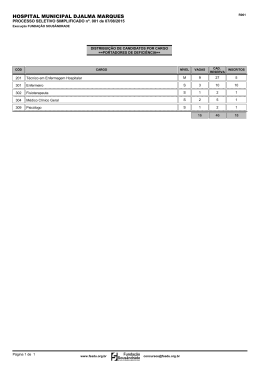
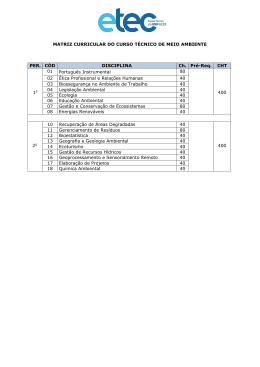
CÓDIGO: DATA DE APROVAÇÃO: Ver: Pg.: PT-LB-BQ-021 22/10/2015 03 1/6 CONTROLE DE COPIA: PROTEÍNA TOTAL 1. INTRODUÇÃO As proteínas são elementos básicos e essenciais ao funcionamento de todas as células e tecidos, tendo papel importante no desenvolvimento do organismo. Compõem a parte estrutural da maior parte dos órgãos e formam as enzimas e hormônios que regulam o funcionamento do organismo. A quantificação das proteínas totais determina grosseiramente todas as proteínas presentes na porção do plasma sanguíneo, sendo que no sangue encontram-se duas classes de proteínas, a albumina e as globulinas. A albumina é transportador de muitas moléculas pequenas, mas o seu principal objetivo é evitar a perda de líquido dos vasos sanguíneos através da pressão osmótica. As globulinas incluem enzimas, anticorpos de 500 outras proteínas. A relação da albumina com a globulina (relação A/G) calcula-se a partir dos valores obtidos na determinação direta das proteínas totais e da albumina. Essa relação representa as quantidades relativas de albumina e globulinas. 2. NOME DO TESTE E SINONÍMIAS Proteínas Totais, Proteinemia 3. ABRANGÊNCIA Setor de Imunoquímica 4. PRINCÍPIO DO MÉTODO As proteínas do soro reagem com o biureto (íons cobre) desenvolvendo coloração roxa, proporcional à concentração protéica da amostra. 5. APLICAÇÃO CLÍNICA A determinação das proteínas totais em amostras de sangue e outros líquidos biológicos é útil para avaliar o estado nutricional e as alterações protéicas nas doenças. A dosagem isolada da proteína total tem pouco valor, porque a alteração em uma das frações pode ser compensada por alteração oposta de outra fração, como ocorre nas doenças crônicas, em que há diminuição de albumina com aumento de gamaglobulina. O contrário pode ser observado em respostas de fase aguda, tais como infecções ou traumas, ocasião em que muitas proteínas plasmáticas derivadas do fígado aumentam de concentração, enquanto a albumina reduz, mantendo a concentração protéica inalterada. As proteínas estão aumentadas em algumas neoplasias, especialmente no mieloma múltiplo; macroglobulinemia; doenças autoimunes, como a artrite reumatóide e LES; doenças granulomatosas, como a sarcoidose; leishmaniose visceral; endocardite bacteriana sub-aguda e linfogranuloma; em alguns casos de doença hepática crônica, como hepatite autoimune e na desidratação. As proteínas estão diminuídas na gravidez; hiperhidratação; desnutrição grave; cirrose e outras doenças hepáticas, incluindo alcoolismo crônico; imobilização prolongada; insuficiência cardíaca; nefrose e insuficiência renal; hipertireoidismo; deficiência de cálcio e vitamina D e na síndrome de má absorção. A dosagem de proteína no líquido sinovial tem sensibilidade de 52% e especificidade de 56% nas doenças inflamatórias. A determinação da concentração de proteínas no líquido pleural é de pouco valor, exceto quando combinada com outros parâmetros que permitam diferenciar exudato de transudado. Em 15 a 20% ELABORADOR: APROVADOR: VALIDAÇÃO DA QUALIDADE: Fernanda Seixas Anderson Alvim Márcia Patrícia ESTE DOCUMENTO É UMA COPIA CONTROLADA, SOMENTE VÁLIDO NA FORMA ELETRÔNICA CÓDIGO: DATA DE APROVAÇÃO: Ver: Pg.: PT-LB-BQ-021 22/10/2015 03 2/6 CONTROLE DE COPIA: PROTEÍNA TOTAL dos indivíduos com hepatopatias apresentam ascite com dosagem de proteína superior a 2,5 g/dl. Em pacientes com ascite de etiologia neoclássica, tem-se o contrário. 6. AMOSTRA a) Tipo de amostra: O soro ou o plasma com heparina/citrato/EDTA e líquidos cavitários são os tipos de amostra recomendados para este ensaio. b) Quantidade mínima de amostra necessária: Quantidade ideal de 1,0mL e mínima de 0,5mL. c) Restrições e critérios para rejeição de amostras: Amostras que apresentarem hemólise, lipemia, icterícia excessiva e/ou transporte inadequado serão rejeitadas e uma nova amostra será solicitada. d) Condições de acondicionamento das amostras inclusive seu período de guarda: 2 a 8 °C por quatro dias. e) Procedimentos de tratamento ou pré-tratamento da amostra: NÃO SE APLICA. f) Preparo do paciente: Conforme Pop Orientações de preparo e coleta de amostras biológicas (cód. PO-LB-CO-005). g) Transporte da amostra: Vide o PO Manuseio de Transporte de Amostras Biológicas (cód. PO-LB-CO-006). 7. BIOSSEGURANÇA Utilizar o EPI (Equipamento de Proteção Individual) comum a toda área técnica sendo eles: jaleco, luva, pro-pé e touca, conforme descrito no PO Orientações de Biossegurança (Cód. PO-LB-CQ-001) em vigor. 8. MATERIAIS E EQUIPAMENTOS a) Equipamentos ADVIA 1800 – Siemens. Centrifuga ELABORADOR: APROVADOR: VALIDAÇÃO DA QUALIDADE: Fernanda Seixas Anderson Alvim Márcia Patrícia ESTE DOCUMENTO É UMA COPIA CONTROLADA, SOMENTE VÁLIDO NA FORMA ELETRÔNICA CÓDIGO: DATA DE APROVAÇÃO: Ver: Pg.: PT-LB-BQ-021 22/10/2015 03 3/6 CONTROLE DE COPIA: PROTEÍNA TOTAL b) Materiais Pipetas automáticas e ponteiras c) Reagentes: Kit Proteínas totais REF N. B01-4601-01 Reagente 1 e 2:: Prontos para uso OBS: 1) Os reagentes são estáveis até 3 dias entre 2 – 8º C e 7 dias a 10º C negativos.Todos os reagentes, calibradores e controles devem estar a temperatura ambiente para serem usados; conter a data de recebimento no setor e a data de abertura para uso, com a rubrica do colaborador responsável; 2) os materiais e reagentes acima mencionados são solicitados ao responsável pelo almoxarifado. A rastreabilidade dos produtos do Almoxarifado deve ser registrada no formulário Rastreabilidade de Produtos/Reagentes (cod.LAB-017-VR01). 9. CALIBRAÇÃO De acordo com o PE de Operação do ADVIA 1800 (Cód. PE-LB-IQ-002). A calibração deve ser realizada quando houver troca de lote do calibrador, troca de lote do reagente, de acordo com o especificado pelo fabricante, ou sempre que os limites de tolerância dos controles forem ultrapassados, necessitando de calibração e ajuste. 10. CONTROLE DE QUALIDADE a) Controle de qualidade interno Conforme descrito no plano da qualidade do setor Imunoquímica (Cód. PQ-LB-IQ-001). b) Controle de qualidade externo Conforme descrito no plano da qualidade do setor Imunoquímica (Cód. PQ-LB-IQ-001). 11. PROCEDIMENTO Ver procedimento de operação do ADVIA 1800 (Cód. PE-LB-IQ-002). a)Limites de Detecção/Sensibilidade: 2,0 g/dL b)Linearidade: 12,0 g/dL. c) Intervalo reportável (CRR): 2,0 a 12,0 g/dL. Diluir a amostra até obter resultado dentro da linearidade. A diluição deve ser feita com água destilada e repetir a medição. O valor encontrado deve ser multiplicado pelo fator utilizado. d) Valores críticos: > 10,0 g/dL ou < 4,0 g/dL e) Especificidade: não se aplica ELABORADOR: APROVADOR: VALIDAÇÃO DA QUALIDADE: Fernanda Seixas Anderson Alvim Márcia Patrícia ESTE DOCUMENTO É UMA COPIA CONTROLADA, SOMENTE VÁLIDO NA FORMA ELETRÔNICA CÓDIGO: DATA DE APROVAÇÃO: Ver: Pg.: PT-LB-BQ-021 22/10/2015 03 4/6 CONTROLE DE COPIA: PROTEÍNA TOTAL f) Carryover: Verificação do sistema interno de pipetagem, escolha de um soro alterado e analito seguido da passagem do branco. Peridiocidade de 6 em 6 meses procedimento descrito no formulário Controle de Carryover do Equipamento (cód. LAB-093-VR01). 12. CÁLCULO A dosagem de proteínas totais engloba tanto as globulinas como a albumina. Para obtenção da concentração plasmática de globulina faz o seguinte calculo: Resultado da dosagem de Proteínas totais - Resultado da dosagem da albumina = Globulinas. Pt – A= G 13. REGISTRO DOS RESULTADOS Resultados interfaceados e armazenados pelo sistema Centralink, conforme POP SOFTWARE ADVIA CENTRALINK (cód. PO-LB-CT-002). 14. PROCEDIMENTOS EM CASOS DE RESULTADOS ANORMAIS Verificam-se dados clínicos, medicamentos e histórico do paciente. Se necessário o ensaio é repetido e informa-se no laudo analítico que o resultado foi repetido e confirmado na amostra. Comunicar ao médico que solicitou por via telefônica, os resultados discrepantes e anotar no formulário Programa de Diagnóstico Laboratorial Baseado em Evidências (cód. LAB-121-VR01). 15. VALORES DE REFERÊNCIA Plasma e soro: 6,4 a 8,3 g/dL ADVIA CHEMISTRY PROTEINA TOTAL REAGENT, instruções de uso. SIEMENS HEALTHCARE DIAGNOSTIC 16. INTERFERÊNCIAS – COMENTÁRIOS Os fatores pré analíticos devem ser seguidos para garantia da exatidão do exame. O tempo de jejum deve ser rigorosamente seguido, uma vez, que a alimentação pode expressar uma elevação dos limites séricos. A realização de questionário prévio, pode identificar os elementos pré-analicos que podem interferir nos resultados. Problemas técnicos que possam ocorrer na realização da rotina dos exames devem ser analisados conforme informações no plano da qualidade do setor de Bioquímica. Sempre que necessário os resultados serão analisados de acordo com a indicação clinica e/ou história do paciente. 17. DOCUMENTOS DE REFERÊNCIA a) Bibliografia ELABORADOR: APROVADOR: VALIDAÇÃO DA QUALIDADE: Fernanda Seixas Anderson Alvim Márcia Patrícia ESTE DOCUMENTO É UMA COPIA CONTROLADA, SOMENTE VÁLIDO NA FORMA ELETRÔNICA CÓDIGO: DATA DE APROVAÇÃO: Ver: Pg.: PT-LB-BQ-021 22/10/2015 03 5/6 CONTROLE DE COPIA: PROTEÍNA TOTAL RAVEL, Richard M.D. Aplicações clínicas dos dados laboratoriais. 6. ed. Guanabara Koogan: Rio de Janeiro, 1997. POP Cod PT-LB-BQ 398, Versão 001. Elaborado em 14/08/13 por Leandro Lago e Revisado por Anderson Alvin Henry JB. Clinical Diagnosis and Management by Laboratory Methods, Philadelphia: W.B. Saunders Company, 1996; 525-527. ADVIA CHEMISTRY PROTEINA TOTAL REAGENT, instruções de uso. SIEMENS HEALTHCARE DIAGNOSTIC. b) Documentos Complementares Manual do equipamento automatizado Bula do kit PO de Orientação de Preparo e Coleta de Amostras Biológicas (Cód. PO-LB-CO-005). PO Manuseio de Transporte de Amostras Biológicas (Cód. PO-LB-CO-006). PO de Orientações de Biossegurança (Cód. PO-LB-CQ-001) Plano da qualidade do setor de Imunoquimica (Cód. PQ-LB-IQ-001) PE de Operação do ADVIA 1800 (Cód. PE-LB-IQ-002). PO Software ADVIA Centralink (Cód. PO-LB-CT-002). 18. HISTÓRICO DE REVISÕES Pg. Natureza da Revisão Data da Revisão Versão Responsáveis 1/2 Inclusão do equipamento ADVIA 1800 14/08/2013 01 Leandro Lago 1-3 Pop recodificado, codificação anterior PO-LB-BQ-398 14/08/2013 01 Ana Regina e Márcia Patrícia 1-5 Procedimento adequado para atender ao item 5.3 da Norma PALC, versão 2013 01/08/2014 02 Fernanda Seixas Procedimento adequado para atender ao item 5.3 da Norma PALC, versão 2013 Após Pré auditoria. 02/01/2015 03 Fernanda Seixas 22/10/2015 03 Luciana Calmon 1-6 1-6 Procedimento revisado e sem alterações. 19. REGISTRO DE TREINAMENTO DATA NOME COMPLETO ASSINATURA ELABORADOR: APROVADOR: VALIDAÇÃO DA QUALIDADE: Fernanda Seixas Anderson Alvim Márcia Patrícia ESTE DOCUMENTO É UMA COPIA CONTROLADA, SOMENTE VÁLIDO NA FORMA ELETRÔNICA CÓDIGO: DATA DE APROVAÇÃO: Ver: Pg.: PT-LB-BQ-021 22/10/2015 03 6/6 CONTROLE DE COPIA: PROTEÍNA TOTAL ELABORADOR: APROVADOR: VALIDAÇÃO DA QUALIDADE: Fernanda Seixas Anderson Alvim Márcia Patrícia ESTE DOCUMENTO É UMA COPIA CONTROLADA, SOMENTE VÁLIDO NA FORMA ELETRÔNICA
Download