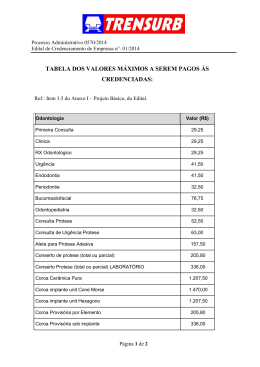
META BIO INDUSTRIAL LTDA. AVENIDA TRINTA E SETE N.º 1.907 - ESTÁDIO - RIO CLARO - SP C EP.: 13501-460 TEL.: (0XX 19) 3535-5300 C.N.P.J/M.F 02.513.989/0001-62 INSTRUÇÕES DE USO PRÓTESE MODULAR PARA ARTROPLASTIA NÃO CONVENCIONAL - META BIO ( PRÓTESE ORTOPÉDICA NÃO CONVENCIONAL ) 2.2. INFORMAÇÕES DE IDENTIFICAÇÃO DO PRODUTO: A Prótese Modular para Artroplastia Não Convencional - Meta Bio é composta por: Haste de Fixação, Módulo Intermediário, Joelho Articulado e Módulo Trocantérico. A Haste de Fixação tem formato de um cilindro alongado, em uma extremidade tem um cone com o qual se interliga com os componentes, na outra extremidade tem diâmetro com paredes paralelas que, introduzidas no canal intramedular, permite, com a ajuda de cimento ósseo, fixar o conjunto ao mesmo, é apresentado nas dimensões: Diâm.: 8 a 13 e Compr.: 45, 70, 95 e 130 mm. O Módulo Intermediário tem formato cilíndrico, em uma extremidade tem um cone “macho” ou “fêmea” e na outra um cone “fêmea” ou “macho”, serve como elemento intermediário substituindo a parcela da diáfise óssea removida. Visando permitir ao cirurgião a escolha do componente mais adequado, o mesmo é apresentado em 3 dimensões: Compr.: 25, 50 e 100 mm. O Joelho Articulado substitui a articulação do joelho mimetizando o mesmo na aparência e nas dimensões. É constituído por dois componentes principais que se articulam em torno de um eixo de giro tendo dois pontos de parada: um no momento de máxima extensão e outro na flexão. Por esses detalhes não é necessária a preservação de nenhum dos ligamentos, tanto os cruzados como os laterais/mediais. É produzido nas dimensões: Med.: 40 e 48 mm. O Módulo Trocantérico tem formato semelhante à porção proximal, nele será afixada a cabeça permitindo a reconstituição da junta. Todos os componentes são fabricados em Aço Inoxidável (ASTM F-138 e NBR ISO 5832-1 )( o Joelho Articulado apresenta Polietileno de Ultra-Alto Peso Molecular (UHMW)(ASTM F-648 e NBR ISO 5834-2) entre seus componentes rotacionais). A Prótese Modular Para Artroplastia Não Convencional - Meta Bio é constituída por: Haste de Fixação, Módulo Intermediário, Joelho Articulado e Módulo Trocantérico, é utilizado conforme anatomia do paciente. Os componentes da Prótese Modular para Artroplastia Não Convencional - Metas Bio são embalados em duas embalagens de Papel Grau Cirúrgico, a etiqueta com as informações do produto é fixada na embalagem em contacto com o produto e ambas as embalagens são seladas, para garantir a esterilidade, de acordo com a NBR 13386:95. A Prótese Modular Para Artroplastia Não Convencional - Meta Bio é indicada para os casos de cirurgias ortopédicas (Oncológicas), traumatológicas, na reposição de articulações ósseas, artrite de bacia causada por enfermidade reumática em conjunto com enfermidade degenerativa, artrite pós-traumática, artrite pós-infecciosa, necrose avascular, e artrite advinda de outras causas etiológicas raras. A prótese tem como finalidade à substituição total do fêmur incluindo a articulação do joelho em caso de cirurgia oncológica. A variação das medidas dos componentes permite ao cirurgião escolher o mais adequado a cada caso, obtendo assim encaixe e adaptação perfeitos. Este produto é projetado de forma a transmitir a carga e permitir movimentos sob tensão e estabilização da estrutura óssea, conforme indicação médica. A ilustração abaixo mostra o conjunto dos componentes da Prótese Modular para Artroplastia Não Convencional - Meta Bio. 47 META BIO INDUSTRIAL LTDA. AVENIDA TRINTA E SETE N.º 1.907 - ESTÁDIO - RIO CLARO - SP C EP.: 13501-460 TEL.: (0XX 19) 3535-5300 C.N.P.J/M.F 02.513.989/0001-62 2.2.1. APRESENTAÇÕES: A Prótese Modular para Artroplastia Não Convencional - Meta Bio mostra o conjunto dos componentes sendo a mesma fabricada de acordo com o desenho. Seus tamanhos não podem ser alterados. 2.2.2. FORMAS DE COMERCIALIZAÇÂO: Os componentes da Prótese Modular para Artroplastia Não Convencional – Meta Bio serão fabricados e comercializados individualmente em embalagem estéril. A embalagem será composta pelos seguintes itens: 48 META BIO INDUSTRIAL LTDA. AVENIDA TRINTA E SETE N.º 1.907 - ESTÁDIO - RIO CLARO - SP C EP.: 13501-460 TEL.: (0XX 19) 3535-5300 C.N.P.J/M.F 02.513.989/0001-62 5. A primeira e segunda embalagem é de Papel Grau Cirúrgico de selagem direta (Filme laminado de Poliéster e Polipropileno). 6. Etiqueta de Identificação. 7. A terceira embalagem, caixa externa, feita de Papel Triplex 400 gramas. 8. Etiqueta de Identificação de Esterilização por Óxido de Etileno ou Radiação Gama. Modelo da Etiqueta de Identificação. Produto: MÓDULO INTERMEDIÁRIO Código: xxxxxxx Quant: 01 Reg ANVISA No 800034760003 Lote: Data: Validade: Advertência/Precauções, etc “Ver Instruções de Uso” Processo OX. ETIL Resp. Téc. Engo Raimundo M. Peña CREA 0600491910 PRODUTO DE USO ÚNICO ESTÉRIL META BIO INDUSTRIAL LTDA. Av 37, no 1907-Rio Claro-SP-CEP 13501-460 Fone/Fax: 55-19-3533-9399 – www.metabio.com.br CNPJ 02.513.989/0001-62 – Ind. Brasileira Etiqueta de Identificação para produtos esterilizados por Óxido de Etileno Produto: MÓDULO INTERMEDIÁRIO Código: xxxxxxx Quant: 01 Reg ANVISA No Lote: Data: Validade: Advertência/Precauções, etc “Ver Instruções de Uso” Processo R.GAMA Resp. Téc. Engo Raimundo M. Peña CREA 0600491910 PRODUTO DE USO ÚNICO ESTÉRIL META BIO INDUSTRIAL LTDA. Av 37, no 1907-Rio Claro-SP-CEP 13501-460 Fone/Fax: 55-19-3533-9399 – www.metabio.com.br CNPJ 02.513.989/0001-62 – Ind. Brasileira Etiqueta de Identificação para produtos esterilizados por Radiação Gama O produto será identificado com as etiquetas (conforme modelo acima), tanto na parte externa da caixa quanto na parte interna. Também irá conter as etiquetas de esterilidade. Etiquetas de Identificação de Esterilidade. As etiquetas que indicam a esterilidade do produto é parte fundamental, pois indicam que o produto foi submetido à esterilização por Oxido de Etileno ou Radiação Gama, estando assim pronto para ser comercializado. Antigo modelo de identificação de esterilidade Indicador químico de esterilização (Óxido de Etileno) Não exposto à radiação gama Indicador químico de esterilização (Radiação Gama) 49 Após exposição à radiação gama META BIO INDUSTRIAL LTDA. AVENIDA TRINTA E SETE N.º 1.907 - ESTÁDIO - RIO CLARO - SP C EP.: 13501-460 TEL.: (0XX 19) 3535-5300 C.N.P.J/M.F 02.513.989/0001-62 2.7. CONDIÇÕES ESPECIAIS DE ARMAZENAMENTO / CONSERVAÇÃO / MANIPULAÇÃO: O produto deve se mantido em sua embalagem individual até o momento do uso com os devidos cuidados da área médico-hospitalar. O produto deve ser conservado em temperatura ambiente, evitando o seu armazenamento em lugares úmidos. Inspecionar a embalagem, de qualquer produto esterilizado para garantir sua integridade estrutural, antes do uso. Se estiver danificada, o produto deverá ser assumido como não esterilizado. O produto estará acondicionado em embalagem de papel grau cirúrgico, etiquetado e selado, para garantir a esterilidade. A embalagem não deve ser violada. Deve ser mantido em sua embalagem original até o momento do uso. O tipo de embalagem na qual os componentes são acondicionados permite fácil transporte e armazenamento sempre que necessário. O estoquista armazena os materiais, após a aprovação do R.I.Q.G. (registro de inspeção na qualidade garantida). Os implantes são embalados, transportados e armazenados em ambiente limpo, arejado em local seco a uma temperatura ambiente e não devem ser deixadas à ação de intempéries, em prateleiras identificadas, respeitando o empilhamento, e respeitando o sistema peps (primeiro que entra é o primeiro que sai), tendo como referência data do vencimento da esterilização. O armazenamento dos produtos nas prateleiras deve ser de tal maneira que facilite a visualização do empregador. Todas as embalagens são identificadas com etiquetas que informam validade da esterilização, código do produto, número do registro do produto no Ministério da Saúde, lote, responsável técnico e dados da empresa. A manipulação deverá ser feita apenas por pessoas devidamente especializadas na área médica. 2.8. INSTRUÇÕES PARA USO DO PRODUTO: A Prótese Modular para Artroplastia Não Convencional – Meta Bio é destinada para cirurgias ortopédicas (Oncológicas) e para traumatológicas, sendo que cada componente apresenta variações nas suas características e dimensões, sendo de competência do cirurgião a escolha as peças com características mais apropriadas, após a análise do caso de cada paciente. As cirurgias devem ser conduzidas por profissional médico com conhecimento tanto da técnica cirúrgica quantos dos aspectos mecânicos e metalúrgicos do implante ortopédico. É de competência do cirurgião informar todos os cuidados pós-operatórios, a fim de se atingir os resultados desejados. O paciente deverá ser informado: - das limitações do implante; - de que deverá comunicar – a todo médico que solicite um exame de Ressonância Nuclear Magnética – que possui um implante; - de que um dos aspectos mais importantes na recuperação pós-operatória é o de seguir as instruções de seu médico. Ao usar implantes cirúrgicos, o cirurgião deve considerar os seguintes aspectos: 1. É extremamente importante à correta seleção do implante. A adequada seleção do tamanho, formato e projeto do implante aumentam a possibilidade de êxito na consolidação de uma fratura. O tamanho e a forma dos ossos humanos limitam o tamanho e a robustez dos implantes. Não se deve esperar que um implante suporte os esforços máximos de uso do corpo humano. Mesmo as próteses exigem uma localização cuidadosa e um suporte ósseo adequado e seu uso restringem-se a esforços funcionais limitados. 2. A correta manipulação do implante é extremamente importante. A dobra de material metálico deve ser evitada ao máximo. Se necessária, não deve ser feita de forma aguda, no sentido inverso à curvatura, nem tampouco golpeando ou deixando riscos. Todos esses procedimentos podem produzir defeitos no acabamento da superfície, podendo acarretar concentração de pressões internas e eventualmente quebra do implante. 3. Nenhum implante metálico pode ser usado novamente. Todo implante metálico já utilizado deverá ser descartado. Ainda que, aparentemente, esteja em perfeitas condições, poderá ter 50 META BIO INDUSTRIAL LTDA. AVENIDA TRINTA E SETE N.º 1.907 - ESTÁDIO - RIO CLARO - SP C EP.: 13501-460 TEL.: (0XX 19) 3535-5300 C.N.P.J/M.F 02.513.989/0001-62 fissuras microscópicas e prévias concentrações internas de pressões que provocarão sua fratura. Recomendamos que se usem somente implantes novos e de projetos atualizados. 4. O cuidado pós-operatório é importante. O paciente deverá ser instruído quanto as limitações do seu implante e aos perigos de pressões excessivas do corpo sobre o mesmo até que haja uma completa consolidação do osso. Todos os cuidados e precauções devem ser observados, antes que qualquer procedimento. 2.9. PRECAUÇÕES DE USO: Para que o ortopedista possa implantar a Prótese Modular Para Artroplastia Não Convencional Meta Bio é importante que conheça bem a anatomia da região e esteja familiarizado com a técnica cirúrgica. Se o paciente tem um trabalho ou atividade que implique de forma importante levantar objetos deve ser orientado de sua limitação pelo médico ortopedista. Infecção exposta é uma absoluta contra indicação. Instabilidade grave subseqüente a ausência de integridade do ligamento colateral e osteoporose também são casos de contra indicação. Perda de musculatura ou enfermidade neuromuscular comprometendo o membro afetado torna o procedimento injustificável (exemplo: ausência de músculo, ligamentos suportando a estrutura, neuropatia das juntas). Uma artrodesis dolorosa e estável numa posição funcional favorável pode ser uma relativa contraindicação. Pacientes com artrite reumática (AR) têm sido apontados como os de maior risco de infecção pós-operatória, especialmente os homens. O uso de esteróide em pacientes com artrite reumática também pode aumentar o risco de infecção. Infecções tardias em pacientes com artrite reumática têm sido reportadas em 24 meses ou mais após a operação. O acompanhamento contínuo de fontes de fontes de infecção novas ou recorrentes e a administração preventiva de antibiótico durante qualquer procedimento operativo devem ser continuados ao longo do tempo que o aparelho estiver colocado. A mais alta incidência de falha de implante tem ocorrido em paraplégicos, pacientes com paralisia cerebral e paciente com doença de Parkinson, e tais pacientes devem ser prevenidos deste risco. O Manuseio e a colocação da prótese serão realizados exclusivamente por profissionais especializados da área médico-hospitalar, e de acordo com as normas e praticas hospitalar adequada a cada caso. Todas as embalagens são identificadas com etiquetas que informam validade da esterilização, código do produto, número do registro do produto no Ministério da Saúde, lote, responsável técnico e dados da empresa. Precauções quanto ao manuseio dos produtos devem ser tomadas, já que estes não devem sofrer qualquer tipo de choque mecânico, pois pode comprometer a qualidade do implante. É importante que os implantes sejam manipulados de maneira adequada, já que qualquer lesão ou alteração do implante pode provocar tensões e ocasionar defeitos que iniciem insucessos do mesmo. Os pacientes jovens, ativos, obesos e, sobretudo com expectativas funcionais não realistas apresentam índices mais elevados de falência do implante. Os pacientes candidatos a implantes devem ser informados sobre as potencialidades do implante e o impacto que este terá no seu estilo de vida. Nunca reutilize um implante. Embora ele possa parecer não danificado, os esforços precedentes podem ter criado imperfeições que poderiam reduzir a vida útil do implante. 2.9.1. ADVERTÊNCIAS: Artigo Médico Hospitalar - Uso Único Produto Estéril. Esterilizado à Óxido de Etileno OU Radiação Gama. Obs.: Os produtos deste registro fabricados em polietileno, neste caso o módulo proximal de tíbia e o joelho articulado, não devem ser esterilizados por Radiação Gama. Todo implante, uma vez usado, tem que ser descartado. Inclusive quando aparente estar danificado, já que pode ter pequenos defeitos e zonas de tensão internas que podem causar falhas do implante por fadiga. O produto deve ser mantido em sua embalagem original até o momento de seu uso, com devidos cuidados da área médico-hospitalar. Se a embalagem estiver danificada, o produto deverá ser assumido como não esterilizado. 2.9.2. RESTRIÇÕES DE USO: 51 META BIO INDUSTRIAL LTDA. AVENIDA TRINTA E SETE N.º 1.907 - ESTÁDIO - RIO CLARO - SP C EP.: 13501-460 TEL.: (0XX 19) 3535-5300 C.N.P.J/M.F 02.513.989/0001-62 Pacientes que tenham suporte ósseo inadequado. Uso Único - nenhum implante deve ser utilizado novamente. Ainda que, aparentemente, estejam em perfeitas condições o implante poderá conter pequenas fissuras ou defeitos nas áreas de tensão interna, podendo levar à ruptura por fadiga. Recomenda-se que sejam utilizados somente implantes novos. Desprezar o produto caso a embalagem esteja violada. Apenas o cirurgião poderá decidir sobre a retirada do implante. Retorne todas as embalagens com falhas na barreira estéril ao fornecedor. Não Reesterilize. Condições que sobrecarregam a extremidade afetada: obesidade, trabalho/esporte pesado, jovem, histórico de quedas, abuso de drogas e álcool e outras inabilidades. Pacientes com sintomas sugestivos de infecção, histórica ou sinais assim como local inflamado, abscessos, febre, aumento da taxa de sedimentação do sangue, evidências de rápida destruição da articulação não devem ser tratados a menos que uma infecção pré-operatória seja eliminada. O médico ortopedista deverá instruir o paciente das limitações do seu implante e dos perigos das pressões excessivas exercidas pelo corpo sobre o implante, até que haja uma adequada consolidação do osso. 2.9.3. ESTADO PATOLÓGICO DO PACIENTE: Certas doenças degenerativas ou condições fisiológicas anormais, como diabetes, artrite reumatóide, tumores, doenças degenerativas ou osteoporose, podem alterar o processo de regeneração óssea e ligamentar e, conseqüentemente, o risco de ruptura do implante. 2.9.4. CONSIDERAÇÕES GERAIS: O paciente deve ser informado e alertado sobre as limitações da e da necessidade de limitar o peso e a atividade física para proteger dos esforços desnecessários. Seleção imprópria da prótese, localização incorreta da implantação ou fixação inadequada da prótese e de seus componentes podem resultar, em condições de estresse anormal, numa subseqüente redução da vida útil da prótese e de seus componentes. Para a utilização segura e eficaz deste sistema, o cirurgião deve estar completamente familiarizado, com todo instrumental e com todos os procedimentos anteriores à cirurgia. A técnica cirúrgica a ser utilizada deve ser indicada pelo cirurgião. Este deve considerar sua experiência médica e escolher a técnica mais adequada para cada paciente. Assim sendo, a META BIO não recomenda uma técnica cirúrgica geral para todos os pacientes, pois isto deve ser feito segundo as referências do cirurgião. Contudo algumas precauções podem ser adotadas para maximizar a utilização e sucesso da implantação: Terapia profilática com antibióticos; Utilização de sala limpa com sistema de fluxo laminar para filtração do ar para a cirurgia; Proteção dos instrumentais cirúrgicos ao ar contaminado; Utilização de roupas e mascaras apropriada para todas as pessoas presentes na sala cirúrgica. Drapejamento impermeável. É aconselhável fazer um acompanhamento radiográfico durante o pós-operatório, com a finalidade de comparar a situação pós-operatória inicial e detectar evidências em longo prazo relacionadas com mudanças na posição afrouxamentos ou fissuras dos componentes. 2.9.5. CUIDADOS ESPECIAIS: Manter o produto em sua embalagem original, até o momento de seu uso. Nenhum implante pode ser usado novamente ainda que aparentemente esteja em perfeitas condições. Pacientes que são jovens, fisicamente ativos, pesados ou sobre peso podem por uma demanda pesada ou incomum sobre o implante, que pode produzir cargas, e que pode levar a uma falha prematura da prótese. 2.9.6. CONTRA-INDICAÇÕES: As condições seguintes constituem contra-indicações para: 52 META BIO INDUSTRIAL LTDA. AVENIDA TRINTA E SETE N.º 1.907 - ESTÁDIO - RIO CLARO - SP C EP.: 13501-460 TEL.: (0XX 19) 3535-5300 C.N.P.J/M.F 02.513.989/0001-62 Infecção ativa local ou sistêmica. Perda da musculatura, comprometimento neuromuscular ou deficiência vascular do membro afetado que tomam o procedimento injustificável. Má qualidade óssea, tal como na osteoporose, em que, na opinião do cirurgião, se poderá produzir uma migração considerável da prótese ou uma possibilidade significativa de fratura e/ou ausência de osso adequado para suportar o implante ou implantes. Doença de charcot ou Doença de paget. NOTA: não se estabeleceu que a diabetes, se presente, seja uma contra-indicação. Contudo, devido ao maior risco de complicações tais como Infecção, cicatrização lenta da ferida, etc., o médico deve ponderar cuidadosamente se será aconselhável à prótese de um doente com diabetes graves. O implante não será tão forte, tão seguro ou tão durável quanto uma articulação humana natural. O peso e o nível de atividade do paciente terão um impacto significativo na vida útil de qualquer implante. O implante pode não durar o resto da vida do paciente, nem é dada qualquer garantia de que dure. O paciente deve ser informado sobre todas as limitações do pós-operatório e sobre a possibilidade do implante se desgastar, falhar ou ter de ser substituída. Existem maiores probabilidades de ocorrerem complicações e ou falência da prótese em: - Pacientes com expectativas funcionais não realistas. - Pacientes obesos. - Pacientes com ossos delgados. - Pacientes fisicamente ativos. 2.9.7. POSSÍVEIS ADVERSIDADES: Sensibilidade ou hipersensibilidade aos materiais do implante ou reação a corpo estranho. Dores ou desconforto no membro ou local operado. Danos aos tecidos, necrose óssea ou de tecidos moles provocados pela cirurgia. 2.9.8. CUIDADOS PRÉ-OPERATÓRIOS: Antes da intervenção, o cirurgião deve tomar alguns cuidados pré-operatórios como o planejamento da cirurgia, com vista a uma seleção e um dimensionamento adequados dos componentes do implante, assim como a um posicionamento correto do implante no osso. A preparação pré-operatória auxilia a determinar: Antecipadamente o tamanho do implante. O centro de rotação da prótese. Que todos os componentes necessários para o implante estejam disponíveis. Que existam condições operatórias altamente assépticas. Que os instrumentos próprios para a implantação estejam completos e em devidas condições para poderem ser utilizados. Que toda a documentação de informação sobre os componentes do implante, os instrumentos necessários para a implantação e a técnica de operação estejam presentes, e que o cirurgião e a equipe cirúrgica tenham tomado devido conhecimento da mesma. 2.9.9. EFEITOS ADVERSOS: Enquanto o tempo de vida útil dos componentes de substituição é difícil de ser estimada, e determinada. Estes componentes são colocados dentro do corpo para o potencial de restauração e mobilidade ou redução da dor. Entretanto, devidos a muitos fatores biológicos, mecânicos e físicoquímicos, mas não podem ser avaliados in vivo, os componentes não podem ser esperados que estejam indefinidamente dentro dos níveis e cargas de um osso saudável normal. Deslocamento da Prótese Modular para Artroplastia Não Convencional - Meta Bio pode ocorrer devido a atividades inapropriadas ou outras considerações biomecânicas. Pacientes que são jovens, fisicamente ativos, pesados ou sobre peso podem por uma demanda pesada ou incomum sobre o implante, que pode produzir cargas, e que pode levar a uma falha prematura da prótese. 53 META BIO INDUSTRIAL LTDA. AVENIDA TRINTA E SETE N.º 1.907 - ESTÁDIO - RIO CLARO - SP C EP.: 13501-460 TEL.: (0XX 19) 3535-5300 C.N.P.J/M.F 02.513.989/0001-62 2.9.10. ESTERILIZAÇÃO: As embalagens de todos os produtos estéreis devem ser inspecionadas contra falhas na barreira estéril antes da abertura. Na presença de uma possível falha, o produto deve ser assumido como não estéril. Se a embalagem está aberta, mas o produto não está usado, o componente não deve ser reesterilizado e deve ser descartado ou retornado ao fornecedor. 2.9.11. EFEITOS SECUNDÁRIOS INDESEJÁVEIS: Sensibilidades ao material e reações alérgicas pós-operatórias podem ocorrer. 2.9.12. DESCARTE DE PRODUTO DESQUALIFICADO: Em caso de embalagem danificada ou vencimento do prazo de validade, o produto deve ser descartado, seguindo as boas práticas de descarte hospitalar. 2.9.13. RISCO DE DESCARTE DE PRODUTO DESQUALIFICADO, IMPACTO/CONSEQÜÊNCIA DO DESCARTE INDEVIDO: Como o produto é um material, pertencente à classe III de resíduos conforme NBR 10001 / NBR 10007, não apresenta riscos e conseqüentemente impacto ao meio quando houver descarte indevido. 3.2. DESEMPENHO PREVISTO NOS REQUISISTOS DA REGULAMENTAÇÃO ANVISA, QUE DISPÕES SOBRE OS REQUISITOS ESSENCIAIS DE SEGURANÇA E EFICÁCIA DE PRODUTOS MÉDICOS RDC Nº 56/01, BEM COMO QUAISQUER EVENTUAIS EFEITOS SECUNDÁRIOS INDESEJÁVEIS: O produto para saúde deve ser projetado e fabricado de forma que seu uso não comprometa o estado clínico e a segurança dos pacientes, nem a segurança e saúde dos operadores ou, quando for o caso, de outras pessoas, quando usados nas condições e finalidades previstas. Os possíveis riscos existentes devem ser aceitáveis em relação ao benefício proporcionando ao paciente e devem ser reduzidos a um grau compatível com a proteção à saúde e a segurança das pessoas. O implante tem a finalidade de formar uma estrutura física com a função de estabilizar. 3.2. (a) Indicação e finalidade ou uso a que se destina o produto. A Prótese Modular Para Artroplastia Não Convencional - Meta Bio é indicada para os casos de cirurgias ortopédicas (Oncológicas), traumatológicas, na reposição de articulações ósseas, artrite de bacia causada por enfermidade reumática em conjunto com enfermidade degenerativa, artrite pós-traumática, artrite pós-infecciosa, necrose avascular, e artrite advinda de outras causas etiológicas raras. A prótese tem como finalidade à substituição total do fêmur incluindo a articulação do joelho em caso de cirurgia oncológica. A variação das medidas dos componentes permite ao cirurgião escolher o mais adequado a cada caso, obtendo assim encaixe e adaptação perfeitos. Este produto é projetado de forma a transmitir a carga e permitir movimentos sob tensão e estabilização da estrutura óssea, conforme indicação médica. 3.2. (b) Efeitos secundários ou colaterais indesejáveis e contra-indicações: 3.2. (b1) Podendo haver efeitos secundários ou colaterais indesejáveis como: Retardo da consolidação podendo levar a soltura ou ruptura do implante. Ruptura ou soltura do implante pode ser originada por não seguir as orientações solicitadas após o pós-operatório ou em sua reabilitação. Pode também ocorrer sensibilização ao metal ou uma reação alérgica devido à presença de corpo estranho. Encurtamento do membro. Diminuição na densidade óssea, dor desconforto devido à presença do implante. Lesões de nervos devido ao trauma cirúrgico, necroses ósseas e alterações vasculares. O produto para saúde, fornecido em estado estéril deve ser projetado, fabricado e embalado em embalagem não reutilizável ou segundo procedimentos apropriados, de maneira que estejam estéreis no 54 META BIO INDUSTRIAL LTDA. AVENIDA TRINTA E SETE N.º 1.907 - ESTÁDIO - RIO CLARO - SP C EP.: 13501-460 TEL.: (0XX 19) 3535-5300 C.N.P.J/M.F 02.513.989/0001-62 momento de sua comercialização e que mantenham esta qualidade e condições previstas de armazenamento e transporte, até que a embalagem protetora que garante a esterilidade seja violada ou aberta. O produto para saúde fornecido em estado estéril devem ser fabricado e esterilizado por métodos apropriados e validados. A embalagem ou rotulagem do produto para saúde deve permitir que se distingam claramente e a simples vista o produto idêntico ou similar em suas formas de apresentação, estéril. E devem possuir desempenho atribuído pelo fabricante e executar suas funções conforme especificadas pelo fabricante. 3.2. (b2) Contra-Indicações: As condições seguintes constituem contra-indicações para: Infecção ativa local ou sistêmica. Perda da musculatura, comprometimento neuromuscular ou deficiência vascular do membro afetado que tomam o procedimento injustificável. Má qualidade óssea, tal como na osteoporose, em que, na opinião do cirurgião, se poderá produzir uma migração considerável da prótese ou uma possibilidade significativa de fratura e/ou ausência de osso adequado para suportar o implante ou implantes. Doença de charcot ou Doença de paget. NOTA: não se estabeleceu que a diabetes, se presente, seja uma contra-indicação. Contudo, devido ao maior risco de complicações tais como Infecção, cicatrização lenta da ferida, etc., o médico deve ponderar cuidadosamente se será aconselhável à prótese de um doente com diabetes graves. O implante não será tão forte, tão seguro ou tão durável quanto uma articulação humana natural. O peso e o nível de atividade do paciente terão um impacto significativo na vida útil de qualquer implante. O implante pode não durar o resto da vida do paciente, nem é dada qualquer garantia de que dure. O paciente deve ser informado sobre todas as limitações do pós-operatório e sobre a possibilidade do implante se desgastar, falhar ou ter de ser substituída. Existem maiores probabilidades de ocorrerem complicações e ou falência da prótese em: - Pacientes com expectativas funcionais não realistas. - Pacientes obesos. - Pacientes com ossos delgados. - Pacientes fisicamente ativos. 3.5. INFORMAÇÕES ÚTEIS PARA EVITAR RISCOS DECORRENTES DE IMPLANTAÇÃO: As condições mínimas as quais os implantes devem ser implantados para minimizar os riscos decorrentes de implantação são: - Devem ser implantados somente por profissionais habilitados conforme referencia no item “Instrução para o uso”. - Implantados em casos de necessidade de estabilização: trauma, tumores, doenças degenerativas, deformidades ou pseudoartrose. - O procedimento deve ser realizado em hospitais com a estrutura de equipamentos e de recursos humanos mínimos necessários, definidos pelo cirurgião responsável pelo procedimento, para não colocar em risco o paciente, o procedimento, o cirurgião, seu assistente e pessoal do hospital. - Os cirurgiões, usuários dos implantes, não estão sujeitos a nenhuma situação ou condição em que os implantes possam gerar risco durante o procedimento, caso a instrução de uso, principalmente quanto ao manuseio e esterilização seja seguida. 3.5.1. DESCARTE DO IMPLANTE: 55 META BIO INDUSTRIAL LTDA. AVENIDA TRINTA E SETE N.º 1.907 - ESTÁDIO - RIO CLARO - SP C EP.: 13501-460 TEL.: (0XX 19) 3535-5300 C.N.P.J/M.F 02.513.989/0001-62 Nenhum implante deve ser reutilizado, isto é re-implantado, pois podem gerar falhas por fadiga no material ou gerar outros riscos. Com objetivo de prevenir o uso indevido do implante já utilizado, removido do paciente após o uso, recomenda-se que o implante seja descartado, uma vez que não há necessidade de ser submetido à análise. Recomenda-se que sejam deformados através de modeladores, ou retorcedores até estar claramente identificado que o implante está impróprio para o seu uso e então descartado em lixo hospitalar no próprio hospital, onde ocorrer à remoção do implante, seguindo procedimento hospitalar. Quando o implante for submetido à análise após ser removido do paciente, deve-se proceder em conformidade com a NBR ISO 12891-1 “Remoção e Análise de Implante Cirúrgico - Parte 1 - Remoção e Manuseio de 03/03”. - PROCEDIMENTOS PARA RASTREABILIDADE DO PRODUTO PÓS-IMPLANTAÇÃO: Produtos Acabados Distribuídos: Os produtos Distribuídos ao mercado poderão ser identificados pelo seu rótulo anexado a sua embalagem (POP–106) ou pela gravação no corpo do produto (POP–103), no caso de violada a embalagem, essa gravação possuirá o código do produto, o logotipo da empresa e o lote de fabricação sempre que possível. Produtos Distribuídos: Para os produtos Distribuídos a sua identificação será dada através de seu rotulo, onde as informações sobre o código do produto, número de lote de fabricação e outras descritas no POP-106 estão registradas internamente, ao distribuir esses produtos ao mercado serão registrados, os números dos lotes de fabricação nas notas fiscais de venda, pelo departamento de vendas conforme explica o POP-109, “distribuição”. Para se rastrear esses produtos nos clientes, a companhia envia, aos seus clientes, um Formulário de Registro de Distribuição para cada Nota Fiscal emitida, e esse formulário conterá as seguintes informações: - Razão Social do Distribuidor; CNPJ do Distribuidor; Código dos produtos; Descrição de cada lote de produto enviado na Nota Fiscal; Lote de Fabricação para todos os produtos da Nota Fiscal; Quantidade distribuída de cada lote de produto; Número do Registro do produto na ANVISA. Nome do paciente e número da Autorização de Internação Hospitalar para cada lote revendido pelo distribuidor; Número do Conselho Regional de Medicina (CRM) e o nome do Médico que utilizou cada produto revendido pelo distribuidor; Data de revenda, pelo distribuidor, de cada lote dos produtos da Nota Fiscal enviada. Os produtos distribuídos serão rastreados sempre pelo seu número de lote que será igual ao número da Ordem de Fabricação que o gerou. Deve-se exigir que o hospital tenha o cadastro dos distribuidores que fornecem os implantes ortopédicos para o mesmo. Identificar compulsoriamente no prontuário do paciente, o material a ser implantado no mesmo. Resgate das Informações de Lote: O Responsável pelo Rastreamento de lotes, deverá: 56 - No Departamento de Vendas: Resgatar a segunda via da Nota Fiscal de venda do lote; Pedir para que providencie uma cópia do Formulário de Registro de Distribuição onde o lote em questão foi vendido. - No Departamento de Sistema da Qualidade: Resgatar a Ordem de Fabricação (Of) do lote; META BIO INDUSTRIAL LTDA. AVENIDA TRINTA E SETE N.º 1.907 - ESTÁDIO - RIO CLARO - SP C EP.: 13501-460 TEL.: (0XX 19) 3535-5300 C.N.P.J/M.F 02.513.989/0001-62 O Registro de Inspeção na Qualidade Garantida; O Laudo de Esterilização, quando o produto for estéril; Certificado de Qualidade da embalagem; Ficha de Entrada e Saída (FES) do lote do componente; Ocorrências de Não Conformidades (ONC) quando houver; Registro de Inspeção de componente (RIC); Certificado de Qualidade do Fornecedor do componente; Certificado de Contra Prova, quando houver; Nota Fiscal do Fornecedor do componente. Demais documentos do Sistema da Qualidade (Procedimentos Operacionais Padrão utilizados na época de fabricação do lote, Certificados de Calibração dos Instrumentos de Medição e outros dependendo da necessidade) IMPORTANTE: Todos os documentos e registros compilados para o resgate das informações de lotes, não poderão ser retirados da companhia e deverão ser arquivados, após seu uso, nos locais de onde foram retirados. Quando o número do lote a ser rastreado for um re-trabalho, o responsável pelo Rastreamento de lote deverá, além dos documentos acima mencionados, resgatar a Ordem de Retrabalho (OR). Quando se tratar de lotes com documentos antigos, além dos documentos acima mencionados, deverá ser resgatado o RIP. Nos lotes atuais as informações do RIP estão contidas na própria OF. A instituição, no momento do recebimento, deve proceder a conferência da documentação fiscal e a avaliação dos produtos, verificar as condições das embalagens, da acomodação e do transporte. Verificar as condições de embalagem e identificação do número de lote (possibilitar a rastreabilidade). Proceder da mesma forma em relação ao material de reposição. Caso constate alguma incorreção, registrar a ocorrência formalmente, por escrito, e informar ao responsável técnico do centro de materiais, ao setor de controle da documentação fiscal da instituição e ao diretor técnico. 57 META BIO INDUSTRIAL LTDA. AVENIDA TRINTA E SETE N.º 1.907 - ESTÁDIO - RIO CLARO - SP C EP.: 13501-460 TEL.: (0XX 19) 3535-5300 C.N.P.J/M.F 02.513.989/0001-62 ARTIGO MÉDICO HOSPITALAR - USO ÚNICO ESTÉRIL E S T E R I L I Z A D O A Ó X I D O D E E T I L E N O ( E T O ) OU R A D I A Ç Ã O G A M A (R) Outras informações Fabricado e distribuído por: Meta Bio Industrial Ltda. Endereço: Av. 37, nº. 1907 – Bairro do Estádio – Rio Claro/SP – Brasil CEP: 13.501-360 Fone/Fax: (55-19) 3535-5300 CNPJ: 00.513.989/0001-62 Responsável Técnico: Fabricio Belini – CREA: 5061741384 Registro ANVISA nº.: 80034760003 Revisão: 02 Emissão: 12/03/2013 ALERTA INSTRUÇÃO DE USO Estas INSTRUÇÕES DE USO são disponibilizadas em formato não impresso, através do endereço eletrônico do fabricante www.metabio.com.br. As INSTRUÇÕES DE USO estão indexadas no site através do NÚMERO REGISTRO/ CADASTRO ANVISA e respectivo NOME COMERCIAL do produto, informados no rótulo do produto adquirido. Todas AS INSTRUÇÕES DE USO disponibilizadas no website possuem a identificação da revisão e data de emissão do documento. Sendo que o usuário deve atentar-se para a correta versão (revisão e data de emissão) do documento em relação à DATA DE FABRICAÇÃO informada no rótulo do produto adquirido. Caso seja de interesse do usuário, as INSTRUÇÕES DE USO poderão ser fornecidas em formato impresso, sem custo adicional. Sendo que a solicitação das mesmas deverá ser realizada junto ao SAC (Serviço de Atendimento ao Cliente) do fabricante, informado a seguir: Serviço de Atendimento ao Cliente Telefone: +55 19 3535-5300 FAX: +55 19 3535-5308 http://www.metabio.com.br Avenida 37, 1907 – Bairro Estádio CEP: 13501-460 | Rio Claro – São Paulo – Brasil 58 META BIO INDUSTRIAL LTDA. AVENIDA TRINTA E SETE N.º 1.907 - ESTÁDIO - RIO CLARO - SP C EP.: 13501-460 TEL.: (0XX 19) 3535-5300 C.N.P.J/M.F 02.513.989/0001-62 Horário de atendimento: 8hs às 17hs, de segunda à sexta-feira, exceto feriados. 59
Download