EXERCÍCIOS DE FIXAÇÃO
1. Os dias dos carros com luzes azuis estão contados, pois, desde 1º de janeiro de 2009, as
lâmpadas de xenônio (Xe), não podem mais ser instaladas em faróis convencionais.
Mesmo que as lâmpadas azuis possibilitem três vezes mais luminosidade do que as
convencionais, elas não se adaptam adequadamente aos refletores feitos para o uso com
lâmpadas convencionais, podendo causar ofuscamento à visão dos motoristas que trafegam
em sentido contrário e possibilitando, assim, a ocorrência de acidentes.
Quantos elétrons o gás xenônio apresenta na camada de valência?
a) 2
b) 6
c) 8
d) 10
e) 18
2. Sobre a evolução do modelo atômico, afirma-se:
I. De acordo com os postulados de Bohr, os elétrons emitem energia quando saltam de um
estado energético para outro mais interno.
II. Após a descoberta da radioatividade, Rutherford propôs que o átomo é maciço, esférico,
descontínuo e formado por um fluido com carga positiva, no qual estão dispersos os
elétrons.
III. Thomson realizou experimentos com tubos catódicos que permitiram concluir que o
átomo é formado por duas regiões distintas: o núcleo e a eletrosfera.
IV. Segundo Dalton, a matéria constitui-se de pequenas partículas esféricas, maciças e
indivisíveis denominadas átomos.
São corretas apenas as proposições
a) I e II.
b) I e IV.
c) II e III.
d) III e IV.
3. Leia o poema apresentado a seguir.
Pudim de passas
Campo de futebol
Bolinhas se chocando
Os planetas do sistema solar
Átomos
Às vezes
São essas coisas
Em química escolar
LEAL, Murilo Cruz. Soneto de hidrogênio. São João del Rei: Editora UFSJ, 2011.
O poema faz parte de um livro publicado em homenagem ao Ano Internacional da
Química. A composição metafórica presente nesse poema remete
a) aos modelos atômicos propostos por Thomson, Dalton e Rutherford.
b) às teorias explicativas para as leis ponderais de Dalton, Proust e Lavoisier.
c) aos aspectos dos conteúdos de cinética química no contexto escolar.
d) às relações de comparação entre núcleo/eletrosfera e bolinha/campo de futebol.
e) às diferentes dimensões representacionais do sistema solar.
4. O último elétron de um átomo neutro apresenta o seguinte conjunto de números
quânticos: n = 3; = 1; m = 0; s = +1/2. Convencionando-se que o primeiro elétron a
ocupar um orbital possui número quântico de spin igual a +1/2, o número atômico desse
átomo é igual a:
a) 15
b) 14
c) 13
d) 17
e) 16
5. Os radioisótopos são hoje largamente utilizados na medicina para diagnóstico, estudo e
tratamento de doenças. Por exemplo, o cobalto - 60 é usado para destruir e impedir o
crescimento de células cancerosas. O número de prótons, de nêutrons e de elétrons no
3
nuclídeo 60
são, respectivamente:
27 Co
a) 33, 27 e 24
b) 27, 60 e 24
c) 60, 33 e 27
d) 27, 33 e 27
e) 27, 33 e 24
6. Comemora-se, neste ano de 2011, o centenário do modelo atômico proposto pelo físico
neozelandês Ernest Rutherford (1871-1937), prêmio Nobel da Química em 1908. Em 1911,
Rutherford, bombardeou uma finíssima lâmina de ouro com partículas alfa, oriundas de
uma amostra contendo o elemento químico polônio.
De acordo com o seu experimento, Rutherford concluiu que
a) o átomo é uma partícula maciça e indestrutível.
b) existe, no centro do átomo, um núcleo pequeno, denso e negativamente carregado.
c) os elétrons estão mergulhados em uma massa homogênea de carga positiva.
d) a maioria das partículas alfa sofria um desvio ao atravessar a lâmina de ouro.
e) existem, no átomo, mais espaços vazios do que preenchidos.
7. Um elemento representativo tem sua configuração eletrônica de camada de valência
5s2 5p2 .
Sobre este elemento, afirma-se:
I. seu cátion bivalente tem configuração de camada de valência 5s2 5p4 ;
II. seu ponto de fusão é mais alto do que o do elemento que tem camada de valência
6s2 6p2 ;
III. tem caráter metálico maior do que o do elemento que tem camada de valência 5s2 5p5 .
É correto apenas o que se afirma em
a) I.
b) I e II.
c) II.
d) II e III.
e) III.
8. Um laboratório brasileiro desenvolveu uma técnica destinada à identificação da origem
de “balas perdidas”, comuns nos confrontos entre policiais e bandidos. Trata-se de uma
munição especial, fabricada com a adição de corantes fluorescentes, visíveis apenas sob luz
ultravioleta. Ao se disparar a arma carregada com essa munição, são liberados os
pigmentos no atirador, no alvo e em tudo o que atravessar, permitindo rastrear a trajetória
do tiro.
Adaptado de MOUTINHO, Sofia. À caça de evidências. Ciência Hoje, maio, 24-31, 2011.
Qual dos modelos atômicos a seguir oferece melhores fundamentos para a escolha de um
equipamento a ser utilizado na busca por evidências dos vestígios desse tipo de bala?
a) Modelo de Dalton.
b) Modelo de Thompson.
c) Modelo de Rutherford-Bohr.
d) Modelo de Dalton-Thompson.
e) Modelo de Rutherford- Thompson.
9.) “O processo de emissão de luz dos vagalumes é denominado bioluminescência, que
nada mais é do que uma emissão de luz visível por organismos vivos. Assim como na
luminescência, a bioluminescência é resultado de um processo de excitação eletrônica, cuja
fonte de excitação provém de uma reação química que ocorre no organismo vivo”. A partir
da informação do texto, pode-se concluir que o modelo atômico que representa a luz
visível dos vagalumes é o
a) Rutheford.
b) Bohr.
c) Thomson.
d) Heiserberg.
10. O filme “Homem de Ferro 2” retrata a jornada de Tony Stark para substituir o metal
paládio, que faz parte do reator de seu peito, por um metal atóxico. Após interpretar
informações deixadas por seu pai, Tony projeta um holograma do potencial substituto, cuja
imagem se assemelha à figura abaixo.
Essa imagem é uma representação do modelo de
a) Rutherford.
b) Thomson.
c) Dalton.
d) Bohr.
11. O silício, elemento químico mais abundante na natureza depois do oxigênio, tem
grande aplicação na indústria eletrônica. Por outro lado, o enxofre é de importância
fundamental na obtenção do ácido sulfúrico. Sabendo-se que o átomo 14Si28 é ISÓTONO
de uma das variedades isotópicas do enxofre, 16S, pode-se afirmar que este átomo tem
número de massa
a) 14
b) 16
c) 30
d) 32
e) 34
12. O lixo atômico de uma fábrica de material nuclear contém os elementos radioativos
urânio e tório. Considere a seguir, as representações desses elementos:
I - 92U238
II - 92U234
III - 90Th230
IV - 90Th234
Constituem um par de isóbaros:
a) I e II.
b) I e III.
c) II e III.
d) II e IV.
e) III e IV.
13. EUA BUSCAM SAÍDA ECOLÓGICA PARA O LIXO DA INFORMÁTICA.
Washington - O Governo americano e a indústria de informática juntaram esforços para
projetar um "computador verde", totalmente reciclável e com baixo consumo de energia.
Com esse projeto os EUA vão tentar resolver um dos seus maiores problemas ambientais,
que são os dez milhões de computadores que vão anualmente para o lixo. Esses
equipamentos, que a evolução tecnológica torna rapidamente obsoletos, têm componentes
tóxicos como o chumbo para a proteção eletromagnética, o arsênico dos circuitos
integrados, o cádmio, o mercúrio, o fósforo, o boro e plásticos não recicláveis.
("O Globo") - 22/09/94
O texto refere-se ao problema ecológico causado pela presença de alguns elementos
químicos nos computadores, tais como o chumbo, o cádmio, o mercúrio, o fósforo e o
boro.
a) Classifique cada um desses seis elementos como metal, ametal ou semi-metal.
b) Dois desses elementos estão localizados no mesmo grupo da Tabela Periódica. Qual
entre os dois apresenta menor eletronegatividade? Justifique sua resposta.
14. Os átomos 7x+10A e 3x+4B são isótopos. O átomo A tem 66 nêutrons. Assinale, entre as
opções a seguir, a posição no quinto período da classificação periódica do elemento que
apresenta como isótopos os átomos A e B.
a) grupo IB
b) grupo IIB
c) grupo IIIA
d) grupo IIIB
e) grupo IVA
15. Os elementos I, II e III têm as seguintes configurações eletrônicas em suas camadas de
valência:
I: 3s2 3p3
II: 4s2 4p5
III: 3s2
Com base nestas informações, assinale a alternativa "errada".
a) O elemento I é um não-metal.
b) O elemento II é um halogênio.
c) O elemento III é um metal alcalino terroso.
d) Os elementos I e III pertencem ao terceiro período da Tabela Periódica.
e) Os três elementos pertencem ao mesmo grupo da Tabela Periódica.
16. Considere os elementos a seguir e assinale a opção correta:
(I) 19K40
(II) 8O16
(III) 18Ar40
(IV) 8O17
(V) 17Cℓ37
(VI) 8O18
(VII) 20Ca40
a) I e III são isótopos; II, IV e VI são isóbaros.
b) III e VII são isóbaros; V e VII são isótonos.
c) II, IV e VI são isótopos; III e VII são isótonos.
d) II e III são isótonos; IV e VI são isóbaros.
e) II e IV são isótonos; V e VII são isóbaros.
17. Associar os números das regiões da tabela periódica esquematizada a seguir com:
a) os metais alcalinos,
b) os não-metais,
c) os gases nobres,
d) os metais de transição.
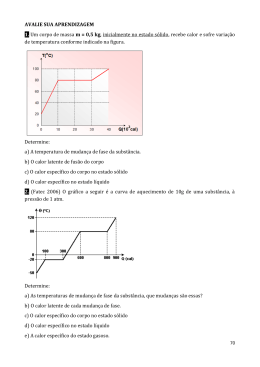
18. A figura representa a curva de aquecimento de uma amostra, em que S, L e G
significam, respectivamente, sólido, líquido e gasoso. Com base nas informações da figura
é CORRETO afirmar que a amostra consiste em uma
a) substância pura.
b) mistura coloidal.
c) mistura heterogênea.
d) mistura homogênea azeotrópica.
e) mistura homogênea eutética.
19. A adição de cloreto de sódio à água reduz o seu ponto de congelamento devido ao
efeito crioscópico. A presença de 23,3% de NaC s na água pode reduzir o seu ponto de
congelamento a 21,1°C, formando entre ambos uma mistura eutética. Se NaC sólido for
adicionado ao gelo acima dessa temperatura, parte desse gelo se fundirá e ocorrerá a
dissolução do sal adicionado. Se mais sal for adicionado, o gelo continuará a fundir. Essa é
uma prática comum, utilizada para remover o gelo das ruas das cidades em que neva no
inverno.
(PERUZZO, F. M; CANTO, E. L. Química: na abordagem do cotidiano. v. 2. FísicoQuímica. 4. ed. São Paulo: Moderna, 2006. – Texto adaptado.)
Assinale a alternativa na qual a curva de aquecimento da mistura eutética citada acima está
corretamente representada.
Legenda: S=Sólido; L=Líquido, G=Gasoso.
a)
b)
c)
d)
e)
20. Uma outra técnica utilizada é a secagem de alimentos em estufas. Nesse processo, a
umidade é retirada gradativamente devido ao fluxo de ar quente. De um modo caseiro,
todos podem construir uma estufa para secagem de alimentos tal qual a desenhada a seguir.
(Imagem seccionada de uma estufa, mostrando o interior da câmara de aquecimento e o
interior da câmara de secagem onde são colocados os alimentos.)
Pensando nessa técnica, assinale a alternativa cujas palavras completam, correta e
respectivamente, a afirmação a seguir.
Nessa estufa, o ar frio é aquecido na câmara de aquecimento e é levado até os alimentos
por __________, extraindo a água por __________.
a) condução – ebulição
b) condução – evaporação
c) convecção – ebulição
d) convecção – evaporação
e) irradiação – calefação
21. Os compostos orgânicos possuem interações fracas e tendem a apresentar temperaturas
de ebulição e fusão menores do que as dos compostos inorgânicos. A tabela apresenta
dados sobre as temperaturas de ebulição e fusão de alguns hidrocarbonetos.
Substância
metano
propano
eteno
propino
TE (ºC)
-162
- 42
-104
-23
TF (ºC)
-182
-188
-169
-101
Na temperatura de –114 ºC é correto afirmar que os estados físicos em que se encontram os
compostos, metano, propano, eteno e propino, são, respectivamente,
a) sólido, gasoso, gasoso e líquido.
b) líquido, sólido, líquido e sólido.
c) líquido, gasoso, sólido e líquido.
d) gasoso, líquido, sólido e gasoso.
e) gasoso, líquido, líquido e sólido.
22. Um frasco de amostra contendo três substâncias químicas, A, B e C, foi enviado a um
laboratório químico para ser analisado. O rótulo apresenta os seus pontos de fusão (P.F.) e
pontos de ebulição (P.E.) à pressão de 1 atm conforme o quadro a seguir:
Substância
A
B
C
P.F. ºC
- 114
43
- 218
P.E. ºC
78
182
- 183
A primeira medida tomada pelo técnico químico foi determinar o estado físico das
substâncias à temperatura de 25 ºC. A conclusão a que ele chegou em relação às
substâncias, respectivamente, de cima para baixo foi:
a) líquido, sólido, gasoso.
b) sólido, gasoso, líquido.
c) sólido, líquido, gasoso.
d) líquido, gasoso, sólido.
e) gasoso, líquido, sólido.
23. Uma empresa de reciclagem de resíduos industriais recebeu uma grande quantidade de
resíduo industrial contendo basicamente uma mistura dos seguintes metais: mercúrio,
alumínio e ferro. A empresa tem interesse em desenvolver um processo para a separação
dos componentes desta mistura. Assinale, dentre as alternativas abaixo, aquela que fornece
uma sequência adequada para a separação dos componentes da mistura.
a) Centrifugação, sifonação e levigação.
b) Catação, flotação e decantação.
c) Destilação simples e separação magnética.
d) Filtração, fusão fracionada, decantação e ventilação.
e) Ventilação e levigação.
24. A imagem mostra a escultura do poeta Carlos Drummond de Andrade, criada pelo
artista mineiro Leo Santana, instalada em Copacabana, na cidade do Rio de Janeiro.
A escultura foi feita em bronze, em tamanho natural, em comemoração ao
centenário de nascimento do escritor. Nela observamos a frase do poeta: “No mar estava
escrita uma cidade”.
Quando o bronze se encontra exposto ao ar, ocorre o fenômeno da oxidação,
formando na superfície do metal uma camada cinzento-esverdeada de sais de cobre que, de
certa forma, evita maiores estragos na escultura.
No entanto, a ação continuada da chuva ácida dissolve parte dessa camada
protetora e permite uma corrosão mais profunda.
(http://www.notapositiva.com/pt/trbestbs/quimica/11chuvasacidas.htm#vermais.
em: 10.02.2012. Adaptado)
Acesso
Pensando nisso, assinale a alternativa que preenche, correta e respectivamente, a frase a
seguir.
O bronze é uma liga metálica constituída principalmente por ____________ e
___________, sendo que sua oxidação é um fenômeno ___________.
a) ferro – carbono – químico
b) ferro – carbono – físico
c) cobre – carbono – físico
d) cobre – estanho – físico
e) cobre – estanho – químico
25. Para iniciar o preparo de um bolo de maçã, uma dona de casa acendeu a chama de um
forno a gás, usando fósforos. Em seguida, descascou e cortou as maçãs, acrescentando-as à
mistura da massa já preparada, levando-a para o forno pré-aquecido. Com o passar do
tempo, o volume do bolo expandiu devido ao fermento adicionado e, após o período de
cozimento, a dona de casa retirou o bolo para servir um lanche que seria acompanhado de
sorvete. Ao abrir a geladeira, verificou que o mesmo estava derretendo. Após o lanche,
recolheu as sobras das maçãs, em processo de escurecimento, para descartá-las.
As sequências destacadas correspondem, respectivamente, a fenômenos
a) químico, físico, físico e físico.
b) físico, físico, químico e químico.
c) físico, químico, químico e físico.
d) químico, químico, físico e químico.
26. Observe atentamente os processos cotidianos abaixo:
I. A secagem da roupa no varal;
II. A queima do carvão;
III. A filtração da água pela vela do filtro;
IV. Enferrujamento de uma peça de ferro;
V. Azedamento do leite.
Constituem fenômenos químicos:
a) II e V apenas.
b) II, IV e V apenas.
c) I, III e IV apenas.
d) I, II e III apenas.
e) I, II, III, IV e V.
27. Na figura abaixo está representada uma balança. No prato da esquerda há um béquer,
que contém uma solução aquosa de ácido clorídrico HC . No prato da direita, foram
colocados alguns pesos, de forma que as massas, nos dois pratos, fiquem iguais.
Considere que se adiciona à solução ácida, acima descrita, uma solução aquosa de
bicarbonato de sódio, NaHCO3, o que resulta numa reação química.
a) Escreva a equação balanceada que representa essa reação.
b) A massa da solução aquosa de bicarbonato de sódio adicionada é de 16,80 g, valor
encontrado numa pesagem independente, feita em outra balança. Quando cessa a reação,
para que a massa contida nos dois pratos permaneça igual, é necessário adicionar, ao
prato da direita, pesos correspondentes a uma massa adicional de 16,36 g. Considerando
a equação representada no item anterior, explique por que, no prato direito, a adição de
apenas 16,36 g basta para equilibrar novamente a balança.
c) Calcule a quantidade de bicarbonato de sódio, em mol, presente na solução aquosa
adicionada.
28. A tabela abaixo apresenta os valores de algumas propriedades físicas de 3 substâncias:
Substância
Álcool
Acetona
Naftalina
Temperatura
de Fusão ºC
- 114,5
- 94,8
80,2
Temperatura de
Ebulição ºC
78,4
56,2
218,5
Densidade
g/cm3
0,789
0,791
1,145
Analisando-se os dados contidos na tabela, é correto afirmar-se que
a) a acetona evapora mais dificilmente que o álcool.
b) as 3 substâncias encontram-se no estado líquido a 60 ºC.
c) a pressão normal 1kg de água entraria em ebulição com maior dificuldade que 1kg de
álcool.
d) a densidade é a propriedade mais adequada, para distinguir o álcool da acetona.
e) a naftalina, a temperatura ambiente, ficaria boiando na superfície da água.
29. Ácido acético e bromo, sob pressão de 1 atm, estão em recipientes imersos em banhos,
como mostrado na figura adiante. Nessas condições, qual é o estado físico preponderante
de cada uma dessas substâncias?
Dados: o ácido acético apresenta temperatura de fusão igual a 17 °C e temperatura de
ebulição a 1 atm igual a 118 °C. O bromo apresenta temperatura de fusão igual a – 7 °C e
temperatura de ebulição a 1 atm igual a 59 °C.
a) ácido acético sólido e bromo líquido.
b) ácido acético líquido e bromo gasoso.
c) ácido acético gasoso e bromo sólido.
d) ácido acético sólido e bromo gasoso.
e) ácido acético gasoso e bromo líquido.
30. 46,0g de sódio reagem com 32,0g de oxigênio formando peróxido de sódio. Quantos
gramas de sódio são necessários para se obter 156g de peróxido de sódio?
a) 23,0
b) 32,0
c) 69,0
d) 78,0
e) 92,0
31. Bronze, "gelo seco" e diamante são, respectivamente, exemplos de:
a) mistura, substância simples e substância composta.
b) mistura, substância composta e substância simples.
c) substância composta, mistura e substância simples.
d) substância composta, substância simples e mistura.
e) substância simples, mistura e substância composta.
32. Acredita-se que os cometas sejam "bolas de gelo" que ao se aproximarem do sol
volatilizam parcialmente à baixa pressão do espaço. Qual das flechas do diagrama a seguir
corresponde à transformação citada?
33. Qual o estado físico (sólido, líquido ou gasoso) das substâncias da tabela a seguir,
quando as mesmas se encontram no Deserto da Arábia, à temperatura de 50 °C (pressão
ambiente = 1 atm)?
34. O gráfico abaixo representa a curva de resfriamento, temperatura em função do
tempo, de uma substância pura.
T( 0 C)
180
A
B
130
120
C
180
D
60
60
E
25
0
0
10
20
30
40
50
60
70
80 t ( min90)
120
Com base no gráfico, responda:
a)Qual os estados físicos nos trechos A,B,C,D e E
b)Qual a temperatura de condensação?
60
c) Qual
a temperatura de solidificação?
d)Qual o estado físico e a temperatura após decorridos 20 minutos?
35.0 Uma amostra de uma espécie química foi analisada em um laboratório e, como
resultado,
0
10 obteve-se
20
30
40 o50 seguinte
60
70 gráfico:
80
90
T( 0 C)
50
5
35
4
3
20
2
1
10
1
2
3
4
5
6
t ( min ) 7
a)Qual o ponto de fusão e ebulição?
b)Qual os estados físicos nos trechos 1,2,3,4,5.
36. Durante a fusão de um material, verifica-se que a temperatura se mantém constante até
o fim da fusão. Esse material:
A)certamente é uma substância pura
B)certamente é uma substância pura
C)Pode ser uma substância pura ou uma mistura eutética
D)Pode ser uma substância pura ou uma mistura azeotrópica
15
10
0
1
2
3
4
A
5
6
t ( min )
0
20
15
10
5
0
5
30
25
25
20
15
10
20
C)
35
30
40
35
30
25
20
15
10
5
0
T(
25
C)
T(
30
0
T(
0
0
35
T(
C)
C)
37. Qual(is) dos gráficos abaixo representa o aquecimento de uma substância pura:
5
0
7
1
3
B
t ( mi5 n )
71
1
2
3
t 5( min )
4
C
6
7
2
3
4
t 5( min ) 6
7
D
38. Na natureza nada se cria, nada se perde; tudo se transforma. Esse enunciado é
conhecido como Lei da Conservação das Massas ou Lei de Lavoisier. Na época em que foi
formulado, sua validade foi contestada, já que na queima de diferentes substâncias era
possível observar aumento ou diminuição de massa. Para exemplificar esse fenômeno,
considere as duas balanças idênticas I e II mostradas na figura abaixo. Nos pratos dessas
balanças foram colocadas massas idênticas de carvão e de esponja de aço, assim
distribuídas:
- pratos A e C: carvão;
- pratos B e D: esponja de aço.
A seguir, nas mesmas condições reacionais, foram queimados os materiais contidos em B e
C, o que provocou desequilíbrio nos pratos das balanças. Para restabelecer o equilíbrio,
serão necessários procedimentos de adição e retirada de massas, respectivamente, nos
seguintes pratos:
a) A e D
b) B e C
c) C e A
d) D e B
39. São anotados os seguintes valores nas experiências I, II e III
Determine os valores de x, y, z, w e k mencionando a(s) Lei(s) empregadas nestas
determinações.
40. Foram analisadas três amostras (I, II e III) de óxidos de enxofre, procedentes de
fontes distintas, obtendo-se os seguintes resultados:
Estes resultados mostram que:
a) as amostras I, II e III são do mesmo óxido.
b) apenas as amostras I e II são do mesmo óxido.
c) apenas as amostras II e III são do mesmo óxido.
d) apenas as amostras I e III são do mesmo óxido.
e) as amostras I, II e III são de óxidos diferentes.
41. Com o objetivo de verificar a observância à lei de Proust, um estudante efetuou a
reação entre ferro e oxigênio, obtendo os seguintes dados experimentais:
Outro estudante, utilizando os mesmos reagentes, obteve os seguintes valores
experimentais:
O que podemos concluir a respeito do trabalho dos dois estudantes e da observância à
referida lei?
42. Querendo verificar a Lei da Conservação das Massas (Lei de Lavoisier), um estudante
realizou a experiência esquematizada abaixo:
Terminada a reação, o estudante verificou que a massa final era menor que a massa inicial.
Assinale a alternativa que explica o ocorrido:
a) A Lei de Lavoisier só é válida nas condições normais de temperatura e pressão.
b) A Lei de Lavoisier não é válida para reações em solução aquosa.
c) De acordo com a Lei de Lavoisier, a massa dos produtos é igual à massa dos reagentes,
quando estes se encontram na mesma fase de agregação.
d) Para que se verifique a Lei de Lavoisier, é necessário que o sistema seja fechado, o que
não ocorreu na experiência realizada.
e) Houve excesso de um dos reagentes, o que invalida a Lei de Lavoisier.
43. Os seguintes dados foram obtidos analisando-se amostras de óxidos de nitrogênio.
Pela análise desses dados, conclui-se que:
a) as amostras I, II e III são do mesmo óxido.
b) apenas as amostras I e II são do mesmo óxido.
c) apenas as amostras I e III são do mesmo óxido.
d) apenas as amostras II e III são do mesmo óxido.
e) as amostras I, II e III são de diferentes óxidos.
44. Para separar uma mistura de açúcar com areia, a técnica mais adequada é:
A. destilação
B. dissolução em água, filtração e evaporação da água.
C. separação magnética
D. a filtração à vácuo
E. o uso do funil de Bromo
45. Em uma as etapas do tratamento da água do abastecimento público, é preciso deixá-la
em repouso por algumas horas para que se torne potável. Essa técnica é conhecida por:
A.decantação
B. filtração
C. destilação
D.cristalização
E. vaporização
Aparelho – II
46. Aparelho – I
A regra geral de solubilidade nos diz que as substâncias são solúveis em solventes
polares e insolúveis em solventes apolares vice-versa. Indique o aparelho que deve ser
usado para separar os constituintes das misturas abaixo relacionados:
a) Água e óleo.
b) Água e cloreto de sódio de uma solução não saturada. Justifique suas respostas.
Download