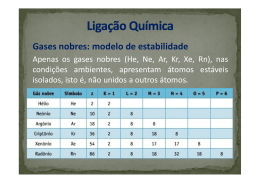
Prof. Sidnei Tabela Periódica Química Histórico 1817 - Tríades Dohereiner 1862 - Parafuso Telúrico de De Chancourtois 1864 - Lei das Oitavas de Newlands 1869 - D. F. Mendeleiev: - ordem crescente de massa atômica - propriedades químicas semelhantes - Te e I ; "Ekas" nos espaços vazios Química Histórico 1913 - Lei da Periodicidade de Moseley: - ordem crescente de Z Química Lei Periódica "As propriedades físicas e químicas dos elementos, são funções periódicas de seus números atômicos". Na tabela, os elementos estão arranjados horizontalmente, em seqüência numérica, de acordo com seus números atômicos, resultando o aparecimento de sete linhas horizontais (ou períodos). Química Elementos Químicos Os elementos químicos são representados por letras maiúsculas ou uma letra maiúscula seguida de uma letra minúscula. Os Símbolos são de origem latina: Português Latim Símbolo Sódio Natrium Na Potássio Kalium K Enxofre Sulphur S Fósforo Phosphurus P Ouro Aurum Au Química Períodos ou Séries São as filas horizontais da tabela periódica. São em número de 7 e indicam o número de níveis ou camadas preenchidas com elétrons. K L M N O P Q 1 2 3 4 5 6 7 P Q Química Famílias ou Grupos São as colunas verticais da Tabela Periódica. Em um Grupo ou Família, encontram-se elementos com propriedades químicas semelhantes. Para os Elementos Representativos, o nº do Grupo representa o nº de elétrons da última camada (camada de valência). 1 18 K L M N O P Q 2 13 14 1516 17 3 4 5 6 7 8 9 1011 12 1 2 3 4 5 6 7 Química Famílias ou grupos 18 1 3 4 5 6 7 8 9 10 11 12 GASES NOBRES HALOGÊNIOS CALCOGÊNIOS GRUPO DO NITROGÊNIO GRUPO DO CARBONO TRANSIÇÃO GRUPO DO BORO DE Metais Alcalinos Metais Alcalinos - TERROSOS ELEMENTOS 13 14 15 16 17 2 ELEMENTOS REPRESENTATIVOS Química subníveis mais energéticos Química Metais - Eletropositivos - Sólidos; exceto o Hg (25°C, 1atm); - Brilho característico; - Dúcteis (fios); - Maleáveis (lâminas); - São bons condutores de calor e eletricidade. Química Ametais -Eletronegativos; -Quebradiços; -Opacos; -Formam Compostos Covalentes (moleculares); - São Péssimos Condutores de Calor e Eletricidade (exceção para o Carbono). Química Gases Nobres - Foram Moléculas Monoatômicas; - São Inertes Mas Podem Fazer Ligações apesar da estabilidade (em condições especiais); - São Sete: He, Ne, Ar, Xe, Kr, Rn. Química Resumo Metais Ametais Gases nobres Química Notas: 1 - São elementos líquidos: Hg e Br; 2 - São Gases: He, Ne, Ar, Kr, Xe, Rn, Cl, N, O, F, H; 3 - Os demais são sólidos; 4 - Chamam-se cisurânicos os elementos artificiais de Z menor que 92 (urânio): Astato (At); Tecnécio (Tc); Promécio (Pm) 5 - Chamam-se transurânicos os elementos artificiais de Z maior que 92: são todos artificiais; 6 - Elementos radioativos: Do bismuto (83Bi) em diante, todos os elementos conhecidos são naturalmente radioativos. Química Propriedades periódicas Eletronegatividade Eletropositividade Potencial de ionização Raio atômico Eletroafinidade Densidade Química Raio Atômico É a distância que vai do núcleo do átomo até o seu elétron mais externo. Inclui os gases nobres. H Li Na K Rb Cs Fr He Química Potencial de Ionização É a energia necessária para arrancar um elétron de um átomo, no estado gasoso, transformando-o em um íon gasoso. Varia como a eletronegatividade e inclui os gases nobres. A segunda ionização requer maior energia que a primeira e, assim, sucessivamente. He H Fr Ne Ar Kr Xe Rn Química Eletroafinidade É a energia liberada quando um átomo recebe um elétron (Afinidade Eletrônica). Varia como o Potencial de Ionização. Não inclui os Gases Nobres. H Fr Química Eletronegatividade É a capacidade que um átomo tem de atrair elétrons (ametais). Varia da esquerda para a direita e de baixo para cima, excluindo-se os gases nobres. H BCNOF Cl Br I Fr Química Eletropositividade ou Caráter Metálico: É a capacidade que um átomo tem de perder elétrons (metais). Varia da direita para a esquerda e de cima para baixo excluindo-se os gases nobres. H Li Na K Rb Cs Fr F Química Densidade É a razão entre a massa e o volume do elemento. Varia das extremidades para o centro e de cima para baixo. Os Ir Química Resumo das propriedades Eletronegatividade; Potencial de ionização; Eletroafinidade. Eletropositividade; Raio atômico H Li Na K Rb Cs Fr BCNOF Cl Br I He Ne Ar Kr Xe Rn Química Tabela de Prova Química
Download