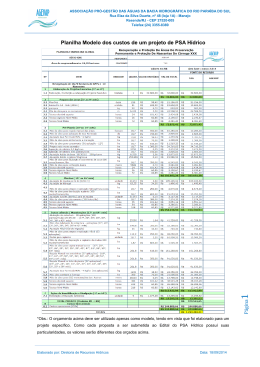
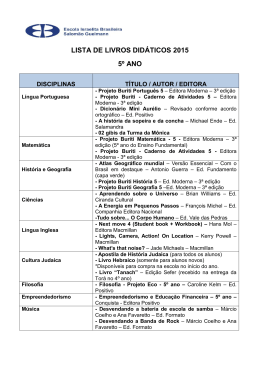
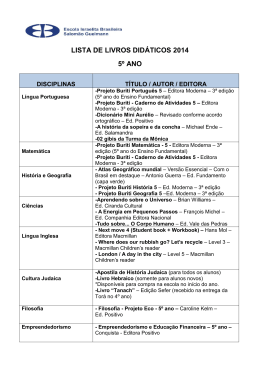
Fotossíntese, condutância estomática... 117 FOTOSSÍNTESE, CONDUTÂNCIA ESTOMÁTICA, TRANSPIRAÇÃO E AJUSTAMENTO OSMÓTICO DE PLANTAS DE BURITI SUBMETIDAS A ESTRESSE 1 HÍDRICO Maria Elisa Ribeiro Calbo 2 e José Antônio P. V. de Moraes 3 Departamento de Botânica, Universidade Federal de São Carlos, C.P. 679, São Carlos, SP, 13565-905. Brasil RESUMO- Plantas de buriti (Mauritia vinifera Mart.) com 5 meses de idade foram cultivadas em vasos contendo 7 kg de solo e submetidas a estresse hídrico pela suspensão da irrigação. Após 41 dias sem irrigação o estresse hídrico reduziu a fotossíntese para zero. Neste ponto, quando o potencial hídrico foliar atingiu -2,1 MPa, as plantas foram reidratadas com irrigações diárias. Este valor de potencial hídrico, correspondente a fotossíntese zero, está na faixa previamente observada para mesófitas e para árvores da floresta tropical úmida. A manutenção de concentrações internas de CO2 relativamente altas durante o desenvolvimento do estresse sugere que a redução observada na taxa de fotossíntese ocorreu independentemente do aumento da resistência estomática. A taxa fotossintética foi recuperada completamente após 5 dias de reidratação. A análise das curvas de pressão e volume, após o lento e gradativo estabelecimento do déficit hídrico foliar, mostrou diminuição do potencial osmótico. Os valores de potencial osmótico no ponto de turgescência zero foram -1,5 MPa e -1,85 MPa para plantas do controle e estressadas, respectivamente. O ajustamento osmótico durante o estabelecimento do estresse hídrico foi estimado como sendo de 18,9 %, na turgescência zero e de 17,0% na turgescência máxima. Estes resultados sugerem que o buriti possui mecanismos para tolerar déficit hídrico moderado, pois pode manter valores de turgescência positivos em potenciais hídricos relativamente baixos. Termos adicionais para indexação: palmeiras, Mauritia vinifera. 1 Recebido em22/10/96 e aceito em 03/07/1997. 2 Lab.Fisiologia Vegetal, Depto Botânica, C.P. 04457, Universidade de Brasília, Brasília, DF, 70910-900. e-mail [email protected] 3 Departamento de Botânica, Universidade Federal de São Carlos, C.P. 679, São Carlos, SP, 13565-905. Brasil PHOTOSYNTHESIS, STOMATAL CONDUCTANCE, TRANSPIRATION AND OSMOTIC ADJUSTMENT OF BURITI PLANTS SUBJECTED TO WATER STRESS ABSTRACT - Five month old buriti (Mauritia vinifera Mart.) plants grown in pots containing 7 kg of soil were subjected to water stress by withholding irrigation. After 41 days without irrigation the water stress reduced photosynthesis to zero. At this point, when leaf water potential reached -2.1 MPa the plants were rehydrated by daily irrigation. The water potential value corresponding to photosynthesis zero is within the range previously observed for mesophytes and for humid tropical forest trees. The maintainance of relatively high internal CO2 concentrations during stress development suggests that the observed reduction in photosynthesis rate occurred independently of the increase in stomatal resistance. After 5 days from the start of rehydration the photosynthethic rate was recovered completely. The analysis of pressure-volume curves, after a slow and gradual leaf water deficit establishment, has shown a decrease in osmotic potential. The osmotic potential values at zero turgor were -1.5 and -1.85 MPa for control and stressed plants, respectively. Osmotic adjustment during water stress establishment was estimated as being 18.9% at turgor zero and 17.0% at full turgor. These results suggest that buriti has mechanisms to tolerate moderate water deficits because it is able to maintain positive turgor values at relatively low water potentials. Additional index terms: palms, Mauritia vinifera. INTRODUÇÃO O buriti (Mauritia vinifera Mart.) ocorre nos estados da Bahia, Minas Gerais, Goiás, Mato Grosso (Ferri, 1980), Ceará e o Maranhão (Bondar, 1964). de R. Bras. Fisiol. Veg., 9(2):117-123, 1997. 118 Fotossíntese, condutância estomática... preferência nas baixadas úmidas (várzeas) do Brasil Central, nos terrenos pantanosos ou brejados próximos dos cursos de água permanente e no alto das serras (Pio Corrêa, 1926; Lorenzi, 1992). Atinge mais de 15 m de altura, o diâmetro do caule é de cerca de 0,50 m e quando adulta possui 20 a 30 folhas palmadas eretas, dispostas quase sempre em leque. Não se conhece o grau de tolerância e a capacidade de aclimatação do buriti a fatores ambientais como o déficit de água, que poderiam ser limitantes para a introdução desta espécie fora de seu habitat natural. O habitat preferido do buriti é a várzea, no entanto, devido a sua ampla dispersão, pode-se inferir que esta espécie seja submetida a períodos de seca ocasionais. Mesmo plantas que vivem em comunidades muito úmidas como, por exemplo, florestas pluviais tropicais de locais baixos, podem experimentar estresses hídricos ao longo do dia e em anos mais secos serem submetidas a déficit de água severo (Schulze et al.,1987). As espécies xerófitas desenvolveram, ao longo da evolução, várias adaptações ao estresse hídrico (Turner, 1979 e 1986). As espécies mesófitas também possuem, em menor grau, adaptações metabólicas ao déficit de água, uma condição essencial para sobrevivência em ambientes mesófitos onde déficits internos de água são inevitáveis em alguns períodos (Hanson, 1982). Uma das adaptações que resulta numa tolerância maior ao estresse hídrico é o ajustamento osmótico, que pode ocorrer em xerófitas, halófitas e mesófitas. O ajustamento osmótico é definido como diminuição do potencial osmótico em resposta ao déficit hídrico ou à salinidade (Turner, 1979 e 1986), que permite a manutenção de uma turgescência positiva em potenciais hídricos relativamente mais baixos (Jones & Turner, 1978; Acevedo et al., 1979; Ackerson & Herbert, 1981). A finalidade deste trabalho foi determinar o grau de tolerância ao estresse hídrico em plantas de buriti, através da observação de como a capacidade fotossintética é mantida durante o período de déficit hídrico e da capacidade de recuperação da fotossíntese, após um estresse mais severo. Além disto, procurou-se detectar a existência de adaptação ao estresse hídrico através de ajustamento osmótico. (I sop ro pi l ca rbo mo il -1 -(d i cl oro-3-5-fenil)-3hidantoína) por quilo de sementes e transportadas para São Carlos em sacos plásticos. Um mês após a coleta elas foram colocadas para germinar em canteiros. Após a emergência, as plântulas foram transplantadas para sacos plásticos pretos perfurados, contendo 7 kg de solo de cerrado com as características descritas por Lorandi (1987), adubado com 2g de adubo NPK 10-10-10 por kg de solo e mantidas em casa de vegetação sob uma radiação fotossinteticamente ativa em torno de 450 µmol m-2 s-1. Aos 5 meses de idade as plantas foram submetidas a estresse hídrico, suspendendo-se a irrigação. Diariamente foram determinadas a taxa de fotossíntese, condutância estomática e a transpiração em plantas sem irrigação e em plantas irrigadas. Nestas medidas foi utilizado, no modo diferencial, um analisador portátil de CO2 por infra vermelho (IRGA) da ADC, modelo LCA-2 acoplado a uma câmara foliar Parkinson do tipo PLC-2, e uma unidade de suprimento de ar ADC ASU (MF) e a um processador e armazenador de dados DL-2. Utilizou-se para as determinações 4 plantas submetidas a estresse hídrico e 4 plantas do controle, sendo feitos, pelo menos, 3 registros de dados para cada folha. As medidas foram sempre efetuadas na folha mais velha de cada planta no período da manhã, utilizando-se como fonte de luz uma lâmpada de projetor de slides a qual fornecia uma radiação fotossinteticamente ativa (RFA) em torno de 750 µmol m-2 s-1. Esta irradiação causou saturação lumínica das folhas de buriti, conforme ficou evidenciado na curva de intensidade de radiação versus fotossíntese (Fig. 1). Entre a fonte de luz e a câmara de exposição foi colocada uma cuba de vidro com uma lâmina de 140 mm de água, para absorver irradiação infravermelha e evitar o aquecimento da folha. A concentração interna de CO2 (Ci) calculada (Caemmerer & Farquhar, 1981) foi fornecida pelo IRGA. Quando a fotossíntese das plantas submetidas ao déficit hídrico atingiu zero, elas voltaram a receber irrigação diária enquanto as determinações de fotossíntese, condutância estomática e transpiração continuaram sendo feitas no período de recuperação até a fotossíntese alcançar valores similares ao controle. Uma câmara de pressão modelo 1000 da PMS Instruments (Corvalis, Oregon, USA) foi utilizada para As sementes de buriti (Mauritia vinifera Mart.) foram as determinações de potencial hídrico em folhas de coletadas no mês de fevereiro, de buritizais buriti às nove horas da manhã, após as medidas das localizados no município de Santo Antônio do trocas gasosas. Estas determinações foram feitas aos Descoberto no estado de Goiás. Retirada a polpa dos 29 dias e aos 41 dias após a retirada da irrigação das frutos, elas foram lavadas, superficialmente secas ao plantas sob estresse hídrico. As curvas de pressão e ar, tratadas com 2 g de Captan (n-triclorometileno volume, relacionando o inverso da pressão aplicada -4-ciclo-hexeno -1-2-dicarboximida) e 2 g de Rovral versus a massa da seiva acumulada a cada pressão R. Bras. Fisiol. Veg., 9(2):117-123, 1997. MATERIAL E MÉTODOS Fotossíntese, condutância estomática... 119 FIGURA 1-. Fotossíntese líquida em função da radiação fotossinteticamente ativa em folhas de plantas jovens de buriti. FIGURA 2- Fotossíntese líquida em plantas de buriti durante o período de estresse hídrico. n plantas não irrigadas (estressadas) ¨ plantas irrigadas. (Tyree & Hammel, 1972; Cutler et al., 1979; Turner, 1981) foram confeccionadas para folhas de plantas que haviam atingindo a fotossíntese zero e para folhas de plantas do tratamento controle. Com o ajuste da reta na parte linear da curva estimou-se o potencial osmótico no ponto de turgescência máxima (Cutler et al., 1979, Turner, 1981). O ajustamento osmótico foi calculado pela diferença entre os valores do potencial osmótico no ponto de turgescência máxima de plantas estressadas e os valores do potencial osmótico obtidos da mesma maneira, em plantas irrigadas. O potencial de parede (Ψp) foi calculado pela diferença entre o potencial hídrico e o potencial osmótico. Plantas jovens do cerrado têm tido redução da fotossíntese a zero em potenciais hídricos menores do que os aqui observados para o buriti. Em plantas jovens de Copaifera langsdorffii (Prado et al., 1994) o potencial hídrico crítico para reduzir a fotossíntese a zero foi de -3,5 MPa e em plantas jovens de Stryphnodendron adstringens foi de -2,7 MPa. (Rocha, 1994). RESULTADOS E DISCUSSÃO A fonte de luz utilizada para as medidas de fotossíntese em condições de laboratório está acima do valor de RFA (radiação fotossinteticamente ativa), que satura 90% da fotossíntese líquida em plantas jovens de buriti (Fig. 1). Com a equação utilizada para o ajuste da curva obteve-se valores de RFA saturante e ponto de compensação lumínico de 655 µmol m-2s-1 e 17, 05 µmol m-2 s -1, respectivamente. Este valor de radiação saturante está próximo aos obtidos por Smith (1989) em folhas da palmeira Elaeis guineensis. Nesta espécie o valor da radiação fotossinteticamente ativa saturante foi de 500 µmol m-2 s-1.. O potencial hídrico de -2,1 MPa, no qual a fotossíntese atingiu valor zero no buriti, está na faixa de valores de potenciais hídricos de mesófitas. De acordo com Larcher (1995), mesófitas herbáceas atingem fotossíntese zero com potenciais hídricos entre -1,5 MPa e -2,5 MPa e árvores da floresta tropical com potenciais entre -1,5 e -4,0 MPa. Algumas espécies cultivadas apresentaram valores semelhantes aos valores obtidos para plantas de buriti. Em folhas de soja (Turner, 1979), o potencial hídrico crítico foi -2,5 MPa; em alguns cultivares de girassol foi aproximadamente de -2,1 MPa (Mojayad & Planchon, 1994). Alguns cultivares de fumo apresentaram redução de 97% da fotossíntese líquida A fotossíntese líquida (Fig. 2) começou a diminuir 16 dias após a interrupção da irrigação e permaneceu em cerca de 89% da fotossíntese do controle até os 28 dias. Aos 29 dias houve uma queda acentuada da fotossíntese nas plantas estressadas (2,0 µmol m-2 s-1), enquanto as plantas do controle continuaram com valores médios, ao redor de 5,5 µmol m-2 s-1. O potencial hídrico de folhas de plantas estressadas neste dia foi em torno de -1,6 MPa. A partir do 29o dia FIGURA 3- Condutância estomática em plantas de houve uma diminuição gradativa da fotossíntese buriti durante o período de estresse hídrico. n plantas líquida e tornou-se nula quando o potencial hídrico não irrigadas (estressadas) o plantas irrigadas. foliar era de aproximadamente -2,1 MPa. R. Bras. Fisiol. Veg., 9(2):117-123, 1997. 120 Fotossíntese, condutância estomática... FIGURA 4- Transpiração em plantas de buriti durante o período de estresse hídrico.n plantas não irrigadas (estressadas) o plantas irrigadas. FIGURA 6-. Recuperação da fotossintese líquida de plantas de buriti submetidas a estresse hídrico.n plantas reidratadas após 41 dias sem irrigação o plantas não submetidas a estresse hídrico. muito próxima de zero. Isto indica provavelmente a ocorrência de uma transpiração cuticular. Alta resistência cuticular é importante característica morfológica de resistência a seca, porque permite maior conservação de água nas plantas com estômato fechado sob seca severa (Pallardy & Rhoads, 1993). A possível transpiração cuticular observada sugere que a cutícula em folhas de plantas jovens de buriti não seja barreira muito efetiva para a perda de água, o que é característica de plantas mesófitas, que não possuem cutículas espessas. FIGURA 5- Relação entre a condutância estomática e a concentração interna de CO2 em plantas de buriti durante período de estresse hídrico. com o potencial de água de -2,5 MPa (Rensburg & Kruger,1993). Do 6o ao 16o dia após a suspensão da irrigação (Fig. 3) houve uma ligeira diminuição da condutância estomática que acentuou-se a partir daí, chegando a atingir valores próximos de zero no final do período experimental. O fechamento estomático em folhas da palmeira Rhapis excelsa, ocorreu em potencial hídrico de aproximadamente, -3,2 MPa (Sperry, 1986). Os maiores potenciais hídricos necessários para o fechamento estomático do buriti do que para Rhapis excelsa parecem indicar que o buriti possui menor resistência à seca. No entanto, Sperry (1986) utilizou folhas de palmeiras entre 2 a 3 m de altura e a indução ao estresse hídrico foi feita por desidratação ao sol. A concentração interna de CO2 (Ci) teve pouca redução com a diminuição da condutância estomática em buriti (Fig.5), o que parece indicar que o decréscimo da taxa de fotossíntese líquida foi devido não só ao aumento da resistência estomática, mas também, ao efeito do estresse hídrico na fotossíntese, visto que um alto valor de Ci associado a baixas condutâncias estomática indicaria um decréscimo na eficiência de carboxilação (Farquhar & Sharkey, 1982; Hutmacher & Krieg, 1983; Schulze, 1986; Ni & Pallardy 1992 and Leidi 1993). Este efeito do estresse hídrico foi elástico em plantas de buriti pois elas voltaram a apresentar taxas de fotossíntese similares ao controle após serem reidratadas (Fig. 6). Leidi (1993), utilizando plantas de algodão submetidas ao estresse hídrico, não obteve uma relação linear entre condutância estomática e concentração interna de CO2, semelhantemente ao que ocorreu no buriti. Este autor concluiu que a ocorrência de valores aproximadamente constantes de Ci associados a baixa condutância estomática era um efeito do estresse hídrico sobre o aparelho fotossintético, possivelmente devido à redução na eficiência de carboxilação. Rocha (1994) obteve uma relação linear entre a fotossíntese líquida e a concentração interna de CO2 na espécie Stryphnodendron adstringens, indicando apenas A transpiração começou a diminuir após 6 dias de suspensão da irrigação e continuou ao longo do tempo (Fig. 4). Aos 41 dias, a transpiração de plantas não irrigadas foi apenas 10% da transpiração do controle, enquanto a condutância estomática estava R. Bras. Fisiol. Veg., 9(2):117-123, 1997. Fotossíntese, condutância estomática... 121 FIGURA 7- Recuperação da condutância estomática de planta de buriti submetidas a estresse hídrico. n plantas reidratadas após 41 dias sem irrigação o plantas não submetidas a estresse hídrico. FIGURA 8- Recuperação da transpiração de plantas de buriti submetidas a estresse hídrico. n plantas reidratadas após 41 dias sem irrigação o plantas não submetidas a estresse hídrico. limitação estomática na fotossíntese sob estresse de água. Esta conclusão foi reforçada pela recuperação mais rápida desta espécie após a reidratação (48 horas). 5o dia de irrigação 70 % da condutância estomática das plantas do controle (Fig. 7). Alguns autores atribuem a manutenção aproximadamente constante do Ci durante o estresse hídrico a uma condutância estomática não uniforme ao longo do mesófilo. No entanto, esta heterogeneidade não é comum a todas as espécies e nem todas as espécies apresentam este comportamento sob déficit de água, principalmente quando o estresse é imposto lentamente (Gunasekera & Berkowitz, 1992). As folhas de buriti apresentam estômatos nas superfícies adaxial e abaxial (dados não apresentados) e, segundo Downton et al. (1988), o efeito da falta de uniformidade do fechamento estomático sobre Ci é maior em folhas hipoestomáticas do que em folhas anfiestomáticas. Segundo Mansfield et al. (1990) em folhas com anatomia heterobárica a rede de feixes vasculares forma seções isoladas de espaços intercelulares, restringindo a difusão de CO2 entre as seções, o que poderia propiciar uma hetereogeneidade no fechamento estomático ao longo do mesófilo. No entanto, Kawamitsu et al. (1993) argumentam que na maioria das monocotiledôneas a anatomia é homobárica. As monocotiledôneas possuem também um maior número de estômatos por unidade de área, o que contribui para uma homogeneização da pressão interna. A recuperação da fotossíntese líquida (Fig. 6) iniciou-se um dia após a irrigação quando atingiu 37% da fotossíntese líquida do controle e ao 5 0 dia já era tão alta quanto nas plantas continuamente irrigadas. A condutância estomática apresentou uma pequena recuperação do 10 ao 30 dia, a partir do 40 dia houve um aumento na condutância estomática atingindo no A recuperação da transpiração (Fig. 8) iniciou-se no primeiro dia após a irrigação já atingindo 31% do controle. Após o terceiro dia de irrigação, semelhantemente como ocorreu com a condutância estomática, a recuperação foi acelerada, atingindo no 5o dia 77% da transpiração das plantas do controle. Uma condutância estomática de70 % permitiu uma taxa de fotossíntese similar ao controle ao mesmo tempo que reduziu a taxa de transpiração. TABELA 1- Valores médios de potencial osmótico no ponto de turgescência máxima (Ψp100) e no de turgescência zero (Ψp0) em plantas de buriti submetidas ao déficit hídrico durante 41 dias e em plantas do controle. Ψp100 (MPa) Ψp0 (MPa) Controle -1,31 0,02 -1,50 0,01 Estresse hídrico -1,58 0,03 -1,85 0,02 As plantas sob estresse hídrico apresentaram uma diminuição do potencial osmótico em relação às plantas do controle, de acordo com as médias do potencial osmótico com turgescência zero e com o turgescência total obtidos a partir de curvas de pressão e volume (Tabela 1). A redução do potencial osmótico com o turgescência total foi de 17,0% e com turgescência zero foi de 18,9%. Os potenciais osmóticos com turgescência total obtidos para plantas jovens de buriti do controle (Tabela 1) estão na faixa de valores encontrados para a maioria das espécies cultivadas, as quais, segundo Larcher (1995), atingem valores de potencial osmótico de até -2,1 MPa. As esclerófitas, que são plantas mais resistentes a seca e plantas do deserto apresentam potenciais osmóticos muito mais baixos do que estes, R. Bras. Fisiol. Veg., 9(2):117-123, 1997. 122 Fotossíntese, condutância estomática... podendo atingir -5,0 MPa. O valor do potencial osmótico pode ser uma indicação da resistência a seca nas espécies de palmeiras. Estudos das relações hídricas (Holbrook & Sinclair, 1992) em folhas da palmeira arbórea Sabal palmetto, obtidas de plantas com 0,35 a 4,02 m de altura, mostraram que o valor de potencial osmótico com turgescência zero médio foi -3,81 MPa e o potencial osmótico com turgescência total foi -3,4 MPa. Estes resultados, quando comparados com valores de potenciais osmóticos obtidos em plantas de buriti indicam possível diversidade de resistência a seca entre as espécies de palmeiras. Entretanto nesses trabalhos foram usadas folhas de plantas mais velhas obtidas de palmeiras cultivadas no campo. Em folhas do dossel da espécie arbórea Castanospermum australe nativa da floresta tropical úmida, Myers et al. (1987) obtiveram valores de potencial osmótico com turgescência total de -1,38 MPa semelhantes ao obtido para o buriti. Isto pode indicar que o acúmulo de solutos em folhas de palmeiras varia conforme a sua adaptação ao habitat. O decréscimo no potencial osmótico, obtido após o lento estabelecimento do estresse hídrico, possibilitou a ocorrência de turgescência zero num potencial hídrico mais baixo que em plantas do controle, indicando que o buriti possui mecanismos para tolerar uma seca moderada. REFERÊNCIAS ACKERSON, R.C. & HERBERT, R.R. Osmoregulation in cotton in response to water stress. Plant Physiology, 67:484-488, 1981. ACEVEDO, E.; FERERES, T.C.; HSIAO, T.C. & HENDERSON, D. W. Diurnal growth trends, water potential, and osmotic adjustment of maize and sorghum leaves in the field. Plant Physiology, 64:476-480,1979. BONDAR, J. S. Palmeiras do Brasil. São Paulo, Secretaria da Agricultura do Estado de São Paulo, 1964. 159p. CAEMMERER, S.V. & FARQUHAR, G.D. Some relationships between the biochemistry of photosynthesis and the gas exchange of leaves. Planta, 153:376-387, 1981. CUTLER, J.M.; SHAHAN, K.W. & STEPONKUS, P. L. Characterization of internal water relations of rice by a pressure-volume method. Crop Science, 19:681-685, 1979. DOWNTON, W. J. S.; LOVEYS, B. R. & GRAND, W. J. R. Non-uniform stomatal closure induced by water stress causes putative non-stomatal inhibition of photosynthesis. New Phytologist, 110:503-509, 1988. FARQUHAR, G.D. & SHARKEY, T.D. Stomatal conductance and photosynthesis. Annual Review Plant Physiology, 33:317-345, 1982. FERRI, M.G. Vegetação brasileira. Belo Horizonte, Itatiaia, 1980.157p. GUNASEKERA, D. & BERKOWITZ, G.A. Heterogenous stomatal closure in response to leaf water deficits is not a universal phenomenon. Plant Physiology, 98:660-665, 1992. HANSON, D. A. & HITZ, W. D Metabolic responses of mesophytes to plant water deficits. Annual Review Plant Physiology, 33: 163-203, 1982. HUTMACHER, R. B. & KRIEG, D. R. Photosynthetic rate control in cotton. Plant Physiology, 73:658-661. 1983. HOLBROOK, N.M. & SINCLAIR, T.R. Water balance in the arborescent palm, Sabal palmetto. I. Stem structure, tissue water release properties and leaf epidermal conductance. Plant, Cell and Environment, 15:393-399, 1992. KAWAMITSU, Y.; YODA, S. & AGATA, W. Humidity pretreatment affects the responses of stomata and CO2 assimilation to vapor pressure difference in C 3 and C 4 plants. Plant Cell Physiology, 34:113-119, 1993. JONES, M.M. & TURNER, N.C. Osmotic adjustment in expanding and fully expanded leaves of sunflower in response to water deficits. Australian Journal of Plant Physiology, 7: 181-192. 1980. LARCHER, W. Physiological Plant Ecology. New York, Springer-Verlag, 1995. 506p. LEIDI, E.O.; LOPEZ, J.M.; LOPEZ, M. & GUTIERREZ, J.C. Searching for tolerance to water stress in cotton genotypes: photosynthesis, stomatal conductance and transpiration. Photosynthetica, 28:383-390, 1993. LORANDI, R. Levantamento dendrológico semidetalhado do campus da Universidade Federal de São Carlos ( SP) e suas aplicações. Relatório final de projeto financiado pelo CNPq (400186/87-0/pq/fv), 1987. LORENZI, H. Árvores brasileiras. Nova Odessa, Editora Plantarum, 1992. 281p. MANSFIELD, T. A. ; HETHERINGTON, A. M. & ATKINSON, C. J. Some current aspects of stomatal physiology. Annual Review of Plant Physiology and Plant Molecular Biology, 41:55-57, 1990. MYERS, B.J.; ROBICHAUX, R.H.; UNWIN, G.L & CRAIG, I.E. Leaf water relations and anatomy of a tropical rainforest tree vary with crown position. Oecologia, 74:81-85, 1987. MOJAYAD, F. & PLANCHON, C. Stomatal and photosynthetic adjustment to water deficit as the expression of heterosis in sunflower. Crop Science, 34: 103-107, 1994. R. Bras. Fisiol. Veg., 9(2):117-123, 1997. Fotossíntese, condutância estomática... NI, B. & PALLARDY, S.G. Stomatal and nonstomatal limitation to net photosynthesis in seedlings of woody angiosperms. Plant Physiology, 99:1502-1508, 1992. PALLARDY, S.G. & RHOADS, J.L. Morphological adaptation to drought of deciduous angiosperms. Canadian Journal Forest Research, 23:1766-1774, 1993. PIO CORRÊA, M. Dicionário de plantas úteis do Brasil e das exóticas cultivadas. Rio de Janeiro, Imprensa Nacional, 1926. p 338. PRADO, C.H.B.A.; MORAES, J.A.P.V. & MATTOS, E. A. Gas exchange and leaf water status in potted plants of Copaifera langsdorffii. 1. Responses to water stress. Photosynthetica, 30:207-213, 1994. RENSBURG, L.V. & KRUGER, G.J. Comparative analysis of differential drought stress-induced suppression of a recovery in carbon dioxide fixation: stomatal and non-stomatal limitation in Nicotiana tabacum L. Journal Plant Physiology, 142:296-306, 1993. ROCHA, A.M.S. Estresse hídrico e trocas de CO 2 gasoso e vapor d’ água em plantas jovens envasadas de Stryphnodendron adstringens (Mart.) coville. São Carlos. Universidade Federal de São Carlos, 1994. 112p. Dissertação de Mestrado. 123 SCHULZE, E.D.; ROBICHAUX, R.H.; GRACE, J.; RUNDEL, P.W & EHLERINGER, J.R. Plant water balance. BioScience, 37:30-37, 1987. SMITH, B.G. The effects of soil water and atmospheric vapour pressure deficit on stomatal behaviour and photosynthesis in the oil palm. Journal of Experimental Botany, 215:647-651, 1989. SPERRY, J.S. Relationship of xylem embolism to xylem pressure potential, stomatal closure, and shoot mor phology in the palm Rhapis excelsa. Plant Physiology, 80:110-116, 1986. TYREE, M.T. & HAMMEL, H.T. The measurement of the turgor pressure and water relation of plants by pressure-bomb technique. Journal Experimental Botany, 23:267-282. 1972. TURNER, N.C. Drought resistance and adaptation to water deficits in crop plants. In: MUSSEL, H.; STAPLES, R. C. (Eds.). Stress physiology in crop plants. New York, Wiley Interscience, 1979. p. 468-478. TURNER, N.C. Techniques and experimental approaches for the measurement of plant water status. Plant and Soil, 58:339-366, 1981. TURNER, N.C. Adaptation to water deficits: a changing perspective. Australian Journal Plant Physiology, 13:175-190, 1986. R. Bras. Fisiol. Veg., 9(2):117-123, 1997.
Download