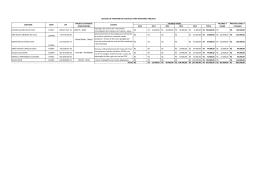
CENTRO UNIVERSITÁRIO DINÂMICA DAS CATARATAS CURSO DE ENGENHARIA AMBIENTAL Missão: “Formar Profissionais capacitados, socialmente responsáveis e aptos a promoverem as transformações futuras” MEXILHÃO DOURADO COMO BIOINDICADOR DE METAIS PESADOS TÓXICOS (Pb, Cd e Cr) NO RESERVATÓRIO DE ITAIPU SABRINA KERKHOFF Foz do Iguaçu - PR 2013 SABRINA KERKHOFF MEXILHÃO DOURADO COMO BIOINDICADOR DE METAIS PESADOS TÓXICOS (Pb, Cd e Cr) NO RESERVATÓRIO DE ITAIPU Trabalho de conclusão de curso apresentado à banca examinadora do Centro Universitário Dinâmica das Cataratas (UDC), como requisito para obtenção do grau de Engenheiro Ambiental. Prof (a) Ms. Orientador(a): Me. Fernanda Rubio e Me. Herbert Nacke. Foz do Iguaçu – PR 2013 TERMO DE APROVAÇÃO CENTRO UNIVERSITÁRIO DINÂMICA DAS CATARATAS MEXILHÃO DOURADO COMO BIOINCIDADOR DE METAIS PESADOS TÓXICOS (Pb, Cd e Cr) NO RESERVATÓRIO DE ITAIPU TRABALHO FINAL DE CONCLUSÃO DO CURSO PARA OBTENÇÃO DO GRAU DE BACHAREL EM ENGENHARIA AMBIENTAL Acadêmico(a):Sabrina Kerkhoff Orientadora: Prof(ª). Me. Fernanda Rubio Nota Final: Banca Examinadora: Prof. Me. Daniel Schwantes Me. Pricila Marin Foz do Iguaçu, 23 de novembro de 2013. DEDICATÓRIA Aos meus pais que me proporcionaram a oportunidade de cursar a graduação e que me auxiliaram nos momentos de dificuldades ao longo do curso. AGRADECIMENTOS A Deus, pelo Dom da vida e por sempre estar ao meu lado e ouvir minhas preces, me amparando nos momentos em que tudo parecia impossível. Aos meus pais, pelo ininterrupto apoio e incentivo aos estudos que sempre me proporcionaram, além de tudo que fizeram por mim ao longo da graduação. Obrigada por serem a minha referência e estarem sempre presentes na minha vida de uma forma indispensável. À minha Profª. Me. Fernanda Rubio, pela orientação e por toda ajuda e dedicação prestadas e também por toda sua compreensão e companheirismo. Ao Adriano Conti que esteve ao meu lado em boa parte dos momentos de tristeza e alegrias, e que sempre me auxiliou de maneira prestativa. Aos meus irmãos Karine Kerkhoff e Kassio Diniz Kerkhoff, pela ajuda e os inúmeros favores que me prestaram ao longo da graduação. Ao meu supervisor de estágio, Domingo Rodriguez Fernandez, que me apresentou a área de conhecimento na qual pretendo seguir, além do conhecimento repassado durante o estágio. À Simone Frederigi Benassi, que colaborou ativamente para o desenvolvimento deste trabalho, desde a escolha dos pontos de coleta até as análises. Muito Obrigada! Aos que me acompanharam na coleta das amostras em São Miguel do Iguaçu, Cícero Medeiros da Silva, Bruna Costa Savio e Marcos Vinícius Alves. Desculpemme por deixá-los sem almoço. Agradeço também aos funcionários da empresa terceirizada da Itaipu Binacional que me apoiaram durante a coleta das amostras do projeto piloto. Aos que me auxiliaram no laboratório durante a trabalhosa separação dos tecidos moles e concha do mexilhão dourado, Gessica Wernke, Jéssica Yuki de Lima Mito, Jonas Rodrigo dos Santos, Kassio Diniz Kekhoff, Marjorie Appio Leama, Jéssica Caroline Mulinari Favassa e Adriano Conti. À toda a Divisão de Reservatório da Itaipu Binacional, em especial à Carla Canzi, Sandro Alveis Heil e Aldérico Coltro, que em meio as conversas, de alguma forma, contribuíram para este trabalho. Aos funcionários do Laboratório do Centro Universitário Dinâmica das Cataratas, pelo apoio prestado durante o processo laboratorial. Ao Herbert Nacke, pela co-orientação e transporte das amostras processadas até a Universidade do Oeste do Paraná - Campus Marechal Cândido Rondon, e ao Prof. Dr. Affonso Celso Gonçalves Jr, pelo apoio quanto à realização da leitura das amostras. Aos meus colegas de classe e principalmente à minha grande amiga Patrícia Groth Alves, por todo apoio, conversas, diversão e dificuldades que enfrentamos todos juntos durante a faculdade. E finalmente, a todos aqueles que direta ou indiretamente contribuíram para a realização deste trabalho. MUITO OBRIGADA! EPÍGRAFE “O caminho da sabedoria é não ter medo de errar” Paulo coelho KERKHOFF, Sabrina. Mexilhão Dourado como Bioindicador de Metais Pesados Tóxicos (Pb, Cd e Cr) no Reservatório de Itaipu. Foz do Iguaçu, 2013. Projeto de Trabalho Final de Graduação - Centro Universitário Dinâmica das Cataratas. RESUMO Entre os diversos poluentes que podem resultar em impactos ambientais nos ecossistemas aquáticos, os metais pesados são considerados um dos tipos de poluição mais graves. O objetivo deste estudo foi avaliar a presença dos metais pesados tóxicos chumbo, cádmio e cromo no mexilhão dourado (Limnoperna fortunei), testando-o como organismo bioindicador e abordando a concha e os tecidos moles do molusco isoladamente, além da realização de análises de sedimento e água do reservatório da Usina Hidrelétrica de Itaipu. As amostras de mexilhão dourado, sedimento e água foram coletadas em quatro pontos no Reservatório de Itaipu, sendo dois em Foz do Iguaçu (PR), (P1 e P2) e os restantes em São Miguel do Iguaçu (PR), (P3 e P4). O processamento das amostras de mexilhão dourado ocorreu no Laboratório de Engenharia Ambiental do Centro Universitário Dinâmica das Cataratas e a determinação dos metais pesados realizada em espectrofotômetro de absorção atômica (modalidade chama) na Universidade Estadual do Oeste do Paraná, campus de Marechal Cândido Rondon (PR). O sedimento e a água foram coletados e encaminhados para o processamento e determinação dos metais pesados pelo Instituto Ambiental do Paraná (IAP), com sede em Curitiba (PR). As análises físico-químicas da água foram realizadas com sonda multiparâmetros. Os resultados apontaram a detecção dos metais analisados em todas as amostras e em todos os pontos. O sedimento coletado no P1 e P2 apresentaram concentrações acima dos limites permissíveis para o cromo registrando 129,58 mg kg-1 e 82,54 mg kg-1 respectivamente. Quanto à água as concentrações situaram-se abaixo dos limites permissíveis. Dentre os metais analisados o chumbo foi o que registrou maior representatividade no molusco atingindo 0,365 mg kg-1 nos tecidos moles do P3 e 0,69 mg kg-1 nas conchas do P4. Percebeu-se também uma tendência de maior acumulação de chumbo e cádmio na concha e de cromo nos tecidos moles. Palavras-Chave: metais traço, ecotoxicologia, moluscos KERKHOFF, Sabrina. Mexilhão Dourado como Bioindicador de Metais Pesados Tóxicos (Pb, Cd e Cr) no Reservatório de Itaipu. Foz do Iguaçu, 2013. Projeto de Trabalho Final de Graduação - Centro Universitário Dinâmica das Cataratas. ABSTRACT Among the many pollutants that can result in environmental impacts on aquatic ecosystems, heavy metals are considered one of the most serious types of pollution. The objective of this study was to evaluate the presence of toxic heavy metals lead, cadmium and chromium in the golden mussel (Limnoperna fortunei), testing it as a bioindicator organism and addressing the shell and soft tissues of the shellfish alone, in addition to performing analyzes of sediment and water reservoir of Itaipu Hydroelectric Power Plant. The mussel samples, sediment and water were collected at four points in the Itaipu Reservoir, two in Foz do Iguaçu (PR), ( P1 and P2 ) and the other in São Miguel do Iguaçu (PR), (P3 and P4) . The processing of samples of mussel occurred in the Laboratory of the University Center of the Falls Dynamic Environmental Engineering and determination of heavy metals held in atomic absorption spectrophotometer (flame mode) at the State University of West Paraná, campus of Marechal Candido Rondon (PR). The sediment and water were collected and sent for processing and determination of heavy by the Environmental Institute of Paraná (IAP), headquartered in Curitiba (PR) metals. The physico- chemical analysis of water were performed with multiparameter probe. The results showed the detection of metals analyzed in all samples and at all points. The sediment collected in P1 and P2 showed concentrations above the permissible limits for chromium recording 129,58 mg kg-1 and 82,54 mg kg-1 respectively. For water concentrations were below the permissible limits. Among the metals analyzed lead was the one that registered the largest representation in the mollusc reaching 0,365 mg kg-1 in the soft tissues of the P3 and 0,69 mg kg-1 in the shells of P4 . Also noticed a trend of greater accumulation of lead and cadmium in chrome shell and soft tissue. Keywords: trace metals, ecotoxicology, molluscs I LISTA DE FIGURAS Figura 1: Principais fontes naturais e antrópicas de metais pesados para o meio aquático ..................................................................................................................... 11 Figura 2: Mexilhão dourado (Limnoperna fortunei)................................................... 19 Figura 3: Estágios larvais do mexilhão dourado ........................................................ 19 Figura 4: Ciclo de vida do mexilhão dourado da fase planctônica até a bentônica ... 19 Figura 5: Pterodoras granulosos com mexilhão dourado no estômago .................... 21 Figura 6: Classificação da matéria sólida presente na água ..................................... 28 Figura 7 : Localização da Bacia Hidrográfica do Paraná III ....................................... 31 Figura 8: Uso e ocupação do solo na Bacia do Paraná III ........................................ 32 Figura 9: Desenvolvimento da coleta e processamento das amostras ..................... 36 Figura 10: Correlação das concentrações de metais pesados no P1 ....................... 52 Figura 11: Correlação das concentrações de metais pesados no P2 ....................... 52 Figura 12: Correlação das concentrações de metais pesados no P3 ....................... 52 Figura 13: Correlação das concentrações de metais pesados no P4 ....................... 52 II LISTA DE TABELAS Tabela 1: Valores máximos permitidos para os metais chumbo e cádmio em produtos de pesca ..................................................................................................... 21 Tabela 2: Limites toleráveis de poluentes inorgânicos em fração total (mg kg-1) ...... 24 Tabela 3: Limites máximos de poluentes inorgânicos em fração total (mg kg-1) ....... 24 Tabela 4: Limites de concentração de poluentes inorgânicos em fração total (mg kg -1) .................................................................................................................................. 25 Tabela 5: Limites estabelecidos quanto aos metais pesados chumbo, cádmio e cromo nas águas superficiais de classe II ................................................................. 26 Tabela 6: Limites de alguns parâmetros físicos e químicos da água ........................ 27 Tabela 7: Pontos de coleta de amostras de mexilhão dourado, sedimento e água .. 34 Tabela 8: Resultados dos Parâmetros Físico-químicos da água do Reservatório de Itaipu ......................................................................................................................... 38 Tabela 9: Peso médio, dimensão média e biomassa dos indivíduos coletados nos quatro pontos ............................................................................................................ 40 Tabela 10: Resultados quanto à concentração dos metais pesados nas amostras de sedimento .................................................................................................................. 40 Tabela 11: Resultados quanto à concentração de metais pesados na água ............ 44 Tabela 12: Resultados das análises de metais pesados nas amostras de tecidos moles de mexilhão dourado ...................................................................................... 45 Tabela 13: Resultados das análises de metais pesados nas amostras da concha do mexilhão dourado ...................................................................................................... 46 Tabela 14: Somatória das concentrações de metais pesados na concha e nos tecidos moles de mexilhão dourado .......................................................................... 49 III LISTA DE SIGLAS Pb – Chumbo Cd – Cádmio Cr – Cromo Cr6+ - Cromo hexavalente Cr3+ - Cromo Tetravalente Cu – Cobre Fe – Ferro Zn – Zinco Ní – Níquel As – Arsênio Be – Berílio Sn – Estanho Mo – Molibdênio Co – Cobalto Hg – Mercúrio Sb – Antimônio Ba – Bário TI – Tálio Ti – Titânio mg kg-1 – Miligramas por quilo mg L-1 – Miligramas por litro BP3 – Bacia do Paraná III UNT – Unidades Nefelométricas de Turbidez STD – Sólidos Dissolvidos Totais OD – Oxigênio Dissolvido Ph – Potencial Hidrogeniônico CE – Condutividade Elétrica N.1 – Nível 1 N.2 – Nível 2 VMP – Valor máximo permitido IV IAP – Instituto Ambiental do Paraná AOAC – Association of Official Analytical Chemists CONAMA – Conselho Nacional de Meio Ambiente ANVISA – Agencia Nacional de Vigilância Sanitária USEPA – United States Environmental Protection Agency NOAA – National Oceanographic and Atmospheric Administration TEL – Concentração abaixo da qual os efeitos adversos são esperados PEL – Concentração na qual há probabilidade de efeitos adversos UET – Concentração na qual os impactos biológicos são sempre esperados ATSDR – Agency for Toxic Substances and disease Registry CETESB – Companhia de Tecnologia de Saneamento Ambiental CEMIG – Companhia Energética de Minas Gerais SEAB – Secretaria da Agricultura e do Abastecimento SEMA – Secretaria de Estado do Meio Ambiente e Recursos Hídricos UEL – Universidade Estadual de Londrina UFSC – Universidade Federal de Santa Catarina USP – Universidade de São Paulo V SUMÁRIO 1 INTRODUÇÃO ......................................................................................................... 7 2 REFERENCIAL TEÓRICO....................................................................................... 9 2.1 POLUIÇÃO HÍDRICA ............................................................................................ 9 2.1.1 Fontes, Tipos e Consequências da Poluição Hídrica.................................... 9 2.2 CONTAMINAÇÃO DOS ECOSSISTEMAS AQUÁTICOS POR METAIS PESADOS ................................................................................................................ 10 2.2.1 Metais Pesados .............................................................................................. 12 2.2.1.1 Chumbo (Pb) ................................................................................................. 13 2.2.1.2 Cádmio (Cd) .................................................................................................. 14 2.2.1.3 Cromo (Cr) .................................................................................................... 16 2.3 INDICADORES DE CONTAMINAÇÃO HÍDRICA POR METAIS PESADOS ...... 17 2.3.1 Mexilhão dourado como bioindicador de metais pesados ........................ 18 2.3.2 Sedimento como indicador de metais pesados ......................................... 22 2.3.3 Água como indicadora de metais pesados ................................................. 25 2.4 PARÂMETROS FÍSICOS E QUÍMICOS DA ÁGUA ............................................ 26 2.4.1 Turbidez (NTU) ............................................................................................... 27 2.4.2 Sólidos Totais Dissolvidos (STD) ................................................................ 28 2.4.3 Oxigêgio Dissolvido (OD) ............................................................................. 28 2.4.4 Potencial Hidrogeniônico (pH) ..................................................................... 29 2.4.5 Temperatura (ºC) ........................................................................................... 29 2.4.6 Condutividade Elétrica (CE) ......................................................................... 30 3 MATERIAL E MÉTODOS ...................................................................................... 31 3.1 CARACTERIZAÇÃO DA ÁREA DE ESTUDO ..................................................... 31 3.2 PROCEDIMENTOS METODOLÓGICOS ............................................................ 34 3.2.1 Amostragem, processamento e determinação dos metais pesados nas amostras de mexilhão dourado ............................................................................. 34 3.2.2 Amostragem, processamento e determinação dos metais pesados nas amostras de sedimento e água .............................................................................. 35 3.2.3 Análises físico-químicas da água ................................................................. 35 VI 3.2.4 Desenvolvimento da coleta e processamento das amostras ..................... 36 4 RESULTADOS E DISCUSSÃO ............................................................................. 38 4.1 ANÁLISES FÍSICO-QUÍMICAS DA ÁGUA .......................................................... 38 4.2 BIOMETRIA DO MEXILHÃO DOURADO............................................................ 39 4.3 METAIS PESADOS NO SEDIMENTO ................................................................ 40 4.4 METAIS PESADOS NA ÁGUA............................................................................ 44 4.5 METAIS PESADOS NO MEXILHÃO DOURADO ................................................ 45 4.6 CORRELAÇÕES DOS RESULTADOS ENTRE AS AMOSTRAS ....................... 51 5 CONSIDERAÇÕES FINAIS ................................................................................... 55 REFERÊNCIAS BIBLIOGRÁFICAS ......................................................................... 57 ANEXOS ................................................................................................................... 65 Mapa dos Pontos de Coleta.................................................................................... 66 Laudo das Análises de Metais Pesados no Mexilhão Dourado (UNIOESTE) ..... 67 Laudo das Análises de Metais Pesados no Sedimento e Água (IAP) ................. 68 1 INTRODUÇÃO A poluição hídrica é uma questão de preocupações por parte de órgãos governamentais e de pesquisas ambientais, pois devido ao avanço populacional e intensificação do desenvolvimento de atividades antrópicas potencialmente poluidoras registrado nas últimas décadas os ecossistemas passaram a sofrer uma maior pressão. Entre os diversos agentes poluentes que podem resultar em impactos ambientais nos ecossistemas aquáticos, considera-se a poluição por metais pesados uma das mais graves, pois as suas consequências abrangem efeitos de curto, médio e longo prazo. Além disso, a remoção deste tipo de poluente do ambiente ainda é considerada complexa, principalmente tratando-se de grandes áreas contaminadas. Dentre os metais pesados, o chumbo e cádmio são considerados tóxicos e, portanto não possuem nenhuma função considerada essencial aos organismos. Quanto ao cromo apesar de na forma trivalente ser considerado essencial ressaltase que no arranjo hexavalente este metal também é tóxico. A presença de metais pesados nos recursos hídricos pode comprometer a fauna e flora aquática, e pelo fato destes contaminantes possuírem caráter acumulativo a saúde dos consumidores finais de produtos provenientes do meio aquático também pode ser afetada devido à transferência destes compostos ao longo da cadeia trófica. Os moluscos bivalves são amplamente utilizados em estudos de biomonitoramento, e o mexilhão dourado (Limnoperna fortunei), possui características consideradas vantajosas, principalmente pelo fato de ser um organismo filtrador, portanto é capaz de bioacumular compostos metálicos e embora seja um molusco exótico, habita o reservatório de Itaipu há 12 anos, sendo que encontra-se incluso de forma muito representativa na dieta de algumas espécies de peixes. Baseando-se na problemática da contaminação hídrica por metais pesados, este estudo objetivou avaliar a presença dos metais pesados tóxicos chumbo, cádmio e cromo no molusco mexilhão dourado (Limnoperna fortunei), analisando-se isoladamente a concha e os tecidos moles do bivalve, visto que 8 algumas espécies de peixes são incapazes de digerir a concha. Além disso, avaliou-se a presença dos metais no sedimento e na água do reservatório da Usina Hidrelétrica de Itaipu , para complementação do estudo. 9 2 REFERENCIAL TEÓRICO 2.1 POLUIÇÃO HÍDRICA A Política Nacional do Meio Ambiente (Lei nº 6.938/81) define a poluição hídrica como qualquer alteração química, física ou biológica que possa importar em prejuízo a saúde, a segurança e ao bem estar das populações, além de causar danos a flora e a fauna ou comprometer o seu uso para finalidades sociais e econômicas. Segundo Sirvinskas (2006) a poluição hídrica resulta na degradação da qualidade ambiental decorrente de atividade direta ou indireta que lance matéria ou energia nas águas em desacordo com os padrões ambientais estabelecidos. Sabendo que a água é constituída por duas moléculas de hidrogênio e uma de oxigênio (H2O), a alteração desses elementos constituintes pode resultar em um recurso impróprio para o consumo ou até mesmo para outros fins (SIRVINSKAS, 2006), pois a emissão de substâncias orgânicas ou inorgânicas comprometem as propriedades naturais da água, resultando em impactos negativos (FIORILLO, 2005). 2.1.1 Fontes, Tipos e Consequências da Poluição Hídrica O intenso desenvolvimento populacional e econômico das últimas décadas resultou em uma maior pressão sobre os recursos naturais, de modo que atualmente são raros os ecossistemas livres de interferências antrópicas. Um dos fatores contribuintes para a pressão exercida aos recursos naturais provém da extração de matéria-prima para o desenvolvimento atrelado à geração de resíduos ou efluentes considerados poluentes que são lançados no meio ambiente (GOULART e CALLISTO, 2003). A poluição hídrica pode ser difusa ou pontual, evidenciando que ela concretiza-se pela condução dos poluentes até as águas superficiais ou 10 subterrâneas por meio do lançamento direto, precipitação, escoamento pela superfície do solo ou infiltração, resultando em impacto ambiental (MARTINI e LANNA, 2003). Pereira (2004), classifica a poluição hídrica quanto à natureza, em poluição química ocasionada pelos poluentes biodegradáveis ou persistentes, física resultante da alteração das variáveis físicas da água e biológica pela ação de organismos patogênicos, como vírus, protozoários, bactérias e vermes. Segundo Desirío (1992), apud Chambo (2011) as fontes de poluição para águas superficiais podem ser de origem natural ocasionada por chuvas, escoamento superficial, salinização, decomposição de vegetais e animais, e que, portanto não provém de atividades antrópicas, como: poluição industrial resultante do lançamento de resíduos líquidos sólidos ou gasosos; poluição urbana oriunda de efluentes domésticos; poluição agropastoril proveniente de atividades agrícolas e utilização de defensivos e fertilizantes e por fim a poluição acidental que pode atingir os corpos d’água. Quanto as consequências da poluição hídrica, podem resultar em diversos problemas, dentre eles a degradação da qualidade da água, eutrofização, comprometimento da biodiversidade aquática, contaminação e mortandade de organismos aquáticos (GOULART e CALLISTO, 2003). Todavia as consequências de um determinado poluente dependem das suas concentrações, do potencial de diluição e da capacidade suporte do ambiente (CHAMBO, 2011). Diante disto, foram criadas as resoluções do Conselho Nacional de Meio Ambiente (CONAMA) n° 357/05, que classifica os corpos d’água e 430/11, que determina as condições para lançamento de efluentes. 2.2. CONTAMINAÇÃO DE ECOSSISTEMAS AQUÁTICOS POR METAIS PESADOS A expressão “metal pesado” aplica-se aos elementos químicos que tem massa específica maior que 5 g cm-3 ou que possuem número atômico maior que 20 (GONÇALVES Jr. et al., 2000). Como substituto do termo “metais pesados”, Duffus (2002) coloca que ultimamente tem-se utilizado a denominação “elementos traço” 11 para caracterizar metais em pequenas concentrações no ambiente e nos seres vivos. Antigamente a principal fonte de elementos traço para o ambiente aquático era proveniente do intemperismo natural das rochas. Todavia as atividades antrópicas intensificaram este processo (Figura 1), devido as atividades industriais e seus efluentes, mineração, efluentes domésticos e lixiviação de águas sobre áreas cultivadas com adubos químicos e defensivos agrícolas utilizados com finalidade corretiva ou nutricional que contêm os mais variados elementos traço, como cádmio, mercúrio, chumbo, cobre e etc. Além disso, a atmosfera também é uma fonte de metais pesados nos ecossistemas aquáticos, visto que diversas fontes como queimadas, partículas de origem vulcânica e emissões industriais transportadas pelos ventos contribuem para a contaminação (ESTEVES, 2011; CAMPOS et al., 2005), e considera-se que cerca da metade dos metais pesados que contaminam o meio aquático são depositados a partir do ar, seja na forma de gases ou como espécies adsorvidas sobre materiais em suspensão (BAIRD, 2002). Figura 1: Principais fontes naturais e antrópicas de metais pesados para o meio aquático Fonte: ESTEVES, 2011 No entanto, é comprovado que a contribuição antrópica é diversas vezes mais significativa que a natural. Sendo que para alguns elementos como o chumbo (Pb) considera-se que a origem antrópica seja 16 vezes superior às naturais. Em rios e lagos a carga total de elementos traço depende de características geológicas 12 e ecológicas das bacias de drenagem e das atividades humanas desenvolvidas no entorno. O transporte dos metais pesados no meio aquático é realizado sob a forma dissolvida e em suspensão, todavia tendem a se apresentar como colóides em suspensão ou adsorvidos por substâncias orgânicas ou minerais, sendo que a distribuição entre estas formas se dá em função do tipo de elemento e da sua carga total no meio (ESTEVES, 2011). A presença de um metal em um corpo d’água pode afetar os organismos aquáticos por meio de intoxicação ou bioacumulação tendo seu efeito potencializado ao longo da cadeia alimentar (LIMA e MERCON, 2011). Justamente por isso é importante que os ecossistemas aquáticos sejam monitorados regularmente (CAVALCANTE, 2009). 2.2.1 Metais Pesados Os metais pesados podem ser classificados em essenciais como o cobre (Cu), ferro (Fe), manganês (Mn), zinco (Zn), molibdênio (Mo), cobalto (Co), cromo (Cr) e níquel (Ní), e tóxicos, como cádmio (Cd), mercúrio (Hg), chumbo (Pb), arsênio (As), antimônio (Sb), bário (Ba), berílio (Be), estanho (Sn), tálio (TI) e titânio (Ti) (MALAVOLTA et al., 2006), sendo esses benéficos, pois participam das atividades metabólicas de plantas e animais, desde que não estejam presentes em níveis elevados. Quanto aos metais tóxicos, o simples fato da sua presença, mesmo em níveis de traço, podem indicar riscos de contaminação (TUZEN, 2003). Entretanto o fato da poluição por metais pesados em ecossistemas aquáticos ou terrestres ocorrer geralmente de maneira lenta resulta em uma falsa impressão de que esta poluição não implica em graves efeitos (PEREIRA e QUINÁIA, 2007). A principal característica que eleva a preocupação com os metais pesados é que eles possuem efeito cumulativo, ou seja, ao ingressar em um organismo a velocidade de eliminação é menor que a velocidade de entrada ocorrendo assim a bioacumulação do metal (GOMES e SATO, 2011), sendo que a flora e fauna aquática que bioacumulam metais, podem representar riscos se 13 consumidos, podendo ocasionar graves intoxicações ao longo da cadeia alimentar (PEREIRA, 2004). Portanto, dentre as várias formas de contaminação do meio ambiente, a contaminação da água com metais pesados é uma das poluições de maior preocupação aos pesquisadores e órgãos governamentais envolvidos no controle de poluição (OLIVEIRA et al., 2001). 2.2.1.1 Chumbo (Pb) O chumbo (Pb) é um metal pesado considerado tóxico mesmo em pequenas concentrações, pois não é essencial ao metabolismo celular e pode provocar inibições em algumas enzimas e alterações no metabolismo das células (PEREIRA, 2004). A utilização do chumbo é relatada desde épocas primitivas. Há registros de que os egípcios utilizavam este metal há mais de 8 mil anos e até hoje a sua utilização é bastante ampla, estando na sexta posição na lista dos metais mais utilizados no mundo, devido a sua versatilidade (SILVA, 2001). Este elemento pode ser utilizado na forma de metal puro ou ligado a outros metais, assim como em compostos químicos como os óxidos de chumbo e os sais de chumbo. Na forma de metal puro normalmente é aplicado em indústrias químicas e de construção para obtenção de soldas, lâminas, cabos e revestimentos. Quanto aos óxidos são utilizadas baterias elétricas, vidros, e componentes de borracha e os sais servem como base para tintas e pigmentos (CETESB, 2012). A liberação do chumbo no ambiente se dá por atividades antrópicas, principalmente do ramo industrial. Este elemento é encontrado na atmosfera na forma particulada podendo ser transportada por longas distâncias. Os ramos industriais que mais contribuem com a contaminação por chumbo são as indústrias de petróleo, cerâmica, mineração e gráficas (PEREIRA, 2004). A intoxicação por chumbo em longo prazo denomina-se de saturnismo ou plumbismo e pode ser proveniente do contato com água, ar ou alimentos contaminados (IRYODA, 2008). 14 A contaminação da água por chumbo pode ser proveniente de fontes naturais ou antropogênicas e ocorre principalmente pelo escoamento superficial do solo que transporta os contaminantes até os rios e lagos onde o metal é adsorvido aos sólidos suspensos, sedimentos ou permanece na coluna d’água. Portanto, os organismos aquáticos como plantas e animais ficam suscetíveis a absorção deste metal pesado de efeito cumulativo que se aloja em vários órgãos e tecidos (CETESB, 2012; PAOLIELLO e CHASIN, 2001). A característica cumulativa indica que a contaminação por chumbo também pode prejudicar a saúde humana, visto que ao ingerir alimentos contaminados o metal é bioacumulado no organismo (PEREIRA, 2004). O chumbo pode ser absorvido pela via oral e inalatório, sendo que 80% do chumbo ingressa no organismo por meio do consumo de alimentos contaminados e contato com sujeiras e poeiras que contenham o metal. O sistema nervoso é o local mais afetado pelo chumbo, independente da faixa etária, embora crianças tendem a ser mais susceptíveis. Quanto as consequências destacam-se os sintomas: fraqueza, irritabilidade, náusea, dor abdominal e anemia (CETESB, 2012). 2.2.1.2 Cádmio (Cd) O cádmio é um metal não essencial e altamente tóxico, estando presente na natureza geralmente associado a sulfetos e minérios de zinco, cobre e chumbo. Portanto, as principais fontes de cádmio provêm de subprodutos da fusão do zinco, já que os dois metais ocorrem usualmente juntos (BAIRD, 2002). Quanto as fontes naturais de cádmio pode-se citar as atividades vulcânicas, erosão de rochas sedimentares e incêndios florestais. Em relação às fontes antrópicas ressaltam-se as atividades mineradoras, produção e consumo de produtos que contenham cádmio em sua composição como baterias, pilhas, componentes eletrônicos, pigmentos, ligas, além de emissões geradas por indústrias de ferro e aço, soldas, combustíveis fósseis, cimento e fertilizantes. Também é empregado como anticorrosivo em aço galvanizado e pode ser utilizado como pigmentos em plásticos e na manufatura de pilhas e baterias recarregáveis compostas por níquel e cádmio (CETESB, 2012). Normalmente, as poluições por 15 cádmio ocorrem em áreas próximas às fundições de metais como chumbo, zinco e cobre, além disso, a incineração de materiais que contenham cádmio em sua composição também é considerada uma fonte de poluição (BAIRD, 2002). Outra aplicação importante do cádmio é na indústria de PVC e plásticos afins, onde o metal é empregado como estabilizador inibindo a degradação do PVC. Além disso, também é aplicado na indústria do vidro, na fotografia, na litografia e como anti-helmíntico para aves e suínos (USP, 2008). Na atmosfera este o cádmio apresenta-se principalmente na forma de óxidos de cádmio e cloreto de cádmio proveniente dos processos de incineração. Alguns sais e complexos de cádmio apresentam significativa mobilidade na água, enquanto que os complexos não solúveis tendem a serem adsorvidos pelos sedimentos registrando baixa mobilidade, embora exista o risco de contaminação da cadeia alimentar a partir do sedimento contaminado (CETESB, 2012). Um dos fatores que influenciam na mobilidade do cádmio em sedimentos é o pH, visto que em pH ácido, a dessorção de cádmio é favorecida, pois íons H+ podem deslocar uma fração do metal adsorvido em forma não-trocável (MCBRIDE, 1989 apud PIERANGELI, et al., 2005), considera-se portanto, que a medida que a acidez do meio se intensifique a disponibilidade do elemento tenderá a ser maior, evidenciando que este metal possui caráter cumulativo em plantas aquáticas, invertebrados, peixes, mamíferos e sedimentos (PIERANGELI, et al., 2005). A principal via de exposição à contaminação por cádmio é a oral, sendo que a ingestão de alimentos ou água com altas concentrações do metal resultam em efeitos a curto e em longo prazo, sendo considerados os efeitos de curto prazo a ocorrência de irritação no estômago, vômitos, diarreia, paralisia muscular, salivação excessiva, distúrbios sensoriais,convulsões, choque e falhas no sistema renal, e a longo prazo podem causar danos ao fígado, rins, ossos e sangue. Evidenciando que considera-se letal a dose de 1 g de cádmio (CETESB, 2009; USP, 2008; MACEDO, 2004). Dentre os alimentos que mais representam riscos de contaminação por cádmio destacam-se os frutos do mar, batata, arroz, e outros cereais. Os alimentos cultivados no solo apresentam risco de contaminação devido a similaridade do cádmio e do zinco, o que por vezes gera a absorção do cádmio pelas plantas ao invés do zinco, principalmente nos cultivos que utilizam fertilizantes fosfatados (BAIRD, 2002). 16 2.2.1.3 Cromo (Cr) O cromo (Cr) é um metal pesado considerado essencial, todavia algumas de suas formas podem ser tóxicas. As variações do cromo são divididas de acordo com os números de oxidação do metal, todavia as mais ocorrentes são Cr 3+ e Cr6+. A forma hexavalente (Cr6+) é resultado de processos industriais, sendo considerado altamente tóxico e cancerígeno, enquanto que o trivalente (Cr3+) possui ocorrência natural no meio ambiente e é essencial ao organismo (ATSDR, 2013; USP, 2008). A principal função do cromo trivalente (Cr3+) no organismo esta relacionada ao metabolismo da glicose, pois ele potencializa a ação da insulina no metabolismo dos açúcares, sendo importante para a produção de glicogênio que servirá de energia para os músculos, além disso, por desempenhar esta função o Cr3+ auxilia no fornecimento de glicose para o cérebro, uma vez que a ausência da mesma resulta em sérios distúrbios (USP, 2008). No entanto, o Cr3+ pode se tornar especialmente tóxico para os seres humanos, já que sua acumulação nos tecidos pode inibir vários sistemas enzimáticos dos organismos vivos e também afetar a ecologia do meio ambiente quando presente em grande escala (ANIRUDHAN e RADHAKRISHNAN, 2007). O cromo hexavalente (Cr6+) é considerado mais perigoso, pois é cancerígeno e causa forte impacto na estabilidade dos ecossistemas provocando efeitos adversos a saúde (MIRANDA et al., 2011). Além disso, caracteriza-se por ser de fácil penetração nos tecidos onde se reduz a cromo trivalente (Cr 3+), resultando no aumento de sua concentração até níveis tóxicos, gerando problemas às estruturas celulares (GOMES et al., 2005). No ramo industrial o cromo é empregado para fabricação de aços inoxidáveis, estruturas da construção civil, fertilizantes, ligas metálicas, fornos metalúrgicos a partir de tijolos, manufatura de tintas e pigmentos, tratamento de madeira e de água (CETESB, 2009; USP, 2008). Todavia entre estas utilizações a principal responsável por contaminação por cromo são as fábricas de curtume de couro, visto que o cromo é amplamente utilizado devido ao seu custo reduzido e sua eficiência no beneficiamento, principalmente pelo fato de proporcionar resistência e permitir o armazenamento das peças por longos períodos (USP, 2008). 17 As vias de acesso do cromo no organismo ocorrem pelo contato direto ou consumo de água e alimentos contaminados, sendo que pode resultar em alergias na pele, falência de órgãos como rins, afetar o sistema imunológico podendo e até levar a morte. Os resíduos industriais que contém cromo devem passar por um tratamento, visto que a sua deposição no solo ou em corpos hídricos incide em riscos a população, pois a água e os alimentos provenientes destes locais, se ingeridos poderão provocar sérios danos à saúde (USP, 2008). Entre os alimentos que possuem cromo destacam-se as carnes, cereais integrais, oleaginosas e leguminosas e atualmente, esse mineral tem sido utilizado como suplemento alimentar no meio esportivo com a proposta de promover maior ganho de massa muscular e maior perda de gordura corporal (GOMES et al., 2005). 2.3 INDICADORES DE CONTAMINAÇÃO HÍDRICA POR METAIS PESADOS O monitoramento de variáveis físicas e químicas no meio aquático apresenta vantagens, como a identificação imediata das propriedades físicas e químicas, entretanto estas análises demonstram uma avaliação momentânea da área, enquanto que os bioindicadores, por exemplo, abrangem uma visão mais dinâmica, demonstrando melhor os efeitos das alterações da qualidade da água sobre as comunidades biológicas (GOULART e CALLISTO, 2003). A ocorrência de pequenas concentrações de metais pesados no ambiente aquático é algo constante, contudo, certos fatores têm elevado as suas concentrações, ocasionando a contaminação dos ecossistemas aquáticos, sendo o pescado a principal via de intoxicação de seres humanos (ALVES et al., 2009). Segundo Larcher (2000), diversos organismos podem ser utilizados como bioindicadores de contaminação ambiental pelo fato de possuírem respostas para vários poluentes, sendo então empregados para detectar qualitativa e quantitativamente a poluição hídrica. Todavia fatores como hábito alimentar, tamanho e idade dos organismos, podem afetar as concentrações dos metais nesses animais, podendo variar de espécie para espécie, de região para região, assim como nas diferentes épocas do ano (FORSTNER e WITTMANN, 1983 apud ANDRADE et al., 2011). 18 Alguns dos indicadores utilizados na avaliação de impactos ambientais em ecossistemas aquáticos são os macroinvertebrados bentônicos, água, sedimento de fundo, peixes e comunidade perifítica (GOULART e CALLISTO, 2003 e TOMAZELLI, 2003). Quanto aos peixes, a absorção de metais pesados ocorre por meio da pele ou escama, vias de respiração e alimentação (GOMES e SATO, 2011). Os problemas decorrentes da contaminação em peixes são distúrbios no crescimento e na reprodução além de mudanças histopatológicas na pele, brânquias, fígado e rins (VITEK et al., 2007). Todavia o tamanho, hábito alimentar, peso, idade, o comprimento e o tipo da espécie, são fatores que estão relacionados com a capacidade de acumulação (GOMES e SATO, 2011). Os macroinvertebrados bentônicos possuem algumas características como diversidade biológica, hábito sedentário, ciclo de vida relativamente curto, alimentação baseada principalmente em sedimentos, e serem importantes componentes dos ecossistemas aquáticos (GOULART e CALLISTO, 2003). Portanto, devido a estas características estes organismos têm sido amplamente utilizados em avaliações de efeitos antrópicos sobre ecossistemas aquáticos, evidenciando que entre os invertebrados bentônicos encontra-se a classe dos bivalves representada por ostras, mariscos e mexilhões (AUGUSTINI e MUCELIN, 2009). 2.3.1 Mexilhão dourado como bioindicador de metais pesados O mexilhão dourado (Limnoperna fortunei) pertence ao filo Mollusca, mais especificamente a classe dos bivalves, ordem Mytiloida e família Mytilidae. É um bivalve popularmente conhecido como mexilhão dourado, devido a sua cor característica, sendo que o nome Limnoperna fortunei, do grego “Limno”, que significa água doce e “perna”, que significa mexilhão. Este molusco é originário de rios do sudoeste asiático, distribuindo-se por Hong Kong, Japão e Taiwan e atinge um tamanho médio de 3 cm a 4 cm (Figura 2), com um ciclo de vida de aproximadamente 3 anos (MANSUR et al., 2012). 19 Figura 2: Mexilhão dourado (Limnoperna fortunei) Fonte: MANSUR et al., 2012 O mexilhão dourado caracteriza-se por possuir maturação sexual precoce e alta eficiência na reprodução, sendo que a mesma ocorre externamente (CEMIG, 2009). O desenvolvimento larval do mexilhão dourado (Figura 3 e 4) compreende duas etapas, sendo a primeira delas composta por larvas desprovidas de valvas (ovos, trocófora, pré-véliger), e a segunda com as larvas dotadas de valvas (véliger tipo D, umbonadas, pedivéliger e plantígrada) (DRAGO et al., 2009). Figura 3: Estágios larvais do mexilhão dourado. a) Ovo; b) Pré-véliger com valvas incompletas; c) Véliger tipo D; d) Véliger pré-umbonada; e) Véliger umbonada; f) Plantígrada Fonte: DRAGO et al., 2009 Figura 4: Ciclo de vida do mexilhão dourado da fase planctônica até a bentônica Fonte: MANSUR et al., 2012 20 No estágio adulto o mexilhão dourado possui hábito epifaunal e comportamento gregário fixando-se em substratos rígidos por meio do bisso que é um feixe de filamentos protéicos muito resistentes que se estende da base do pé até o substrato onde o organismo costuma se aderir, formando assim a bioincrustação (RUPPERT, 2005). O mexilhão dourado também caracteriza-se por ser um bivalve filtrador, utilizando plâncton, material em suspensão e matéria orgânica para obter seu alimento, umas vez que não possui rádula, sendo que o seu potencial de filtração atinge cerca de 100 a 150 mL h-1, o que lhe confere o título de grande eficiência se comparado a outros organismos filtradores (MANSUR et al., 2012). Justamente por essa característica, Ravera e Riccardi (1997) apud Augustini e Mucelin (2009) enfatizam que organismos filtradores, como o mexilhão dourado, são capazes de bioacumular metais pesados entre outras substâncias, e, além disso, são animais considerados resistentes a alterações bióticas, portanto podem ser utilizados como bioindicadores de poluição. Mansur et al. (2012), ressaltam a característica do mexilhão dourado de ser um ativo filtrador e atuar como bioacumulador de uma série de substâncias tóxicas, inclusive metais pesados, em seus tecidos e na concha. Além disso, este bivalve é apreciado por diversas espécies de peixes, portanto existe risco sanitário de bioacumulação de metais nos humanos que consomem peixes na sua alimentação. A mudança da dieta original de algumas espécies de peixes esta atribuída a elevada disponibilidade do bivalve invasor que passou a integrar a cadeia alimentar, sendo consumido inclusive por espécies consideradas representativas em relação à pesca artesanal, comercial e desportiva, ou até mesmo utilizada na piscicultura. Dentre as espécies identificadas como predadoras do Limnoperna fortunei no Rio Paraná e Reservatório de Itaipu, destacam-se o Armado (Pterodoras granulosus), Bagre amarelo, Mandi amarelo (Pimelodus maculatus), Bagre, Mandi (Pimelodus argentus), Cascudo abacaxi (Megalancytrus parananus), Pacu (Piaractus mesopotamicus), Piava, Piapara (Leporinus obtusidens), Pintado (Schizodon borelli) entre outras (GARCIA e MONTALTO, 2009). Quanto a espécie Pterodoras granulosus (Figura 5), observou-se que após a invasão do Limnoperna fortunei ocorreu uma grande mudança na sua dieta, sendo que no estudo publicado por Garcia e Montalto (2009), e voltado para a 21 análise do trato digestivo desta espécie, foram encontrados exemplares que continham até 2830 indivíduos de mexilhão dourado, constituindo 100% da dieta. Figura 5: Pterodoras granulosos com mexilhão dourado no estômago Portanto, os moluscos, especialmente os bivalves, fornecem um panorama localizado sobre a contaminação, pois são organismos relativamente sedentários. Já os peixes fornecem um resultado mais abrangente, pois em decorrência do hábito migratório por parte de algumas espécies a acumulação dos poluentes ocorre por todas as regiões por onde passam (TOMAZELLI, 2003). A legislação brasileira para metais pesados em produtos de pesca é estabelecida pela Agência Nacional de Vigilância Sanitária (ANVISA) que estipula os seguintes valores máximos permitidos (VMP), descritos na Tabela 1, para os metais chumbo e cádmio, quanto ao cromo não existem limites estipulados. Tabela 1: Valores máximos permitidos para os metais chumbo e cádmio em produtos de pesca Metal pesado Valor máximo permitido (VMP) -1 Chumbo (Pb) 2,0 mg kg Cádmio (Cd) 1,0 mg kg -1 Fonte: Portaria 685 de 1998 da ANVISA. Vários são os exemplos da presença de metais pesados no mexilhão dourado Marengoni et al. (2013), encontrou valores de concentrações de chumbo com média de 35,25 e 32,58 mg kg-1 para os dois pontos avaliados no reservatório 22 da Usina Hidrelétrica de Itaipu, no município de Santa Helena – PR. Cabe ressaltar que os pontos analisados na pesquisa acima, encontravam-se próximos a tanques redes, locais esses que recebem rações e produtos industrializados. Augustini e Mucelin (2009), obtiveram resultado de 63 mg kg-1 de chumbo e 8,0 mg kg-1 de cádmio em análise realizada com mexilhão dourado no reservatório da Usina Hidrelétrica de Itaipu, no município de São Miguel do Iguaçu – PR. Resultados semelhantes foram obtidos em outros trabalhos com outras espécies de bivalve. Um exemplo é Maia et al., (2006) que, avaliando o teor de chumbo em mexilhões da espécie Perna perna em praias da região metropolitana do Rio de Janeiro, obteve valores de 2,0 ± 0,93 mg kg-1. Emerenciano et al., (2009), em análises realizadas com o molusco Anomalocardia brasiliana proveniente do estuário Potengi/Jundiaí no Rio Grande do Norte, encontrou concentrações de 4,9 mg kg-1 de chumbo, 0,2 mg kg-1 de cádmio e 3 mg kg-1 de cromo. 2.3.2 Sedimento como indicador de metais pesados Sedimento é o resultado das deposições de materiais em suspensão ao longo do tempo em rios, lagos e oceanos, sendo considerados como uma parte integrante do sistema natural aquático, juntamente com a biota aquática. Em ambientes aquáticos o sedimento constitui-se como uma fase mineralógica com partículas de tamanho, forma e composição química diferente (HUTCHISON et al., 1943 apud SILVA, 2002). Os processos de erosão intensificam o transporte de sedimento orgânico e inorgânico até os rios e lagos, sendo que os locais mais vulneráveis à deposição são as zonas de várzea ou remansos, que apresentam baixa velocidade (TUNDISI, 2008). Os sedimentos atuam como um local de deposição e acumulação de compostos orgânicos, como inseticidas e herbicidas ou inorgânicos, como os metais pesados. A deposição destes compostos pode variar de acordo com o tempo de resistência da água no rio ou reservatório, ou seja, esta relacionada com a sedimentação destes compostos que podem ser provenientes de fontes difusas ou pontuais (COTTA, 2003). A presença de elevados índices de metais pesados nos 23 sedimentos pode indicar a existência de fontes de contaminação de ação antrópica e não somente proveniente do intemperismo natural de rochas (JESUS et al., 2003). A análise do material particulado, seja em suspensão ou na forma de sedimento de fundo representa um excelente parâmetro para estudos de contaminação por metais pesados, visto que estas partículas associam-se aos metais traço e, dependo de fatores como vazão e velocidade da água tendem a decantar e incorporar o sedimento de fundo, sendo assim, a composição química do sedimento pode refletir na composição da coluna d’água (TOMAZELLI, 2003). Com isso, a utilização de sedimentos como indicadores da qualidade de ecossistemas aquáticos intensifica-se, uma vez que por meio do mesmo é possível retratar condições ambientais que nem sempre são detectadas na avaliação da água (CETESB, 2006). Além disso, os sedimentos passaram a ser tratados não só como um local de deposição de poluentes, mas também como uma parte integrante dos ecossistemas aquáticos (COTTA, 2003). Considera-se o papel desenvolvido pelos sedimentos extremamente importante para a avaliação de contaminação de ambientes aquáticos, pois eles refletem a poluição de maneira mais abrangente, ou seja, viabilizam informações de caráter espacial e temporal, visto que é possível detectar a presença de contaminantes que por vezes não são detectados na água. Portanto, a acumulação de poluentes nos sedimentos os qualificam como um excelente ponto de partida para estudos de impacto ambiental (MOZETO, 1996 apud COTTA, 2003). Normalmente, em rios e reservatórios, as concentrações de metais pesados nos sedimentos em suspensão normalmente são superiores às encontradas na forma dissolvida ao longo da coluna d’água. Todavia a mobilidade dos metais entre as duas formas depende de alguns fatores como as características dos íons metálicos, o tamanho das partículas, a concentração dos poluentes e o conteúdo orgânico (TOMAZELLI, 2003). A resolução nº 344/2004 do CONAMA dispõe sobre as diretrizes para avaliação de materiais a serem dragados em águas jurisdicionais brasileiras, com o objetivo de estabelecer os limites toleráveis de parâmetros físico-químicos de sedimentos para lançamento em outras áreas de modo a não representar riscos a biota, classificando os sedimentos em nível 1 e nível 2 de acordo com a sua qualidade, onde o nível 1 é considerado o limiar abaixo do qual são previstos efeitos adversos a biota e o nível 2 considera-se o limiar acima do qual prevê-se um 24 provável efeito adverso a biota. Sendo assim os limites para chumbo, cádmio e cromo estão descritos na Tabela 2: -1 Tabela 2: Limites toleráveis de poluentes inorgânicos em fração total (mg kg ) Metal Pesado Nível 1 Nível 2 -1 91,3 mg kg -1 3,5 mg kg Chumbo (Pb) 35 mg kg Cádmio (Cd) 0,6 mg kg Cromo (Cr) 37,3 mg kg -1 90 mg kg -1 -1 -1 Fonte: Resolução nº 344/2004 do CONAMA A resolução nº 420/2009 do CONAMA que dispõe sobre critérios e valores orientadores de qualidade do solo quanto à presença de substâncias químicas e estabelece diretrizes para o gerenciamento ambiental de áreas contaminadas por essas substâncias em decorrência de atividades antrópicas, estipula os seguintes valores máximos permitidos de concentração de metais pesados em sedimentos de água corrente, conforme a Tabela 3. -1 Tabela 3: Limites máximos de poluentes inorgânicos em fração total (mg kg ) -1 Metal Pesado Limite Máximo (mg kg ) -1 Chumbo (Pb) 72 mg kg Cádmio (Cd) 1,3 mg kg Cromo (Cr) 75 mg kg -1 -1 Fonte: Resolução nº 420/2009 do CONAMA A Agência Americana de Proteção Ambiental (United States Environmental Protection Agency – USEPA), Canadá e União Européia por meio do Programa de Sedimentos de Corrente da Administração Nacional Oceanográfica e Atmosférica (National Oceanographic and Atmospheric Administration – NOAA) estabelecem as concentrações limites para chumbo, cádmio e cromo em sedimentos conforme a Tabela 4, sendo estes parâmetros adotados como o padrão internacional e amplamente utilizados em publicações e pesquisas ambientais, visto que a USEPA é um dos órgãos mais ativos no desenvolvimento de indicadores ambientais e critérios que possam nortear as intervenções necessárias à conservação e sustentabilidade dos recursos naturais. 25 -1 Tabela 4: Limites de concentração de poluentes inorgânicos em fração total (mg kg ) Metal Pesado TEL* PEL** UET*** -1 Chumbo (Pb) 35 mg kg Cádmio (Cd) 0,596 mg kg Cromo (Cr) 57,3 mg kg -1 -1 91,3 mg kg -1 127 mg kg 3,53 mg kg -1 3 mg kg 90 mg kg -1 -1 -1 95 mg kg -1 *TEL: concentração abaixo da qual efeitos adversos são esperados **PEL: concentração na qual há probabilidade de ocorrência de efeitos adversos ***UET: concentração na qual os impactos biológicos adversos sempre são esperados Fonte: Administração Nacional Oceanográfica e Atmosférica (BUCHMAN, 2008) Alguns estudos realizados no Brasil, demonstram a presença de metais pesados tóxicos em sedimentos, como Alves et al., (2010) em estudo desenvolvido no córrego Monte Alegre e seus afluentes, que corresponde a um tributário do córrego Ribeirão Preto no município de Ribeirão Preto (SP), encontraram médias de concentração de 462,092 mg kg-1 para chumbo, 0,303 mg kg-1 para cádmio e 403,717 mg kg-1 para cromo, sendo foram utilizados como parâmetro de comparação a Resolução 344/2004 do CONAMA e padrões holandeses. Barreto e Bitar (2011), encontraram valores entre 2,8x10-6 a 3,0 x10-6 mg kg-1 de cádmio e 2,5x10-6 mg kg-1 a 3,36 x10-5 mg kg-1 para chumbo no sedimento de corrente do córrego Aragão em Patos de Minas/MG, sendo que o autor considerou não haver contaminação pois os valores apresentaram-se inferiores aos estabelecidos pela resolução nº 420/2009 do CONAMA. 2.3.3 Água como indicadora de metais pesados Os metais pesados podem estar presentes na água na forma dissolvida, coloidal ou particulada, evidenciando que estes compostos inferem grande importância ecológica e ecotoxicológica (PIRES e SILVA, 2011). Os níveis de metais pesados dissolvidos na água variam, portanto a avaliação deste parâmetro de forma isolada se mostra insuficiente para obter um panorama sobre a contaminação, sendo necessária a junção de análises da água com outras fontes de obtenção de dados. A variação da concentração de metais pesados ao longo da coluna d’água oscila por diversos fatores, dentre eles é possível citar interferências ocasionadas por diluição pela precipitação, fluxo de 26 água, descargas locais de efluentes urbanos e industriais, variações de parâmetros físico-químicos, estações do ano entre outros (TOMAZELLI, 2003). A resolução nº 357/2005 do Conselho Nacional de Meio Ambiente (CONAMA) dispõe sobre a classificação dos corpos de água e estabelece as condições e padrões quanto as concentrações máximas para parâmetros físicos, químicos e biológicos. Sendo que, para os metais chumbo, cádmio e cromo em águas superficiais os limites encontram-se descritos na Tabela 5: Tabela 5: Limites estabelecidos quanto aos metais pesados chumbo, cádmio e cromo nas águas superficiais de classe II. -1 Metal pesado Limite Máximo (mg L ) -1 Chumbo 0,01 mg L Cádmio 0,001 mg L Cromo 0,05 mg L 1 -1 - Fonte: Resolução 357 de 2005 do CONAMA São diversos os trabalhos que determinam a presença de metais na água usando como parâmetro de determinação a Resolução 357/2005 do Conama, um deles é o de Alves et al. (2010), que encontraram médias de concentração dos metais pesados chumbo, cádmio e cromo de 1,2x10-2 mg L-1, 3,43x10-5 mg L-1 e 4,05x10-4 mg L-1, respectivamente. Barreto e Bitar (2011), também determinaram a presença de metais em águas para consumo e verificaram valores entre 5x10-6 e 1,5x10-5 mg L-1 de cádmio e 1,3x10-5 a 1,19x10-4 mg L-1 de chumbo nos três pontos amostrados em estudo realizado no córrego Aragão em Patos de Minas (MG). 2.4 PARÂMETROS FISICOS E QUÍMICOS DA ÁGUA A Resolução do Conama nº 357 de 2005 estabelece a classificação das águas doces, salobras e salinas. O reservatório de Itaipu é considerado de classe II para águas doces, visto que atende as principais características quanto a sua utilização, abrangendo o abastecimento humano após tratamento convencional, proteção de comunidades aquáticas, recreação de contato primário, irrigação, aquicultura e atividades de pesca. 27 Além da classificação, esta resolução estabelece alguns limites quanto a parâmetros físicos, químicos e biológicos de acordo com a classe a qual pertence. Entre estes parâmetros destacam-se os seguintes (Tabela 6): Tabela 6: Limites de alguns parâmetros físicos e químicos da água Parâmetro Limite Turbidez < 100 UNT Sólidos dissolvidos totais 500 mg L Oxigênio dissolvido > 5 mg L pH 6,0 a 9,0 -1 -1 Fonte: Resolução nº 357 de 2005 do CONAMA 2.4.1 Turbidez (UNT) A turbidez da água caracteriza-se como o grau de interferência que um feixe de luz sofre ao atravessar uma determinada amostra e é expressa em termos de unidades de turbidez (UNT – Unidades Nefelométricas de Turbidez). Esta interferência ocorre pela absorção ou espalhamento do feixe de luz devido à ação de materiais em suspensão como argila, areia, matéria orgânica e inorgânica, plâncton, organismos microscópicos e compostos corados solúveis (UNIVERSIDADE DO MINHO, 2007). Portanto o tamanho das partículas em suspensão varia desde grosseiro à colóide, dependendo do grau de turbulência, e o resultado pode ser a água com aparência nebulosa, sendo esteticamente indesejável e potencialmente perigosa (COLOMBO, 2013), pois elevados índices de turbidez reduzem a zona eufótica e comprometem a atividade fotossintética das algas submersas, além disso, também pode suprimir a ictiofauna, resultando em impactos nas comunidades biológicas (CETESB, 2009 e MACEDO, 2004). 28 2.4.2 Sólidos Totais Dissolvidos (STD) Todas as partículas que não fazem parte da matéria líquida da água são classificadas como material sólido, todavia existe uma diversidade quanto a classificação dos sólidos presentes na água, conforme exemplifica a Figura 6: Figura 6: Classificação da matéria sólida presente na água Fonte: UFSC, 2013 Os sólidos dissolvidos podem ser definidos como a fração de sólidos que encontra-se dissolvida na água, sendo que compõem-se principalmente de sais inorgânicos com menor representatividade de matéria orgânica e gases dissolvidos (UFSC, 2013). Para a determinação dos sólidos dissolvidos totais normalmente utiliza-se uma relação com a condutividade elétrica já que ambos os parâmetros são proporcionalmente relativos, ou seja, à medida que a salinidade aumenta o teor de sólidos dissolvidos também tende a aumentar (UEL, 2013). 2.4.3 Oxigênio Dissolvido (OD) O oxigênio dissolvido (OD) é fundamental para o mantimento da vida dos organismos aquáticos e em águas naturais a sua concentração varia constantemente devido a ocorrência de processos biológicos, físicos e químicos. As principais fontes de oxigênio para o meio aquático provêm da atmosfera e da fotossíntese (MACEDO, 2004). 29 Por outro lado, a oxidação da matéria orgânica resultante da atividade dos microorganismos, perdas para a atmosfera, respiração de organismos aquáticos e oxidação de íons metálicos contribuem para a redução da concentração de oxigênio dissolvido. A luminosidade também é um fator de impacto, pois se estiver restrita na coluna d’água provoca a diminuição dos índices de OD, uma vez que diminui a atividade fotossintética das algas (ESTEVES, 2011). Os níveis de oxigênio dissolvido podem ser correlacionados com a temperatura e a salinidade, visto que quanto maior a temperatura e a salinidade menor tende a ser a disponibilidade de oxigênio. Além disso, os níveis de OD tendem a ser menores durante a noite devido à cessão da atividade fotossintética e a respiração dos organismos aquáticos (MACEDO, 2004). 2.4.4 Potencial Hidrogeniônico (pH) O pH representa a concentração de íons de hidrogênio em uma solução. É considerado um parâmetro importante em estudos de campo e saneamento ambiental, pois tem influencia sobre os ecossistemas aquáticos provocando efeitos diretos e indiretos sobre o ambiente (CETESB, 2009). É um parâmetro químico que interfere na mobilidade e disponibilidade de várias substâncias, podendo potencializar a toxicidade de metais traço como chumbo, cádmio e cromo (UNIVERSIDADE DO MINHO, 2007). 2.4.5 Temperatura (°C) A temperatura afeta a toxicidade e solubilidade de outros parâmetros, como os sólidos que tendem a se dissolver mais em temperaturas mais elevadas, enquanto que os gases dissolvem-se melhor em temperaturas mais baixas. A principal fonte de aquecimento das águas é o sol, todavia incrementos de efluentes podem contribuir para a elevação da temperatura, que estando em níveis 30 extremamente elevados, limitam a disponibilidade de oxigênio e podem levar a mortalidade de organismos aquáticos (UNIVERSIDADE DO MINHO, 2007). 2.4.6 Condutividade Elétrica (CE) A condutividade elétrica expressa a capacidade do meio em transmitir corrente elétrica, devido a presença de ânions e cátions em solução. Águas com maiores concentrações de impurezas tendem a apresentar maiores índices de condutividade elétrica. A condutividade pode ser relacionada com a presença de sólidos totais dissolvidos (STD), pois quanto maior a presença destes, maior tenderá a ser a condutividade elétrica (MACEDO, 2004). 31 3 MATERIAL E MÉTODOS 3.1 CARACTERIZAÇÃO DA ÁREA DE ESTUDO A Bacia Hidrográfica do Rio Paraná III (BP3), abrange uma extensa região localizada no oeste do Paraná e sul do Mato Grosso do Sul (Figura 7). A área total da bacia compreende 8000 km², e no seu entorno situam-se 29 municípios que juntos somam cerca de 1 milhão de habitantes. Este território caracteriza-se por possuir uma grande diversidade quanto a recursos naturais, biodiversidade, abundância de água e solos de boa qualidade (ITAIPU, 2013). Figura 7 : Localização da Bacia Hidrográfica do Paraná III Fonte: ITAIPU, 2013 O solo da região classifica-se como Latossolo Vermelho, oriundos de derrames basálticos. Quanto a cobertura florestal nativa, predomina a Floresta Subtropical Estacional Semidecidual (PARIZOTTO, 2013). 32 A partir da década de 50 houve um aumento na ocupação na área, principalmente pelo fato da região possuir solo de qualidade para atividades agrícolas (ITAIPU, 2013). Atualmente o uso e ocupação do solo esta relacionado às principais atividades econômicas na Bacia do Paraná III (Figura 8), que são as culturas anuais (soja, milho e trigo), pastagens para criação de bovinos, plantéis de suínos e aves, além das agroindústrias como frigoríficos, laticínios e fecularias (SEMA, 2010; PARIZOTTO, 2013). Figura 8: Uso e ocupação do solo na Bacia do Paraná III Fonte: SEMA, 2010 O desenvolvimento destas atividades resultou em alguns impactos à região como desmatamentos, erosão, concentração de sedimentos nas águas dos rios, contaminação dos solos e das águas por agrotóxicos, acúmulo de dejetos da pecuária e suinocultura nas águas dos rios e canalizações de esgoto doméstico e industrial de maneira inadequada. Todavia com a construção da Usina Hidrelétrica 33 de Itaipu e a formação do reservatório no ano de 1982, diversas atividades voltadas para a preservação e recuperação da área foram implantadas. Portanto realizaramse estudos visando identificar os principais problemas da Bacia Hidrográfica para que posteriormente medidas mitigadoras fossem aplicadas. Dentre os problemas identificados os principais foram: assoreamento, eutrofização, invasão do mexilhão dourado, agrotóxicos e desmatamento (ITAIPU, 2013). O clima da região caracteriza-se por ser subtropical úmido e segundo a classificaçao de Köppen do tipo “Cfa”, atingido no mês mais frio temperaturas inferiores a 18 ºC e no mês mais quente média acima de 22 ºC, com verões quentes e ocorrência esporádica de geadas, tendo maior concentração pluviométrica nos meses de verão (SEAB, 2011). O estudo foi desenvolvido no reservatório da Usina Hidrelétrica de Itaipu Binacional com sede na cidade de Foz do Iguaçu (PR), na fronteira com o Brasil e Paraguai. O reservatório de Itaipu possui 1350 km² de área inundada, sendo considerado o sétimo em relação a dimensões no Brasil. Possui uma profundidade média de 22 m no corpo principal atingindo aproximadamente 170 m nas proximidades da barragem (NUNES, 2010). O desenvolvimento da pesquisa contou com o apoio da Divisão de Reservatório, a qual auxiliou no transporte até os locais das coletas das amostras e no fornecimento de informações pertinentes ao estudo. As amostras de mexilhão dourado foram processadas no laboratório de Engenharia Ambiental do Centro Universitário Dinâmica das Cataratas (Figura 9 F,G,H,I,J), e a determinação dos metais pesados realizada em espectrofotômetro de absorção atômica (modalidade chama) ocorreu na Universidade Estadual do Oeste do Paraná, campus de Marechal Cândido Rondon - PR. Quanto às amostras de sedimento e água, após a coleta, as mesmas foram encaminhadas para realização da análise de chumbo, cádmio e cromo pelo Instituto Ambiental do Paraná (IAP) de Curitiba (PR). As coletas de mexilhão dourado, sedimento e água foram realizadas em quatro pontos, conforme a Tabela 7 e Anexo I. 34 Tabela 7: Pontos de coleta de amostras de mexilhão dourado, sedimento e água Ponto Local Coordenadas UTM 01 São Miguel do Iguaçu – Braço Passo Cuê – E11 E 760432 N 7191673 02 São Miguel do Iguaçu – Braço Passo Cuê – E14 E 761611 N 7189033 03 Foz do Iguaçu – Braço do Refúgio Biológico – TRFM-01 E 746738 N 7183210 04 Foz do Iguaçu – Braço do Refúgio Biológico – TRFJ-01 E 746695 N 7183583 3.2 PROCEDIMENTOS METODOLÓGICOS 3.2.1 Amostragem, processamento e determinação dos metais pesados nas amostras de mexilhão dourado A coleta das amostras de mexilhão dourado foi realizada no mês de julho de 2013. A remoção do molusco foi feita a partir de troncos flutuantes e cordas submersas (Figura 9 A,B), da balsa da estação de coleta de água da Companhia de Saneamento do Paraná (SANEPAR). As amostras foram lavadas com água do reservatório imediatamente após a coleta para remoção parcial de resíduos de matéria orgânica e, posteriormente, foram acondicionadas em sacos plásticos identificados e alocados dentro de caixa de isopor com gelo para conservação durante o transporte. No laboratório de Engenharia Ambiental do Centro Universitário Dinâmica das Cataratas a amostra passou por homogeneização manual e em seguida, parcelas representativas e em duplicata foram utilizadas para determinação do peso e dimensão média, assim como a biomassa dos indivíduos (Figura 9 G, H, I). Após a determinação da biomassa, amostras dos tecidos moles e concha foram alocadas na estufa a 60 °C por 72 h com posterior trituração. As amostras passaram pelo processo de digestão nitro-perclórica (AOAC, 2005), (Figura 9 J), e foram acondicionadas em tubos de ensaio de vidro com tampa de plástico vedável, com posterior conservação em geladeira até o encaminhamento para determinação dos metais em estudo no espectrofotômetro de 35 absorção atômica (modalidade chama), no campus da Unioeste, na cidade de Marechal Cândido Rondon (PR), conforme metodologia de Welz e Sperling (1999). Todo o material utilizado na manipulação das amostras foi descontaminado previamente em banho de ácido clorídrico 10% (v/v) por 24 h. 3.2.2 Amostragem, processamento e determinação de metais pesados nas amostras de sedimento e água A coleta das amostras de sedimento e água foi realizada no mês de julho de 2013. O sedimento foi coletado com draga tipo Petersen (Figura 9 C) e acondicionado em sacos plásticos identificados e vedados. A água foi coletada ao longo da coluna d’água e disposta em frascos de polipropileno contento 1000 mL (Figura 9 D). Ambas as amostras foram coletadas em duplicata para cada ponto e acondicionadas em caixa térmica com gelo. Todo o procedimento de coleta, conservação e encaminhamento atendeu as normas pré-estabelecidas pelo Ambiental do Paraná (IAP) de Curitiba, no qual as amostras foram encaminhadas para a realização das análises de chumbo, cádmio e cromo. 3.2.3 Análises Físico-Químicas da Água As análises de turbidez, sólidos dissolvidos totais, pH, temperatura e condutividade elétrica foram realizadas com o auxilio da Sonda multiparâmetros da marca HORIBA modelo U-50 (Figura 9 E). A sonda passou por processo de calibração descrito pelo fabricante antes da realização das análises in loco. 36 3.2.4 Desenvolvimento da coleta e processamento das amostras A coleta iniciou-se nos pontos P1 e P2 em um braço do Reservatório próximo a cidade de São Miguel do Iguaçu – PR. Posteriormente, a coleta foi realizada nos pontos P3 e P4, localizados na cidade de Foz do Iguaçu - PR, mais precisamente no braço do Reservatório de Itaipu que pertence ao Refúgio Biológico Bela Vista. As imagens A,B,C,D,E,F,G,H,I,K e L ilustram a coleta e o tratamento das amostras. Figura 9: Desenvolvimento da coleta e processamento das amostras A B C D E F 37 G I H J A) Coleta de mexilhão dourado em troncos flutuantes no Reservatório; B) Coleta de mexilhão dourado na corda da balsa da companhia de abastecimento público de água; C) Draga de Petersen sendo preparada para lançamento visando a coleta de sedimentos; D) Acondicionamento da água coletada no recipiente adequado; E) Leitura da sonda multiparâmetros e posterior anotação dos resultados; F) Mexilhão dourado coletado no ponto P3; G) Manipulação e separação da concha dos tecidos moles do molusco; H) Conchas do bivalve; I) Tecidos moles do bivalve; J) Processo de digestão nitroperclórica. . 38 4 RESULTADOS E DISCUSSÃO 4.1 ANÁLISES FÍSICO-QUÍMICAS DA ÁGUA Quanto aos resultados dos parâmetros físico-químicos da água nos pontos no Reservatório de Itaipu obtiveram-se os seguintes valores expressos na Tabela 8. Tabela 8: Resultados dos Parâmetros Físico-químicos da água do Reservatório de Itaipu Ponto P1 São Miguel do Iguaçu Foz do Iguaçu -1 -1 -1 T (°C) pH OD (mg L ) OD (%) NTU CE (dS m ) SDT (mg L ) 18,72 6,71 6,63 72,95 2.00 0,0535 35 P2 21,92 6,44 5,95 69,70 3,85 0,0495 32 P3 21,54 7,05 7,09 82,40 4,60 0,0530 34 P4 CONAMA 357/05 21,60 7,00 7,20 83,70 3,50 0,0540 54 n/c 6a9 > 5,00 n/c < 100 n/c 500 T– Temperatura; pH – Potencial Hidrogeniônico; OD – Oxigênio Dissolvido; OD – Oxigênio Dissolvido em Porcentagem; NTU – Unidade Nefelométrica de Turbidez; CE – Condutividade Elétrica; SDT – Sólidos Dissolvidos Totais Os parâmetros físico-químicos (pH, OD, UNT e SDT) atenderam os padrões estabelecidos para águas de classe II, no qual se enquadra o Reservatório de Itaipu, segundo a Resolução nº 357 de 2005, do CONAMA. O pH manteve-se na faixa neutra, embora os pontos P1 e P2 apresentaram pH levemente mais ácido se comparado aos pontos P3 e P4. Evidenciando que o pH pode potencializar a toxicidade de metais traço como chumbo, cádmio e cromo (UNIVERSIDADE DO MINHO, 2007), alterando a solubilidade de determinados compostos na água e interferindo sobre a disponibilidade de muitas substâncias (MIEB, 2007). Afinal, considera-se que em meios mais ácidos a dessorção de metais como o cádmio pode ser facilitada (MCBRIDE, 1989 apud PIERANGELI, et al., 2005). Quanto ao oxigênio, novamente, nota-se uma breve semelhança entre os pontos P1 e P2 e os pontos P3 e P4. Estas semelhanças podem ser explicadas, devido à proximidade entre estes pontos. 39 Quanto aos SDT, o P4, apresentou superioridade aos outros pontos, sendo que este resultado pode estar relacionado com a localização deste ponto, que situa-se 100 m à jusante de um conjunto de duas linhas de tanques rede. Para os parâmetros restantes (T°C, OD% e CE) a Resolução citada não prevê limites, porém percebe-se que nenhum dos valores mostrou-se fora dos padrões. Em relação às temperaturas amenas registradas, evidencia-se o fato de a coleta ter sido realizada no mês de julho, ou seja, no inverno. Quanto a condutividade elétrica notou-se semelhança entre todos os pontos, e os valores foram baixos, o que pode indicar que o ambiente não se encontra carregado de impurezas que normalmente contribuem para a elevação da condutividade elétrica (MACEDO, 2004). Contudo os parâmetros físico-químicos obtidos neste estudo se assemelham ao de Marengoni et al., (2013), realizado em uma área aquícola do Reservatório de Itaipu, mais precisamente no município de Santa Helena, entre o período de abril/2009 e março/2010, e que obtiveram as variáveis físico-químicas, pH médio de 7,53±0,47, temperatura média de 24,40°C±3,21, condutividade elétrica de 54,09±1,18 dS m-1 e oxigênio dissolvido de 8,41±0,89 mg L-1. 4.2 BIOMETRIA DO MEXILHÃO DOURADO A biometria dos bivalves coletados mostrou que no P1 e P2 os organismos tratavam-se de jovens adultos, visto que a sua dimensão atingiu em torno de 1 cm. No ponto P2 e P3, os indivíduos coletados apresentaram dimensões superiores, situando-se por volta dos 2 cm, portanto é possível considerar que tratavam-se de organismos com dois anos de idade em média. Pois conforme afirma Mansur et al., (2012) este bivalve atinge em média 3 cm a 4 cm com um ciclo de vida de aproximadamente 3 anos, portanto a média de crescimento anual é de 1 cm/ano. A Tabela 9 apresenta os valores médios de peso, dimensão e biomassa dos bivalves. 40 Tabela 9: Peso médio, dimensão média e biomassa dos indivíduos coletados nos quatro pontos. Ponto Peso Médio (g) Dimensão Média (mm) Biomassa P1 P2 P3 P4 0,0814 ± 0,04 0,0725 ± 0,004 0,6109 ± 0,04 0,5556 ± 0,07 10,13 ± 0,02 9,59 ± 0,02 23,93 ± 0,01 22,19 ± 0,01 38% 31% 29% 23% Quanto ao peso médio dos indivíduos no P1 e P2, obteve-se média semelhante. Em contra-partida, o peso dos indivíduos obtido no P3 e P4 foi superior aos encontrados no P1 e P2. Sendo que este peso superior pode ser atribuído ao fato de que os mexilhões no P3 e P4 eram adultos mais desenvolvidos. Em relação à biomassa a faixa de intervalo entre os pontos foi relativamente pequena, abrangendo o menor índice para o P4 e o maior para o P1. Os índices de biomassa no P1 e P2 foram ligeiramente superiores ao restante dos pontos, pois estes eram jovens adultos e portando a concha do molusco ainda estava em fase de crescimento, resultado assim em uma biomassa maior. 4.3 METAIS PESADOS NO SEDIMENTO Os resultados quanto à concentração de metais pesados nas amostras de sedimento são descritos na Tabela 10, sendo que de modo geral percebeu-se que os pontos P1 e P2 apresentaram as maiores concentrações para todos os metais. Tabela 10: Resultados quanto à concentração dos metais pesados nas amostras de sedimento 1 1 1 Cd (mg Kg- ) Pb (mg Kg- ) Cr (mg Kg- ) 1,18 27,8 129,58 0,88 24,81 82,53 0,95 18,20 32,31 0,79 17,93 33,49 1,3 72 75 N.1 N.2 N.1 N.2 N.1 N.2 0,6 3,5 35 91,3 37,3 90 NOAA/2008** TEL PEL UET TEL PEL UET TEL PEL UET 0,596 3 3,53 35 91,3 127 37,3 90 95 * Resolução 344/2004: N.1 (Nível 1) – Limiar abaixo do qual são esperados efeitos adversos à biota e N.2 (Nível 2) – Limiar acima do qual são previstos prováveis efeitos adversos à biota **NOAA/2008: TEL: concentração abaixo da qual efeitos adversos são esperados; PEL: concentração na qual há probabilidade de ocorrência de efeitos adversos; UET: concentração na qual os impactos biológicos adversos sempre são esperados Ponto P1 P2 P3 P4 Resolução 420/2009 CONAMA Resolução 344/2004 CONAMA* 41 Baseando-se nas Resoluções 420/2009 e 344/2004 do CONAMA, bem como nos padrões internacionais estabelecidos pela Agência Americana de Proteção Ambiental (United States Environmental Protection Agency – USEPA), Canadá e União Européia por meio do Programa de Sedimentos de Corrente da Administração Nacional Oceanográfica e Atmosférica (National Oceanographic and Atmospheric Administration – NOAA) todos os pontos amostrados apresentaram valores inferiores aos limites máximos permitidos ou recomendados, exceto o P1 e P2 que registraram concentrações excedentes para o cromo. A resolução nº 420/2009 do CONAMA também delimita os valores máximos permitidos, todavia não subdivide em níveis de concentração como ocorre na Resolução nº 344/2004. Comparando-se os resultados com a resolução nº 420/209 observa-se que tanto para cádmio quanto para chumbo os índices mantiveram-se abaixo do limite, porém em relação ao cromo o P1 e P2 registraram valores superiores. Quanto aos limites estabelecidos pela National Oceanographic and Atmospheric Administration (NOAA), a concentração do metal cádmio situou-se entre os limites de TEL (concentração abaixo da qual os efeitos adversos são esperados) e PEL (concentração na qual há probabilidade de ocorrência de efeitos adversos). Para o chumbo, todos os pontos apresentaram índices inferiores ao TEL. Em relação ao cromo, para P3 e P4, as concentrações ficaram abaixo do limiar TEL, todavia o P1 e P2 registraram valores acima de UET (concentração na qual os impactos biológicos adversos sempre são esperados), o que indica que este local necessita de maior atenção e aplicação de estudos mais aprofundados quanto ao cromo, visto que as concentrações excedentes podem representar o risco de ações antrópicas nestes pontos. Na pesquisa de Belo et al., (2010), em que foi realizado análise de sedimento das nove praias artificiais do Reservatório de Itaipu foram encontradas concentrações de cromo abaixo do TEL em vários pontos estudados, exceto nas praias de Foz do Iguaçu, Santa Terezinha de Itaipu e Missal, onde os níveis estavam acima do TEL. Quanto ao chumbo, os autores encontraram valores inferiores ao TEL e superiores apenas para as praias de Foz do Iguaçu e de Missal, no entanto, abaixo de PEL, em relação ao cádmio as concentrações não atingiram o limite detectável do método analítico. 42 Segundo a Resolução 344/2009 do CONAMA, em relação ao cromo, P3 e P4 mantiveram-se abaixo do nível 1, o P2 manteve-se em meio termo ao nível 1 e 2, e o P1 ultrapassou o nível 2. Na pesquisa de Chambo (2011), no Reservatório de Itaipu em Santa Helena (PR) as concentrações de cromo no sedimento situaram-se entre o nível 1 e 2 para o cromo, atingindo 45,3 mg Kg-1, durante a estação de inverno, assim como ocorreu neste estudo no P2, evidenciando que Chambo (2011), observou que esta estação destacou-se com os maiores índices do metal, se comparada as outras estações do ano. Comparando-se os valores de cromo encontrados no P1 e P2 neste trabalho com o estudo de Bonai (2007), que avaliou a presença de metais pesados no Reservatório da Usina Hidrelétrica de Itá em Santa Catarina, nota-se que as concentrações são semelhantes, visto que a autora encontrou valores que variavam entre 74,63 mg kg-1 e 119,50 mg kg-1. Portanto, os resultados das análises apontam que, tanto o Reservatório de Itaipu, quanto o de Itá, podem estar refletindo as atividades ao seu entorno que, no caso dos dois reservatórios, caracteriza-se por ser a agropecuária, principalmente voltada para suínos, além da agricultura que pode estar relacionada ao uso de defensivos agrícolas contaminantes (BONAI, 2007). Além disso, essas concentrações de cromo mais elevadas no P1 e P2 podem ser atribuídas ao fato dos pontos P3 e P4 situarem-se em um braço do reservatório que pertence ao Refúgio Biológico de Itaipu e, portanto a interferência antrópica, bem como a possibilidade de descartes de contaminantes na região ser considerada praticamente nula. Enquanto que os pontos P1 e P2 situam-se próximos ao rio Passo Cuê, que é afluente do Reservatório de Itaipu, sendo que este rio localiza-se em uma micro bacia predominantemente agrícola (soja, milho, trigo e aveia), contando ainda com algumas agroindústrias como fecularias e frigoríficos (LEONARDO, 2003). É importante lembrar que o emprego de fertilizantes em áreas agrícolas é considerado uma possível fonte de contaminação por cromo (CETESB, 2009; USP, 2008). Analisando-se mais detalhadamente os resultados de cádmio com a resolução nº 344/2004 do CONAMA, observa-se que todos os pontos apresentaram concentrações situadas entre a faixa do nível 1 e 2, o que indica que apesar de não ter ultrapassado os limites nos quais provavelmente se esperam efeitos adversos à biota, as concentrações também não se mantiveram abaixo do limite no qual não se esperam efeitos, ou seja, observou-se um meio termo. 43 Entre os pontos analisados, o P1 destacou-se na concentração de cádmio, que embora tenha se situado abaixo dos limites pré-estabelecidos, mostrouse relativamente superior aos demais pontos de coleta, o que pode estar relacionado às atividades agrícolas desenvolvidas na região do ponto, pois uma das fontes de poluição por cádmio provém da utilização de fertilizantes, principalmente os fosfatados (BAIRD, 2002), além da queima proveniente dos combustíveis fósseis (CETESB, 2012). Comparando-se ao estudo de Bonai (2007), o Reservatório de Itaipu apresentou índices inferiores, visto que no Reservatório de Itá os valores registrados para o cádmio situaram-se entre 5,33 mg kg-1 e 7,87 mg kg-1. Em relação ao estudo de Chambo (2011), que também abrangeu o Reservatório de Itaipu, os valores encontrados para o cádmio foram superiores ao Nível 1 em todas as estações do ano, pois a autora encontrou médias de 2,26 mg kg-1 no outono e de 1,40 mg kg-1 no verão, não ocorrendo oscilações significativas nas demais estações do ano. A variação dos resultados obtidos neste trabalho em relação ao de Chambo (2001) pode ser resultante do ponto de coleta, pois, apesar do P3 e P4 neste estudo situarem-se próximos a tanques rede, assim como no trabalho de Chambo (2011), a quantidade de tanques em cada ponto analisado difere muito. Baseando-se na resolução nº 344/2004 do CONAMA, quanto ao chumbo, em todos os pontos as concentrações permaneceram abaixo do nível 1, ou seja, não são esperados efeitos adversos à biota. No estudo publicado por Bonai (2007), os valores também situaram-se abaixo do limite, variando entre 17 mg kg-1 e 31,58 mg kg-1. No estudo publicado por Chambó (2011), as maiores concentrações de chumbo foram registradas nas estações de inverno e outono, que inclusive superaram o nível 1, atingindo respectivamente 53 mg kg-1 e 44 mg kg-1. Apesar do estudo de Chambó (2011), ter sido realizado no mesmo reservatório os índices podem ter variado, pois nos meses de inverno do ano de 2013, as chuvas atípicas da época resultaram na cheia do reservatório que ultrapassou a cota 220, sendo que normalmente opera entre a cota 219 e 220 (ITAIPU, 2013), portanto é necessário considerar o efeito da diluição. Além dos estudos comparativos citados, outros realizados pelo Brasil, demonstram a presença de metais pesados tóxicos em sedimentos, como Alves et al., (2010) em estudo desenvolvido no córrego Monte Alegre e seus afluentes, que corresponde a um tributário do córrego Ribeirão Preto no município de Ribeirão 44 Preto (SP), encontrou médias de concentração de 462,092 mg kg-1 para chumbo, 0,303 mg kg-1 para cádmio e 403,717 mg kg-1 para cromo, sendo que foram utilizados como parâmetro de comparação a Resolução 344/2004 do CONAMA e padrões holandeses. Barreto e Bitar (2011), encontraram valores entre 2,8x10-6 e 3x10-6 mg kg1 de cádmio e 2,5x10-6 mg kg-1 a 3,36x10-5 mg kg-1 para chumbo no sedimento de corrente do córrego Aragão em Patos de Minas/MG, sendo que o autor considerou não haver contaminação pois os valores apresentaram-se inferiores aos estabelecidos pela resolução nº 420/2009 do CONAMA. 4.4 METAIS PESADOS NA ÁGUA Os resultados das concentrações de metais pesados na água são expressos na Tabela 11. Conforme as análises realizadas pelo Instituto Ambiental do Paraná (IAP) em Curitiba todas as concentrações mantiveram-se dentro dos limites permissíveis de acordo com a Resolução nº 357 de 2005 do CONAMA. Tabela 11: Resultados quanto à concentração de metais pesados na água Ponto P1 P2 P3 P4 Resolução 357/2005 CONAMA -1 Cd (mg L ) < 0,00025 < 0,00025 < 0,00025 < 0,00025 0,001 -1 Pb (mg L ) < 0,005 < 0,005 < 0,005 < 0,005 0,01 -1 Cr (mg L ) < 0,00375 < 0,00375 < 0,00375 < 0,00375 0,05 A principal questão que evolve a utilização da água como indicador para contaminação por metais pesados relaciona-se ao fato da alta capacidade de diluição deste componente dos ecossistemas aquáticos, sendo considerado, conforme Tomazelli (2003), insuficiente para se obter um panorama sobre a contaminação do ambiente quando é tratada de forma isolada, justamente pelo fato da oscilação quanto a concentração de metais traço ao longo da coluna d’água, por diversos fatores como precipitação, fluxo da água, descargas de efluentes contaminados, parâmetros físico-químicos e até mesmo as estações do ano. 45 Ressaltando que apesar da coleta ter sido realizada em julho, ou seja, na estação de inverno, que normalmente registra queda nos índices pluviométricos, o ano de 2013 foi atípico e na época da coleta o reservatório encontrava-se acima da cota 220, o que indica que os altos índices de precipitação no período podem ter contribuído para a diluição dos metais traço ao longo da coluna d’água. Todavia existem diversos trabalhos que abordam a presença de metais na água, utilizando como parâmetro de determinação a Resolução 357/2005 do Conama, um deles é o de Alves et al., (2010), que encontraram médias de concentração dos metais pesados chumbo, cádmio e cromo de 1,2x10-2 mg L-1, 3,43x10-5 mg L-1 e 4,05x10-4 mg L-1, respectivamente. Na pesquisa de Barreto e Bitar (2011), também determinaram a presença de metais em águas para consumo e verificaram valores entre 5,0x10-6 e 1,5x10-5 mg L-1 de cádmio e 1,3x10-5 a 1,19x10-4 mg L-1 de chumbo nos três pontos amostrados em estudo realizado no córrego Aragão em Patos de Minas (MG). No trabalho publicado por Chambo (2011), foi detectada a presença de cádmio apenas no verão atingindo a concentração de 1,0x10-3 mg L-1, e os níveis de cromo e chumbo foram extremamente baixos, sendo considerados praticamente nulos. Tomazelli (2003), também encontrou concentrações de cádmio e chumbo inferiores aos limites de detecção (< 8,0x10-4 mg L-1). 4.5 METAIS PESADOS NO MEXILHÃO DOURADO Os resultados obtidos quanto à concentração de metais pesados nas amostras de tecidos moles de mexilhão dourado nos quatro pontos analisados são descritos na Tabela 12. Tabela 12: Resultados das análises de metais pesados nas amostras de tecidos moles de mexilhão dourado -1 -1 -1 Ponto Cd (mg kg ) Pb (mg kg ) Cr (mg kg ) P1 <0,005 0,280 0,070 P2 <0,005 0,335 0,045 P3 <0,005 0,340 0,115 P4 <0,005 0,365 0,095 Portaria 685/1998 ANVISA 1,0 2,0 * * A resolução citada não estipula valores máximos permissíveis para o elemento cromo. 46 Quanto aos resultados das concentrações de metais pesados na concha obtiveram-se os resultados descritos na Tabela 13. Tabela 13: Resultados das análises de metais pesados nas amostras da concha do mexilhão dourado -1 -1 -1 Ponto Cd (mg kg ) Pb (mg kg ) Cr (mg kg ) P1 0,0125 0,610 0,03 P2 0,0100 0,625 0,01 P3 <0,005 0,690 0,02 P4 <0,005 0,585 0,01 Portaria 685/1998 ANVISA 1,0 2,0 * * A resolução citada não estipula valores máximos permissíveis para o elemento cromo. Conforme observa-se os resultados apontaram que em todos os pontos analisados as concentrações de metais pesados tóxicos, tanto para os tecidos moles do molusco quanto para a concha mantiveram-se abaixo dos limites préestabelecidos pela legislação Brasileira, que neste caso é delimitada pela Portaria nº 685 de 1998 da Agencia Nacional de Vigilância Sanitária (ANVISA) e que dispõe limites de contaminação para os metais pesados chumbo e cádmio em produtos de pesca. Em relação ao metal pesado cádmio tanto para os tecidos moles quanto para a concha, praticamente em todos os pontos, os resultados apontaram concentrações abaixo de 0,005 mg L-1 , todavia no P1 e P2 situados no braço do reservatório Passo Cuê na cidade de São Miguel do Iguaçu (PR). As amostras da concha do molusco registraram concentrações significativamente superiores, atingindo 0,0125 mg L-1 no P1 e 0,01 mg L-1 no P2, o que representa um aumento de 60% e 50%, respectivamente nas concentrações, se comparado aos outros pontos. No estudo publicado por Tomazelli (2003), também foram encontradas concentrações baixas de cádmio nos bivalves analisados, sendo que para o bivalve Corbicula flumínea, que assim como o Limnoperna fortunei é originário da Ásia, os valores variaram nas seis bacias hidrográficas estudadas no estado de São Paulo entre a ausência do elemento e concentrações de até 1,21 mg kg-1. Entre as causas da contaminação por cádmio, consideram-se os efluentes domésticos e as fontes atmosféricas contribuintes para quantidades significativas de cádmio no meio aquático (MASON et al., 2000 apud TOMAZELLI, 2003). Além disso, deve-se considerar as fontes difusas ou não-pontuais, como as 47 de origem da deposição atmosférica e aplicação de fertilizantes e agrotóxicos (TOMAZELLI, 2003). Dentre os metais analisados, o chumbo foi o que registrou os maiores índices de concentração no molusco, tanto para a concha como para os tecidos moles. Comparando-se as concentrações de chumbo com os outros metais, no corpo mole dos bivalves os níveis foram 85% maiores em relação ao cádmio e 75% em relação ao cromo. Para a concha, estes índices sobem para 99% em relação ao cádmio e 97% para o cromo. Quanto às concentrações de chumbo na concha, observaram-se que estas foram em média 47% superiores aos valores encontrados nos tecidos moles para o mesmo metal. Para o cádmio, observou-se que na concha as concentrações foram 38% maiores que nos tecidos moles. Em relação as concentrações de cromo, ocorreu o inverso e analisando-se todos os pontos amostrados, as quantidades do metal tóxico no corpo mole dos moluscos foi 77% superior às concentrações registradas na concha. Portanto, percebeu-se uma tendência do molusco analisado em acumular maior quantidade de cromo nos tecidos moles e de chumbo e cádmio na concha. Este resultado pode ser atribuído ao fato de que a concha é um depósito natural de metais, pois sua constituição baseada em cálcio resulta numa maior afinidade entre com os metais Cd e o Pb, devido à carga elétrica e a proximidade entre os raios atômicos destes elementos que favorecem a competição pelos mesmos sítios de ligação (BELCHEVA et al., 2006 apud CHAMBO, 2011). Em estudos com moluscos utilizados na alimentação humana normalmente as análises se concentram nos músculos, pois conforme afirma Gonçalves et al., (2007) a determinação da concentração dos metais nos tecidos dos moluscos é importante pois fornece informações relevantes quanto a capacidade de transmissão dos poluentes. Evidenciando que, em pesquisas que envolvem a análise de metais pesados em moluscos comestíveis, a utilização da concha nas análises é relativamente pequena, embora ela apresente algumas vantagens se comparada aos tecidos moles, pois a concha é capaz de integrar as concentrações ao longo da vida do organismo e uma vez que o metal é adsorvido, dificilmente será mobilizado novamente, diminuindo concentrações (BELLOTTO e MIEKELEY, 2005). assim oscilações nas 48 Quanto ao mexilhão dourado, embora ele não seja apreciado como alimento por humanos, a sua integração na cadeia alimentar de peixes é comprovada (CHAMBO, 2011). Neste estudo, diferentemente dos demais, as concentrações de metais pesados na concha e na parte mole foram abordadas separadamente, visto que a elevada disponibilidade de bivalves invasores provocou a mudança da dieta original de várias espécies de peixes que começaram a alimentar-se deles (GARCIA e MONTALTO, 2009). Todavia algumas espécies não são capazes de digerir as conchas do molusco, fato este evidenciado pela alta incidência de conchas intactas no trato digestório (OLIVEIRA et al., 2010 apud LOPES e VIEIRA, 2012), assim como ressalta Mansur et al., (2012) que observaram em alguns exemplares de cascudas das espécies R. microlepdogaster e R. strigilata, apresentavam deformidades na região anal, causadas por conchas não digeridas de mexilhão dourado. Baseando-se nestes fatos, justifica-se a análise dos tecidos moles e da concha do mexilhão dourado de maneira separada, pois somente assim seria possível obter resultados que expressassem as proporções de metais pesados em cada parte do molusco, conforme apontou o presente estudo. Diversos estudos publicados como o de García e Protogino (2005) apud Garcia e Montalto (2009), ressaltam a hipótese de bioacumulação de metais na musculatura dos peixes estaria relacionada ao consumo de bivalves exóticos contaminados. Assim como Chambo (2011) alerta, visto que em seu estudo baseado no peixe armado (Pterodoras granulosus), os níveis de chumbo, cádmio e cromo apresentaram-se superiores aos estabelecidos pela legislação vigente. Portanto, o monitoramento aquático potencializa-se com a aplicação de estudos sobre a bioacumulação em organismos como mexilhões, pois estes possuem a capacidade de acumular contaminantes em seus tecidos e concha (FERREIRA, 2011). Somando-se as concentrações de metais pesados encontradas na concha e nos tecidos moles do mexilhão dourado, conforme descreve a Tabela 14, observou-se que o chumbo permaneceu representando a maior concentração, seguido pelo cromo e cádmio. Nota-se que dos pontos analisados, o P3 apresentou a maior concentração de chumbo com 1,03 mg kg-1 e de cromo com 0,135 mg kg-1. Em relação ao cádmio o ponto que apresentou uma ligeira superioridade quanto à concentração foi o P1 atingindo 0,0175 mg kg-1. 49 Tabela 14: Somatória das concentrações de metais pesados na concha e nos tecidos moles de mexilhão dourado Ponto P1 P2 P3 P4 Portaria 685/1998 ANVISA -1 Cd (mg kg ) 0,017 0,015 0,010 0,010 1,0 -1 Pb (mg kg ) 0,890 0,960 1,030 0,950 2,0 -1 Cr (mg kg ) 0,100 0,055 0,135 0,105 * Os valores das concentrações presentes na concha e nos tecidos dos bivalves, quando somados também não ultrapassaram os limites máximos permissíveis delimitados pela legislação pertinente para produtos de pesca, todavia é necessário ponderar, pois houve acumulação, e o fato do molusco estar presente na dieta de algumas espécies de peixes conforme afirma Garcia e Montalto (2009), pode representar uma transferência desses metais pesados tóxicos ao longo da cadeia alimentar. No trabalho de Agustini e Mucelin (2009), em análise realizada com mexilhão dourado quanto a presença de metais pesados cádmio e chumbo no reservatório de Itaipu, mais precisamente no município de São Miguel do Iguaçu, obtiveram 63 mg kg-1 para o chumbo e 9 mg kg-1 para o cádmio. Sendo que os autores atribuíram as elevadas concentrações ao manejo agropecuário inadequado, utilização abusiva de agrotóxicos, além do despejo de efluentes urbanos, industriais e agropecuários, principalmente de suinoculturas nos rios que deságuam no Reservatório de Itaipu. Em outra pesquisa, Marengoni et al. (2013), encontrou valores de concentrações de chumbo com média de 35,25 e 32,58 mg kg -1 para os dois pontos avaliados no reservatório da Usina Hidrelétrica de Itaipu, no município de Santa Helena – PR. Todavia cabe ressaltar que os pontos analisados na pesquisa do autor encontravam-se próximos a um grande cultivo de peixes em tanques redes, locais esses que recebem rações e produtos industrializados. Diversos outros trabalhos abordam a questão da bioacumulação em moluscos, como por exemplo, Maia et al., (2006) que, analisando mexilhões da espécie Perna perna em praias da região metropolitana do Rio de Janeiro, obteve valores de chumbo de 2,0 ± 0,93 mg kg-1. Carvalho et al., (2001) que também utilizaram o mexilhão Perna perna para estudar a contaminação por metais pesados na Ilha de Santana encontraram concentrações de 1,80 mg kg-1 para cádmio, 1,25 50 mg kg-1 para cromo e 0,38 mg kg-1 para chumbo. Assim como Bellotto et al., (2005) em Itajaí (SC) estudando mexilhões Perna perna, que foram transplantados para uma área próxima a uma indústria de beneficiamento de aço, obteve médias entre 0,84 e 1,15 mg kg-1 para cromo e 1,17 a 1,33 mg kg-1 para cádmio. Emerenciano et al., (2009), em análises realizadas com o molusco Anomalocardia brasiliana proveniente do estuário Potengi/Jundiaí no Rio Grande do Norte, encontrou concentrações de 4,9 mg kg-1 de chumbo, 0,2 mg kg-1 de cádmio e 3 mg kg-1 de cromo. Em estudo realizado por Marengoni et al., (2013), no Reservatório de Itaipu em uma área aquícola, abordando dois pontos, sendo um deles no tanquerede e o outro localizado a 100 m, entre abril de 2009 e março de 2010, observou-se concentrações médias de dos metais chumbo, cádmio e cromo de 35,25 mg kg-1, 3,33 mg kg-1e 4,08 mg kg-1, respectivamente no ponto localizado no tanque-rede. Enquanto que no ponto a 100m encontrou-se médias de 32,58 mg kg-1, 3,08 mg kg-1 e 4,83 mg kg-1, respectivamente. O autor também evidencia o fato de terem ocorrido oscilações quanto à concentração dos metais pesados tóxicos cádmio e chumbo no bivalve entre as estações do ano, visto que no outono e inverno não foi detectado o metal pesado cádmio, e na primavera e verão os valores ultrapassaram os limites descritos na legislação atingindo 6,50±0,55 mg kg-1 e 6,33±0,52 mg kg-1 respectivamente. Isto também ocorreu com o chumbo, pois na primavera e verão as concentrações foram de 51,83±2,93 e 50,16±4,12 respectivamente, enquanto que no outono e inverno as concentrações foram de 17,83±3,66 mg kg-1 e 15,83±2,56 mg kg-1. Quanto ao cromo não foram detectadas variações sazonais e as concentrações situaram-se próximas a faixa de 5 mg kg-1. Estas oscilações foram atribuídas por Marengoni et al., (2013), devido a menor capacidade de drenagem antes da primavera, caracterizada pelos baixos índices pluviométricos durante estas estações do ano e um provável incremento das fontes poluidoras e dos efeitos dos efluentes impactantes deslocados após o período de maior concentração das chuvas. Silva et al., (2010) durante a avaliação de concentração de metais pesados no bivalve Mytella falcata em um estuário do Rio Timbó em Pernambuco, não detectaram a presença de cádmio e cromo em seu estudo. Outro fator relevante observado neste estudo foi que os níveis de acumulação foram relativamente superiores para o cádmio nos mexilhões do P1 e 51 P2 que eram mais jovens e apresentavam proporções relativamente maiores quanto a biomassa, e para o chumbo e cromo nos indivíduos coletados nos pontos P3 e P4, que eram mais desenvolvidos. Estas pequenas diferenças também foram notadas por Tomazelli (2003), pois algumas espécies de bivalves utilizados em seu estudo apresentaram correlações inversas entre o peso do tecido e os teores dos metais, enquanto outras apresentaram correlações diretas, e tais correlações foram, ainda, variáveis para os diferentes elementos. No estudo de Nogarol et al.,(2009) analisando a bioacumulação de metais pesados no bivalve límnico Diplodon expansus, detectaram a presença de cádmio e chumbo na massa visceral da maioria dos organismos analisados e notaram que o órgão com maior potencial acumulativo nos moluscos são as glândulas digestivas. Além disso, os autores perceberam que houve uma relação inversa quanto a presença de metais e o tamanho dos organismos, sendo este fator atribuído as possíveis taxas metabólicas que tendem a ser maiores na fase juvenil resultando na potencialização da assimilação dos metais. Todavia, ressalta-se que as concentrações quanto a metais pesados nos organismos aquáticos variam de acordo com a espécie, tamanho e também com os sítios propícios ou não de ligação (ZHOU et al., 2008 apud NOGAROL et al.,2009). Portanto, considera-se interessante o biomonitoramento por meio de moluscos bivalves, pois estes organismos apresentam diversas características propícias, como o seu hábito séssil, tempo de vida abrangente, permitindo estudos em longo prazo, ampla distribuição geográfica, convívio em altas densidades e simplicidade na coleta (CUNNINGHAM, 1979 apud GALVÃO et al., 2009). Além disso, segundo Tomazelli (2003) estes organismos podem ser utilizados com sucesso no biomonitoramento, visto que refletem as concentrações disponíveis no ambiente e caracterizam como as comunidades bióticas estão reagindo aos contaminantes presentes no ambiente (MUCELIN e SANTOS, 2007). 4.6 CORRELAÇÕES DOS RESULTADOS ENTRE AS AMOSTRAS Analisando-se os resultados de maneira correlacionada, observou-se que em todos os locais as concentrações de metais pesados entre as amostras de 52 mexilhão dourado, assim como sedimento e água comportaram-se similarmente, sendo por meio das Figuras 10, 11, 12 e 13 é possível visualizar as curvas de concentração entre as amostras. Figura 10: Correlação das concentrações de metais pesados no P1 Figura 11: Correlação das concentrações de metais pesados no P2 Figura 12: Correlação das concentrações de metais pesados no P3 Figura 13: Correlação das concentrações de metais pesados no P4 Para todos os metais analisados as maiores concentrações foram registradas no sedimento, seguido pelo mexilhão dourado e as menores na água, isto pode ser atribuído ao fato de que na água ocorre facilmente a diluição dos contaminantes, enquanto que os sedimentos tendem a acumular os poluentes. 53 Outro fator relevante é que quanto aos sedimentos, em todos os pontos os níveis de cromo foram superiores aos de chumbo e cádmio. No trabalho publicado por Chambo (2011), que avaliou as concentrações de metais pesados no mexilhão dourado, sedimento, água e peixes, levando-se em conta variações sazonais, as concentrações de cromo foram registradas em maiores proporções no sedimento durante o inverno, a primavera e o verão, sendo que os menores índices de cromo foram registrados na água nestas estações. O principal elemento acumulado pelo molusco foi o chumbo em detrimento dos sedimentos que acumularam maiores proporções de cromo, todavia, ainda assim as concentrações de chumbo no sedimento superaram as registradas nos bivalves. Assim como ocorreu no estudo de Chambo (2011), onde os índices de chumbo registrados no mexilhão dourado foram inferiores aos detectados no sedimento durante o inverno, porém na primavera e verão o processo foi inverso. Diferentemente do presente estudo e o de Chambo (2011), na pesquisa de Belluta et al., (2008), desenvolvida no córrego do Cinta em Botucatu (SP), os autores registraram valores superiores de Cádmio (0,01mg L-1) e chumbo (0,03 mg L-1) na água e valores inferiores no sedimento 1,09 mg L-1 e 16,4 mg L-1, respectivamente para estes metais. Estas diferenças sugerem que a transferência dos metais pesados do sedimento para os organismos vivos dependem de inúmeros fatores ambientais e fisiológicos (PHILLIPS e RAINBOW, 1994). Assim como Birch et al., (2001), afirmam que os contaminantes presentes nos sedimentos podem ser biodisponibilizados aos organismos, dependendo das condições físico-químicas e biológicas do local. Tanto é que no estudo publicado por Tomazelli (2003), houveram tanto correlações positivas quanto negativas entre a concentração dos metais chumbo e cádmio nos sedimentos e nas espécies de bivalves analisadas, sendo que dentre os bivalves utilizados na sua pesquisa a Corbicula flumínea, que assim como o mexilhão é uma espécie exótica, apresentou correlação positiva, todavia há de se ponderar que este bivalve possui hábito bentônico inclusive na fase adulta, ou seja, vive em contato direto com o sedimento, diferentemente do Limnoperna fortunei que no estágio adulto possui hábito epifaunal e comportamento gregário fixando-se em substratos rígidos por meio do bisso (RUPPERT, 2005). Contudo considera-se que a concentração de metais pesados em bivalves dependa principalmente dos contaminantes presentes na água e no 54 sedimento, devendo se levar em conta as estações do ano e as características físico-químicas (PEREIRA, 2002). Sendo assim, recomenda-se que a avaliação das condições de poluição do ambiente seja composta, portanto, por indicadores bióticos quanto abióticos coletados em uma mesma área e durante todas as estações do ano (ADENIYI et al., 2008 apud CHAMBO, 2011). 55 5 CONSIDERAÇÕES FINAIS Com a realização deste estudo detectou-se a presença dos metais pesados chumbo, cádmio e cromo em todas as amostras e em todos os pontos de coleta, embora os valores em sua maioria estejam de acordos com as normas e legislações vigentes. Quanto ao sedimento, os pontos P1 e P2 necessitam de atenção especial e estudos mais aprofundados, pois as concentrações de cromo no P1 excederam os limites permissíveis registrando 129,58 mg kg-1 e no P2, que ultrapassou os limites estabelecidos pela Resolução 420/2009 do CONAMA, registrando 82,53 mg kg-1. Em relação à água, as concentrações foram baixas, todavia é necessário ponderar o efeito da diluição, que é considerado um fator negativo para o monitoramento ambiental. No mexilhão dourado as maiores concentrações foram de chumbo atingindo 0,365 mg kg-1 nos tecidos moles do P3 e 0,69 mg kg-1 nas conchas do P4. Portanto, notou-se que o chumbo perfez a maior proporção de concentração se comparado aos outros metais traço analisados no mexilhão dourado, enquanto que para o sedimento o metal que apresentou a maior representatividade foi o cromo. Quanto ao mexilhão, percebeu-se também uma tendência de maior acumulação de chumbo e cádmio na concha e de cromo nos tecidos moles, o que representa um resultado diferencial, visto que, normalmente em estudos do mesmo ramo não é de costume analisar estes elementos do molusco isoladamente, desconsiderando-se o fato de que algumas espécies de peixes não são capazes de digerir a concha do molusco. Por fim, ressalta-se a hipótese de transferência ao longo da cadeia alimentar dos contaminantes presentes no mexilhão dourado, que embora neste estudo tenham sido modestos, visualiza-se que em outras pesquisas isto nem sempre se repete, portanto, sugere-se para estudos futuros, análises de mexilhão dourado, sedimento e água em diversos pontos do Reservatório de Itaipu, abrangendo a sazonalidade ambiental, bem como a análise conjunta com espécies de peixes que consomem ativamente o mexilhão dourado e que possuem 56 representatividade comercial, com vistas a assegurar baseamento científico quanto aos possíveis riscos que os consumidores finais do pescado estão susceptíveis. 57 REFERÊNCIAS BIBLIOGRÁFICAS ANIRUDHAN, T. S.; RADHAKRISHNAN, P. G. Chromium (III) removal from water and wastewater using a carboxylate-functionalized cation exchanger prepared from a lignocellulosic residue. Journal of Colloid and Interface Science, v. 316, n. 2, p. 268-276, dez. 2007. AGUSTINI. M. A. B.; MUCELIN. C. A. Mexilhões dourado como bioindicadores da qualidade hídrica do reservatório do lago de Itaipu - PR, 2009. Disponível em: < http://cacphp.unioeste.br/eventos/senama/anais/PDF/ARTIGOS/40_1269270557_ARTIGO.pd f. > Acesso em 15 jan. 2013. ALVES. D.T.V; MIRANDA,R.G.; OLIVEIRA. G.R.F.; PEREIRA, S.F.P. Avaliação da bioacumulação de metais em tecido de peixes apanhados no reservatório da hidrelétrica de Tucuruí-PA. In: 32ª Reunião Anual da Sociedade Brasileira de Quimica. Anais... Fortaleza: Sociedade Brasileira de Quimica, 2009. ALVES, R. I. S.; TONANI, K. A. A.; NIKAIDO, M.; CARDOSO, O. O.; TREVILATO, T. M. B.; SEGURAMUÑOZ, S. I. Avaliação das concentrações de metais pesados em águas superficiais e sedimentos do Córrego Monte Alegre e afluentes, Ribeirão Preto, SP, Brasil. Ambi-Agua, Taubaté, v. 5, n. 3, p. 122-132, 2010. ANDRADE, S.F.; MATOS, T.B.; CARVALHO, C.E.V. Variação sazonal de metais pesados em siris Callinectes ornatus (Ordway, 1863) da lagoa de Iquiparí, Brasil. Revista Virtual de Química. v.3, n.2, p.129-137, 2011. Disponível em: http://www.uff.br/RVQ/index.php/rvq/search/results. Acesso em: 20 jan. 2013. AGENCY FOR TOXIC SUBSTANCES AND DISEASE REGISTRY (ATSDR). Cromo. Disponível em: < http://www.atsdr.cdc.gov/substances/toxsubstance.asp?toxid=17 > Acesso em 14 de maio de 2013. ASSOCIATION OF OFFICIAL ANALYTICAL CHEMISTS (AOAC). Official methods of analysis. 18 ed. Gaithersburg: AOAC, 2005. 3000 p. BAIRD, C. Química Ambiental. 2ª ed. Porto Alegre: Bookman, 2002. 622p. BARRETO, A.C.; BITAR, N.A.B.; Análise de metais pesados na água e nos sedimentos de corrente do córrego Aragão situado no município de Patos de Minas/MG. Revista Perquirere, Patos de Minas, v. 8, n. 2, p. 214-223, dez. 2011. BELO, A.; QUINÁIA, S.P.; PLETSCH, A.L. Avaliação da Contaminação de Metais Pesados em Sedimentos Superficiais das Praias do Lago de Itaipu. Química Nova, vol. 33, n. 3, p. 613-617, 2010. BELÓ A. Diagnóstico da Concentração de Metais em Sedimentos. 73 f. Trabalho de Conclusão de Curso, Universidade Estadual do Centro-Oeste - UNICENTRO, Guarapuava, 2008. 58 BELLOTTO, V.R.; DE BRITO, P.C.; MANZONI, G. et al. Biomonitoramento ativo de metais traço e efeito biológico em mexilhões transplantados para área de influência de efluente de indústria de beneficiamento de aço - fase I. Brazilian Journal of quatic Sciences, v.9, n.2, p.33-37, 2005. BELLOTTO VR, MIEKELY N.Trace metals in mussel shells and corresponding soft tissue samples:a validation experiment for the use of Perna perna shells in pollution monitoring. Analytical and Bioanalytical Chemistry, 389, 769-776. 2007. BELLUTA, I.; TOFOLI, L.A.; CORRÊA, L.C. et al. Impactos provocados por metais potencialmente tóxicos dissolvidos em água e em sedimentos no córrego do CintraBotucatu - SP. Salusvita, v.27, n.2, p.239-258, 2008. BIRCH, G.F.; TAYLOR, S.E.; MATTHAI, C. Small-scale spatial and temporal variance in the concentration of heavy metals in aquatic sediments: a review and some new concepts. Environmental Pollution, v.113, p.357-372, 2001. BONAI, N.C. Distribuição de Metais Pesados nos Sedimentos do Reservatório da Usina Hifrelétrica de Itá e Avaliação da Eficiência de Eichhornia crassipes na Remediação de Águas Contaminadas pela Atividade Agrícola de Criação de Suínos. 2007. 64f. Dissertação (Mestrado em Ciências Ambientais). Universidade Comunitária Regional de Chapecó, Chapecó, 2007. BRASIL. Resolução n°357, de 17 de março de 2005. Publicada no Diário Oficial da União. nº 053, p.58-63. 18 mar. 2005. _______ Resolução n°430, de 13 de maio de 2011. Publicada no Diário Oficial da União. 2011. _______ Lei nº 6938 de 31 de agosto de 1981. Política Nacional de Meio Ambiente. Publicada no Diário Oficial da União. 2 set. 1981. _______ Portaria n°685/98. Publicado no Diário Oficial da União. 27 ago. 1998. _______ Resolução n°344, de 25 de março de 2004. Publicada no Diário Oficial da União. 2004. _______ Resolução n°420, de 28 de dezembro de 2009. Publicada no Diário Oficial da União. 2009. BUCHMAN, M. F. NOAA Screening Quick Reference Tables, NOAA OR&R Report 08-1, Seattle WA, Office of Response and Restoriation Division, National Oceanic and Atmospheric Administration, 34 pages, 2008. CAMPOS, M.L.; SILVA, F.N.; FURTINI NETO, A.E.; GUILHERME, L.R.G.; MARQUES, J.J.; ANTUNES, A.S. Determinação de cádmio, cobre, cromo, níquel, chumbo e zinco em fosfatos de rocha. Pesq. agropec. bras. Brasília, v. 40, n. 4, p. 361-367, abr. 2005 59 CAVALCANTE, A.L.M. Parâmetros sanguíneos de tilápia (Oreochromis niloticus) no monitoramento ambiental do chumbo. 2009.70f. Dissertação (Mestrado em Ciências na área de Saúde Pública) - Escola Nacional de Saúde Pública Sergio Arouca, Rio de Janeiro, RJ. CHAMBO, A.P.S. Bioindicadores para determinação de metais pesados no reservatório da Itaipu Binacional, Paraná, Brasil. 2011, 98f. Dissertação (Mestrado em Zootecnia). Universidade Estadual do Oeste do Paraná, Marechal Candido Rondon, 2011. COLOMBO, J.C. Análise de contaminantes ambientais. Universidade Tecnológica Federal do Paraná. Departamento de Química e Biologia. Disponível em: < http://pessoal.utfpr.edu.br/colombo/arquivos/Turbidez2.pdf > Acesso em 15 de jun. 2013. COMPANHIA DE TECNOLOGIA DE SANEAMENTO AMBIENTAL (CETESB). Água. Relatório de qualidade das águas interiores do Estado de São Paulo. 2006. Disponível em: <http://www.cetesb.sp.gov.br/Agua/relatorios/rios/rel_aguas_int_ 2005/rel_aguas_int_2005.zip>. Acesso: 15 de jun. 2013. _______Significado Ambiental e Sanitário das Variáveis de Qualidade das Águas e dos Sedimentos e Metodologias Analíticas e de Amostragem. Série de Relatórios: Qualidade das águas Interiores no Estado de São Paulo. Apêndice “A”. 2009. _______Chumbo e seus compostos. Ficha de Informação Toxicológica. Divisão de Toxicologia, Genotoxicidade e Microbiologia Ambiental. Jan. 2012. COMPANHIA ENERGÉTICA DE MINAS GERAIS (CEMIG). O mexilhão dourado: uma ameaça às águas e hidrelétricas brasileiras. Fundação Centro Tecnológico de Minas Gerais (CETEC), Belo Horizonte, 2009. COTTA, J. A. O. Diagnóstico ambiental do solo e sedimento do Parque Estadual Turístico do Alto Ribeira (PETAR). 2003. Dissertação (Mestrado em Química Analítica) - Instituto de Química de São Carlos, Universidade de São Paulo, São Carlos, 2004. Disponível em: <http://www.teses.usp.br/teses/disponiveis/75/75132/tde-17082004-110811/>. Acesso em: 29 de abril, 2013. DEBERDT, A.J. Qualidade da água. Disponível em: < http://educar.sc.usp.br/biologia/prociencias/qagua.htm > Acesso em 17 maio de 2013. DRAGO, E.I.; MONTALTO, L.; OLIVEROS, O.B. 2009. Desenvolvimento e ecologia larval do Limnoperna fortunei. Pp. 77-87. En: Darrigran G. & C. Damborenea (Eds.) Introdução a Biologia das Invasões. O Mexilhão Dourado na América do Sul: biologia, dispersão, impacto, prevenção e controle. Cubo Editora. São Carlos – SP. 246 pp. 60 DUFFUS, J. H. “Heavy metals” – a meaningless term? Pure and Applied Chemistry. IUPAC - Tecnhical Report, v. 74, n. 5, p. 793-807, 2002. EMERENCIANO, D.P.; SILVA, H.F.O.;CARVALHO, G.C.;CRUZ, A.M.F.; MOURA, M.F.V. Análise da ocorrência de metais: bário, cádmio, chumbo, cobre, cromo, estanho, níquel e zinco, em mexilhão (Anomalocardia brasiliana) coletados no Estuário Potengi/Jundiaí – RN. Revista PublICa, Rio Grande do Norte, v. 4, p. 1-9, 2008. ESTEVES, F.A. Fundamentos de Limnologia. 3ª ed. Rio de Janeiro: Interciência, 2011. 790p. FACULDADE DE CIÊNCIA E TECNOLOGIA. UNIVERSIDADE NOVA DE LISBOA (FCT). Espectroscopia de Absorção Atómica de Chama. Disponível em: < http://www.dq.fct.unl.pt/servicos-externos/espectroscopia-de-absorcao-atomica-dechama > Acesso em 10 de maio 2013 FERREIRA, M.S. Contaminação Mercurial em Pescado Marinho do Brasil. 2011. 91f. Dissertação (Doutorado em Higiene Veterinária e Processamento Tecnológico de Produtos de Origem Animal). Universidade Federal Fluminense, Niterói, 2011. FIORILLO, C. A. P. Curso de Direito Ambiental Brasileiro. São Paulo. Editora Saraiva, 6º edição, 2005. p.173 a 222. GALVÃO, P.M.A.; REBELO, M.F.; GUIMARÃES, J.R.D.; TORRES, J.P.M.; MALM, O. Bioacumulação de Metais em Moluscos Bivalves: Aspectos evolutivos e ecológicos a serem considerados para a biomonitoração de ambientes marinhos. Braz. J. Aquat. Sci. Technol. v.13, n.2, p. 50-69, 2009. GARCIA, M.; MONTALTO, L. 2009. Os peixes predadores do Limnoperna fortunei nos ambientes colonizados. Pp. 111-126. En: Darrigran G. & C. Damborenea (Eds.) Introdução a Biologia das Invasões. O Mexilhão Dourado na América do Sul: biologia, dispersão, impacto, prevenção e controle. Cubo Editora. São Carlos – SP. 246 pp. GOMES, M.R.; ROGERO, M.M.; TIRAPEGUI, J. Considerações sobre cromo, insulina e exercício físico. Revista Bras Med Esporte, vol. 11, n. 5, p. 262-266, 2005. GOMES, M.V.T e SATO, Y. Avaliação da contaminação por metais pesados em peixes no rio São Francisco à jusante da represa de Três Marias, Minas Gerais, Brasil. Saúde e Ambiente. Duque de Caxias, v. 6, n. 1, p. 24-30, jan./jun. 2011 GONÇALVES Jr, A. C., LUCHESE, E. B., LENZI, E. Avaliação da fitodisponibilidade de cádmio, chumbo e cromo, em soja cultivada em Latossolo Vermelho Escuro tratado com fertilizantes comerciais. Química Nova, São Paulo, v. 23, n. 2, p. 173177, 2000. GONÇALVES, R.S.L.; FREIRE, J.S.S.; NETO, V.A.N. Determinação das Concentrações de Cádmio, Cobre, Cromo e Zinco na Ostra Crassostrea rhizophorae 61 dos Estuários dos Rios Cocó e Ceará. Revista de Geologia, vol.20, n.1, p.57-63, 2007. GOULART, M.D.C. & CALLISTO, M. 2003. Bioindicadores de qualidade de água como ferramenta em estudos de impacto ambiental. FAPAM. Pará de Minas, v. 2, n 1, nov. 2010. IRYODA, K.I. Estudo da Influência da Caolinita na Remediação Eletrocinética em Solo Contaminado com Chumbo. 2008. 80f. Dissertação (Mestrado em Engenharia de Materiais e Processos). Universidade Federal do Paraná, Curitiba, 2008. ITAIPU. Cheia dos rios Iguaçu e Paraná provoca espetáculo e alerta. Disponível em: < http://www.itaipu.gov.br/sala-de-imprensa/noticia/cheia-dos-rios-iguacu-eparana-provoca-espetaculo-e-alerta > Acesso em 5 de novembro de 2013. ITAIPU BINACIONAL. Cultivando Água Boa. Cenário Local – A Bacia do Paraná 3. Disponível em: < http://www.cultivandoaguaboa.com.br/o-programa/cenariolocal-a-bacia-do-parana-3 > Acesso em 14 de maio de 2013. JESUS, H.C.; COSTA, E.A.; MENDONÇA, A.S.F.; ZANDONADE, E. Distribuição de metais pesados em sedimentos do sistema estuarino da Ilha de Vitória – ES. Revista Química Nova, vol. 27, n. 3, p. 378-386, 2004. LARCHER, W.; Ecofisiologia Vegetal, RiMa Artes e Textos: São Carlos, 2000. LEONARDO, H.C.L. Indicadores de Qualidade de Solo e Água para Avaliação do uso Sustentável da Microbacia Hidrográfica do Rio Passo Cuê, Região Oeste do Estado do Paraná. 2003. 121f. Dissertação (Mestrado em Recursos Florestais). Escola Superior de Agricultura “Luiz de Queiroz”. Piracicaba, 2003. LOPES, M.; VIEIRA, J. Predadores Potenciais para o Controle do Mexilhão dourado. 2012. p. 357-363. En: Mansur et al., (2012). (Eds). Moluscos Líminicos Invasores no Brasil: biologia, prevenção e controle. Redes Editora. Porto Alegre – RS. p.411 MACEDO, J.A.B. Águas e águas. Belo Horizonte: CRQ-MG, 2004. 977p. 2004. MAIA, C.B.; ALMEIDA, A.C.M.; MOREIRA, F.R. Avaliação do teor de chumbo em mexilhões da espécie Perna perna na região metropolitana da cidade do Rio de Janeiro. Revista da Sociedade Brasileira de Ecotoxicologia. v.1, n.2, p. 195-198. fev. 2006. MALAVOLTA, E.; MORAES, M.F.; LAVRES JR., J.; MALAVOLTA, M. Micronutrientes e metais pesados - essencialidade e toxidez. Cap.4, p.117-154. In: PATERNIANI, E. (Ed.). Ciência, agricultura e sociedade. Brasília: Embrapa Informação Tecnológica, 2006. 403p. MANSUR, M. C. D. et al. Moluscos Límnicos Invasores no Brasil: biologia, prevenção e controle. Porto Alegre. Redes Editora, 2012. p. 19-30. 62 MARENGONI, N.G.; KLOSOWSKI, E.S.; OLIVEIRA, K.P.; CHAMBO, A.P.S. GONÇALVES, A.C.J. Bioacumulação de metais pesados e nutrientes no mexilhão dourado do reservatório da Usina Hidrelétrica de Itaipu Binacional. Química Nova. v.XY, n.0, p.1-5. Jan. 2013. MARTINI, L.C.P. & LANNA, A.E. Medidas Compensatórias Aplicáveis à Questão da Poluição Hídrica de Origem Agrícola. Revista Brasileira de Recursos Hídricos. V. 8, n. 1, p. 111-136, jan./mar. 2003. MERÇON, F. LIMA, V.F.Metais Pesados no Ensino da Química. Química Nova na Escola, vol. 33, n. 4, Nov.2011. MIRANDA FILHO, A. L.; MOTA, A. K. M.; CRUZ, C. C.; MATIAS, C. A. R; FERREIRA, A. P. Cromo hexavalente em peixes oriundos da Baía de Sepetiba no Rio de Janeiro, Brasil: uma avaliação de risco à saúde humana. Revista AmbiÁgua, Taubaté, v. 6, n. 3, p. 200-209, 2011. MUCELIN, C. A.; SANTOS, C. Estudos Ecológicos: O Grupo de Pesquisa em Ecossistemas Aquáticos e Comunidade Zoobentônica. In: Anais... IV Encontro Nacional de Difusão e Tecnologia (ENDITEC), Medianeira PR, 2007. NOGAROL, L. R. ; BROSSI-GARCIA, A. L. ; MENEGÁRIO, A.A. ; GOVONE, J.S. . Bioacumulação de metais pesados no bivalve limnico Diplodon expansus (Kuster, 1856). In: XXI Congresso de Iniciação Científica da Unesp, 2009, São José do Rio Preto. Resumos em CD, 2009. NUNES, E.G. Avaliação do Comportamento do Mexilhão Dourado (Limnoperna Fortunei) em Telas de Tanques Rede no Reservatório de Itaipu. Foz do Iguaçu, 2010. 22f. Trabalho de conclusão de curso (Graduação em Engenharia Ambiental), União Dinâmica de Faculdades Cataratas, 2010. OLIVEIRA, J.A.;CAMBRAIA, J.; CANO, M.A.O.; JORDÃO, C.P. Absorção e acúmulo de cádmio e seus efeitos sobre o crescimento relativo de plantas de aguapé e de salvínia. Revista Brasileira de Fisiologia Vegetal. v. 13, n. 3, p. 329-341, 2001. PAOLIELLO, M.M.B.; CHASIN, A.A.M. Ecotoxicologia do chumbo e seus compostos. Centro de Recursos Ambientais (CRA). Série de Cadernos de Referência Ambiental, v. 3. Salvador, 2001. PARIZOTTO, A.A. Bacia do Paraná 3. Secretária de Estado do Meio Ambiente e Recursos Hídricos. Disponível em: < http://www2.itaipu.gov.br/aguaboa/encontroTrinacional/documentos/Bacia%20Hidrog r%C3%A1fica%20do%20Paran%C3%A1%20III.pdf > Acesso em 14 de maio de 2013. PERDONA, C.R. Espectroscopia de Absorção Atômica por Chama. ServiçoNacional de Aprendizagem Industrial de Santa Catarina (SENAI). 2008. Disponível em: < http://www.youtube.com/watch?v=C-i7BDqWkvo > Acesso em 12 de maio de 2013. 63 PEREIRA, O. Determinação dos teores de Hg, Pb, Cd, Cu e Zn em Moluscos (Crassostrea brasiliana, Perna perna e Mytella falcata). Revista do Instituto Adolfo Lutz, v. 61, n. 1, p. 9-25, 2002. PEREIRA, R.S. Identificação e caracterização das fontes de poluição em sistemas hídricos. Revista Eletrônica de Recursos Hídricos. Instituto de Pesquisas Hidráulicas - UFRGS. Rio Grande do Sul, v. 1, n. 1, p. 20-36. 2004. PEREIRA, C.D.; QUINÁIA, S.P. Estudo do coeficiente de distribuição do Cr em águas naturais. Revista do Setor de Ciências Agrárias e Ambientais. Guarapuava, v. 3, n. 1, p. 27-37. Jan./Abr. 2007. PIERANGELI, M.A.P; GUILHERME, L.R.G.; CURI, N.; SILVA, M.L.N.; LIMA, J.M.; COSTA, E.T.S. Efeito do ph na absorção e dessorçao de cádmio em latossolos brasileiros. Revista Bras. Ci. Solo, n. 29, p. 523-532, 2005. PIRES, K.S.; SILVA, J. Determinação de Metais no Sedimento da Foz do Rio Ocoy - Tributário do Lago de Itaipu. Medianeira, 2011. 57f. Trabalho de conclusão de curso (Tecnólogo em Tecnologia e Gestão Ambiental) - Curso Superior de Tecnologia em Gestão Ambiental. Universidade Tecnológica Federal do Paraná – Campus Medianeira. 2011. PHILLIPS, D.J.H.; RAINBOW, P.S. Biomonitoring of trace aquatic contaminants. London: Chapman & Hall, 1994. 371p. Disponível em: < http://books.google.com.br/books?id=Ii6HYfJuaG0C&printsec=frontcover&hl=ptBR&source=gbs_ge_summary_r&cad=0#v=onepage&q&f=false > Acesso em 6 de novembro de 2013. RUPPERT, E. E. ; FOX, R.S. ; BARNES, R. D. Zoologia dos Invertebrados: uma abordagem funcional-evolutiva. São Paulo. Editora Roca, 2005. p. 426-469. SECRETARIA DA AGRICULTURA E DO ABASTECIMENTO (SEAB). Departamento de Economia Rural. Análise da Conjuntura Agropecuária Safra 2010/2011. Agrometeorologia. Setembro, 2010. Disponível em: < http://www.agricultura.pr.gov.br/arquivos/File/deral/Prognosticos/agrometeorologia_2 010_11.pdf > Acesso em 15 de maio 2013. SECRETARIA DE ESTADO DO MEIO AMBIENTE E RECURSOS HIDRÍCOS (SEMA). Bacias Hidrográficas do Paraná – Série Histórica. Curitiba, 2010. Disponível em: < http://www.meioambiente.pr.gov.br/arquivos/File/corh/Revista_Bacias_Hidrograficas _do_Parana.pdf > Acesso em 15 de maio 2013. SILVA, B.C.E. Chumbo - Balanço Mineral Brasileiro. Departamento Nacional de Produção Mineral (DNPM). Salvador, 2001. SILVA, S.A.S.C.; SILVA, H.K.P.; NORONHA, T.J.M.; DUARTE, M.M.M.B. Avaliação da Concentração de Metais Pesados em Mytella falcata (ORBIGNY, 1846) em 64 Banco Natural do Estuário do Rio Timbó Município de Paulista, Pernambuco, Brasil. Revista de Ciência, Tecnologia e Humanidade do IFPE, v.2, n. 1, p.23-36, 2010. SILVA, M. R. C. Estudo de sedimentos da bacia hidrográfica do Moji-Guaçu, com ênfase na determinação de metais. 2002. Dissertação (Mestrado em Química Analítica) - Instituto de Química de São Carlos, Universidade de São Paulo, São Carlos, 2002. Disponível em: <http://www.teses.usp.br/teses/disponiveis/75/75132/tde-02092002-165919/>. Acesso em: 29 de abril, 2013. SIRVINSKAS, L. P. Manual de Direito Ambiental. São Paulo. Editora Saraiva, 4º edição, 2006. p.175 a 326. TOMAZELLI, A.C. Estudo Comparativo das Concentrações de Cádmio, Chumbo e Mecúrio em seis Bacias Hidrográficas do Estado de São Paulo. 2003. 126f. Dissertação (Doutorado em Ciências - Área Biologia Comparada). Universidade de São Paulo, São Paulo, 2003. TUNDISI, J.G. TUNDISI, T.M. Limnologia. São Paulo, SP: Oficina de Textos, 2008, 631 p. TÜZEN, M. Determination of heavy metals in fish samples of the middle Black Sea (Turkey) by graphite furnace atomic absorption spectrometry. Food Chemistry, v. 80, n. 1, p. 119-123, 2003. UEL - UNIVERSIDADE ESTADUAL DE LONDRINA. Tratamento de Efluentes – Subárea Lodos Ativados: um estudo terminológico. Disponível em: < http://www.uel.br/grupo-estudo/get/glossarios_raquel/graquel_t.htm > Acesso em 10 de maio 2013. UFSC - UNIVERSIDADE FERERAL DE SANTA CATARINA. Sólidos. Disponível em: < http://www.ens.ufsc.br/corseuil/antigo/parametros/solido.html > Acesso em 10 de maio 2013. UNIVERSIDADE DO MINHO, Laboratórios de tecnologias ambientais. Análises físico-químicas cor, turbidez, ph, temperatura, alcalinidade e dureza. 2007. 16 f. Disponível em: < http://www.biologica.eng.uminho.pt/TAEL/downloads/analises/cor%20turbidez%20ph %20t%20alcalinidade%20e%20dureza.pdf> Acesso em 9 de maio 2013. USP – UNIVERSIDADE DE SÃO PAULO. Poluentes Inorgânicos: fontes de emissão. Instituto de Química das águas. 2008. Disponível em: < http://www.usp.br/gpqa/Disciplinas/qfl3201/Pol_Inorg.pdf > Acesso em 10 de maio de 2013. VITEK, T.; SPURN, P.; MARE, J.; ZIKOVA, A. Heavy Metal Contamination of the Louaka River Water Ecosystem. Acta Vet Brno, 76, p.149-154, 2007. 65 ANEXOS 66 ANEXO I Mapa dos Pontos de Coleta 67 ANEXO II Laudo das Análises de Metais Pesados no Mexilhão Dourado (UNIOESTE) 68 ANEXO III Laudo das Análises de Metais Pesados no Sedimento e Água (IAP)
Download




![Metais Pesados[1] - Professora Soely Geraldis](http://s1.livrozilla.com/store/data/000038677_1-3fd85b8f680410211230364196d6ff56-260x520.png)