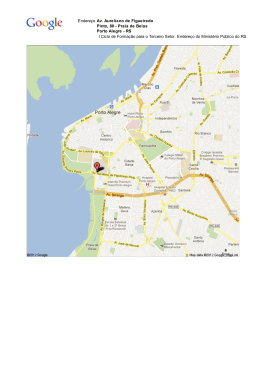
ERIK COSTA TEDESCO ESTUDO DAS DIATOMÁCEAS DA ZONA DE ARREBENTAÇÃO DA PRAIA DO CURURUPE, ILHÉUS – BA. ILHÉUS – BAHIA 2006 ERIK COSTA TEDESCO ESTUDO DAS DIATOMÁCEAS DA ZONA DE ARREBENTAÇÃO DA PRAIA DO CURURUPE, ILHÉUS – BA. Dissertação apresentada ao Curso de Pós- Graduação em Desenvolvimento Regional e Meio Ambiente da Universidade Estadual de Santa Cruz como parte integrante dos requisitos para a obtenção do Grau de Mestre. Área de Concentração: Meio Ambiente Orientador: a a Prof . Dr . Sylvia Maria Moreira Susini Ribeiro IILHÉUS – BAHIA 2006 AGRADECIMENTOS À minha orientadora Profa. Dra. Sylvia Maria Moreira Susini Ribeiro pela paciência, confiança e dedicação, incondicionais ao longo desses anos de estudo e trabalho. Ao Professor Dr. Salvador Airton Gaeta (IOUSP), a Luciana Frazão e a amiga Mayza Pompeu pelas análises de nutrientes realizadas no Instituto Oceanográfico – USP. Aos professores Marcelo Friederichs Landim de Souza, Alexandre Schiavetti, Lucio Figueiredo de Rezende e Ana Claudia da Silva Andrade pelo auxílio científico e sugestões ao longo desse trabalho. Ao Prof. Dr. Paulo César Oliveira Verge de Abreu (FURG) pelo apoio e sugestões no desenvolvimento desse trabalho Ao Prof. Dr. Leonardo Rörig (UNIVALI) pelo material bibliográfico disponibilizado e ajuda fornecida, que contribuíram bastante para a realização do presente trabalho. Ao grande amigo Max de Menezes, incentivador científico incondicional e um dos principais responsáveis pela realização desse trabalho. A família Nüscheler, em especial a Marc e Trix, pelo apoio, compreensão, paciência e incentivo ao longo de todos esses anos. Meus grandes motivadores e responsáveis pela minha permanência na vida acadêmica. Ao colega e amigo Antônio Fábio Figueiredo pela ajuda constante. A minha família e todos os amigos. A CAPES pela concessão da Bolsa. A INFRAERO pelo fornecimento dos dados meteorológicos. SUMÁRIO LISTA DE FIGURAS...................................................................................................VI LISTA DE TABELAS..................................................................................................VII LISTA DE APÊNDICES...............................................................................................X RESUMO....................................................................................................................XI ABSTRACT................................................................................................................XII 1. INTRODUÇÃO...................................................................................................1 1.1. 2. 3. 4. Objetivos......................................................................................................5 ÁREA DE ESTUDO...........................................................................................6 2.1. Localização..................................................................................................6 2.2. Aspectos Fisiográficos.................................................................................7 2.3. Climatologia..................................................................................................8 2.4. Hidrografia....................................................................................................9 2.5. Condições Oceanográficas........................................................................12 METODOLOGIA..............................................................................................14 3.1. Dados Meteorológicos...............................................................................14 3.2. Amostragem Temporal...............................................................................14 3.2.1. Temperatura e Salinidade.....................................................................15 3.2.2. Nutrientes Inorgânicos Dissolvidos.......................................................15 3.2.3. Biomassa Clorofiliana............................................................................16 3.2.4. Análise Quantitativa do Fitoplâncton.....................................................16 3.2.5. Análise Qualitativa do Microplâncton....................................................17 3.3. Amostragem nas Manchas.........................................................................18 3.4. Tratamento dos Dados...............................................................................18 RESULTADOS.................................................................................................20 4.1. Dados Meteorológicos................................................................................20 4.2. Amostragem Temporal...............................................................................21 4.2.1. Monitoramento Quinzenal.........................................................................21 4.2.2. Amostragem Extra.....................................................................................30 4.3. Amostragem nas Manchas.........................................................................38 4.4. Tratamento dos Dados...............................................................................40 4.4.1. Monitoramento Quinzenal.........................................................................40 4.4.2. Amostragem Extra.....................................................................................43 5. DISCUSSÃO....................................................................................................52 6. CONCLUSÕES................................................................................................58 7. REFERÊNCIAS BIBLIOGRÁFICAS................................................................70 LISTA DE FIGURAS Figura 1: Mapa da área de estudo com os pontos de coleta......................................6 Figura 2. Médias mensais de temperatura do ar (ºC) e precipitação acumulada mensal (mm) ao longo do período de estudo.............................................................20 Figura 3. Temperatura do ar (ºC)*, temperatura da água (ºC), precipitação pluviométrica (mm)* e salinidade durante as coletas diárias ao longo de uma semana. * = médias referentes aos dois dias que precederam cada uma das coletas, assim como aqueles referentes aos dias de coleta..............................................................22 Figura 4. Concentração de clorofila-a e número de células de Anaulus australis e Asterionellopsis glacialis na zona de arrebentação da praia do Cururupe, durante as amostragens quinzenais.............................................................................................23 Figura 5. Concentração de feopigmentos na zona de arrebentação da praia do Cururupe, durante as amostragens quinzenais..........................................................24 Figura 6: Concentração de clorofila-a e variação do número de organismos fitoplanctônicos durante as amostragens quinzenais.................................................25 Figura 7. Contribuição dos organismos do microplâncton para o total do fitoplâncton durante as amostragens quinzenais...........................................................................26 Figura 8. Contribuição dos organismos do nanoplâncton para o total do fitoplâncton durante as amostragens quinzenais...........................................................................27 Figura 9. Variação do número de células de Anaulus australis e Asterionellopsis glacialis durante as amostragens quinzenais.............................................................28 Figura 10. Número de células de Anaulus australis e Asterionellopsis glacialis durante as amostragens quinzenais. Os traços abaixo da indicação das datas (eixo X) identificam amostras coletadas na presença de manchas visíveis, enquanto que os asteriscos (*) indicam as amostras nas quais não foi possível identificar visualmente as manchas, porém apresentaram altas densidades de células de A. glacialis e/ou A. australis, durante as contagens.......................................................29 Figura 11. Temperatura do ar (ºC)*, temperatura da água (ºC), precipitação pluviométrica (mm)* e salinidade durante as coletas diárias ao longo de uma semana. * = médias referentes aos dois dias que precederam cada uma das coletas, assim como aqueles referentes aos dias de coleta..............................................................31 Figura 12. Concentração de clorofila-a na zona de arrebentação da praia do Cururupe, durante as coletas diárias ao longo de uma semana................................33 VI Figura 13. Concentração de feopigmentos na zona de arrebentação da praia do Cururupe, durante as coletas diárias ao longo de uma semana................................34 Figura 14. Contribuição dos organismos do fitoplâncton durante as coletas diárias ao longo de uma semana................................................................................................34 Figura 15. Contribuição dos organismos do microplâncton para o total do fitoplâncton durante as coletas diárias ao longo de uma semana.................................................35 Figura 16. Contribuição dos organismos do nanoplâncton para o total do fitoplâncton durante as coletas diárias ao longo de uma semana.................................................36 Figura 17. Variação do número de células de Anaulus australis e Asterionellopsis glacialis durante as coletas diárias ao longo de uma semana...................................37 Figura 18. Variação do número de células de Anaulus australis e Asterionellopsis glacialis nas manchas (verdetes) durante os anos de 2003 e 2005..........................39 Figura 19: Análise em componentes principais: posicionamento das estações no plano fatorial I-II em função das variáveis ambientais. Os pontos em destaque representam as estações com ocorrência de manchas.............................................41 Figura 20: Análise em componentes principais: posicionamento das estações no plano fatorial I-II em função das espécies. Os pontos em destaque representam as estações com ocorrência de manchas.......................................................................43 Figura 21: Análise em componentes principais: posicionamento das estações no plano fatorial I-II em função das variáveis ambientais. O ponto em destaque representa a estação com ocorrência de mancha.....................................................45 Figura 22: Análise em componentes principais: posicionamento das estações no plano fatorial I-II em função das variáveis ambientais. O ponto em destaque representa a estação com ocorrência de mancha.....................................................46 Figura 23: Amplitude (erro padrão) e média do número total de células do fitoplâncton na zona de arrebentação da Praia do Cururupe....................................47 Figura 24: Amplitude (erro padrão) e média do número de células do microfitoplâncton na zona de arrebentação da Praia do Cururupe............................48 Figura 25: Amplitude (erro padrão) e média do número de células do nanoplâncton na zona de arrebentação da Praia do Cururupe........................................................49 Figura 26: Amplitude (erro padrão) e média do número de células de Anaulus australis na zona de arrebentação da Praia do Cururupe..........................................50 Figura 27: Amplitude (erro padrão) e média do número de células de Asterionellopsis glacialis na zona de arrebentação da Praia do Cururupe..........................................51 VII LISTA DE TABELAS Tabela 1. Valores numéricos de predominância e velocidade (m/s) dos ventos, temperatura média do ar (ºC) e pluviosidade acumulada em Ilhéus, durante os meses de estudo........................................................................................................21 Tabela 2. Variação temporal da concentração de nutrientes inorgânicos dissolvidos, ao longo da amostragem quinzenal (APÊNDICE 1)...................................................22 Tabela 3. Lista dos organismos microplanctônicos identificados durante o período de estudo (APÊNDICE 2)................................................................................................76 Tabela 4. Valores numéricos de predominância e velocidade (m/s) dos ventos, temperatura média do ar (ºC) e precipitação (mm), durante as amostragens diárias.........................................................................................................................31 Tabela 5. Variação temporal da concentração de nutrientes inorgânicos dissolvidos durante as coletas diárias ao longo de uma semana ( M)........................................32 Tabela 6. Lista do microplâncton encontrado na Praia do Cururupe durante as coletas diárias ao longo de uma semana (28 de setembro a 03 de outubro de 2005) acompanhando a entrada de uma frente fria.............................................................38 Tabela 7: Porcentagem de Anaulus australis e Asterionellopsis glacialis nas manchas coletadas ao longo do litoral de Ilhéus........................................................39 Tabela 8. Coeficiente de correlação linear das variáveis ambientais com os quatro primeiros eixos (>0,05)...............................................................................................40 Tabela 9 Coeficiente de correlação linear das espécies com os quatro primeiros eixos (>0,05)...............................................................................................................42 Tabela 10. Coeficiente de correlação linear das variáveis ambientais com os quatro primeiros eixos (>0,05)...............................................................................................44 Tabela 11. Coeficiente de correlação linear das espécies com os quatro primeiros eixos (>0,05)...............................................................................................................45 Tabela 12. Análise de Variância fatorial (ANOVA) do número total de células do fitoplâncton na Praia do Cururupe, entre épocas do ano e pontos de coleta. FV: fatores de variação, SQ: soma dos quadrados, GL: graus de liberdade, QM: quadrado médio, F: valor do teste F e P: probabilidade exata..................................47 Tabela 13. Análise de Variância fatorial (ANOVA) do número de células do microfitoplâncton na Praia do Cururupe, entre épocas do ano e pontos de coleta. FV: fatores de variação, SQ: soma dos quadrados, GL: graus de liberdade, QM: quadrado médio, F: valor do teste F e P: probabilidade exata..................................48 VIII Tabela 14. Análise de Variância fatorial (ANOVA) do número de células do nanoplâncton na Praia do Cururupe, entre épocas do ano e pontos de coleta. FV: fatores de variação, SQ: soma dos quadrados, GL: graus de liberdade, QM: quadrado médio, F: valor do teste F e P: probabilidade exata...................................49 Tabela 15. Teste Tukey HSD para a variável nanoplâncton entre épocas do ano e pontos de coleta.........................................................................................................49 Tabela 16. Análise de Variância fatorial (ANOVA) do número de células de Anaulus australis na Praia do Cururupe, entre épocas do ano e pontos de coleta. FV: fatores de variação, SQ: soma dos quadrados, GL: graus de liberdade, QM: quadrado médio, F: valor do teste F e P: probabilidade exata...................................50 Tabela 17. Teste Tukey HSD para a variável Anaulus australis entre épocas do ano e pontos de coleta......................................................................................................50 Tabela 18. Análise de Variância fatorial (ANOVA) do número de células de Asterionellopsis glacialis na Praia do Cururupe, entre épocas do ano e pontos de coleta. FV: fatores de variação, SQ: soma dos quadrados, GL: graus de liberdade, QM: quadrado médio, F: valor do teste F e P: probabilidade exata...................................51 Tabela 19. Teste Tukey HSD para a variável Asterionellopsis glacialis entre épocas do ano e pontos de coleta..........................................................................................51 IX LISTA DE APÊNDICES APÊNDICE 1 (Tabela 2): Variação temporal da concentração de nutrientes inorgânicos dissolvidos, ao longo da amostragem quinzenal....................................76 APÊNDICE 2. (Tabela 3): Lista dos organismos microplanctônicos identificados durante o período de estudo......................................................................................77 APÊNDICE 3: Perfis de variação do número de células dos organismos com freqüência superior a 15%..........................................................................................79 APÊNDICE 4 - Dados brutos de temperatura média do ar (°C)*, temperatura da água (°C), salinidade e precipitação média (mm)*, obtidos durante as amostragens quinzenais (03/12/2004 a 18/08/2005), na Praia do Cururupe. * = médias referentes aos dois dias que precederam cada uma das coletas, assim como aqueles referentes aos dias de coleta..............................................................81 X ESTUDO DAS DIATOMÁCEAS DA ZONA DE ARREBENTAÇÃO DA PRAIA DO CURURUPE, ILHÉUS – BA. ERIK COSTA TEDESCO Orientador: Profa. Dra. SYLVIA MARIA MOREIRA SUSINI RIBEIRO RESUMO As manchas causadas pelo acúmulo de diatomáceas na zona de arrebentação e os possíveis fatores que condicionam o seu aparecimento foram estudados no município de Ilhéus - BA, ao longo do ano de 2005. A direção e intensidade dos ventos associados à passagem de frentes frias parecem ser os principais responsáveis pelas oscilações nas variáveis físicas e químicas da zona de arrebentação, determinando a modificação da comunidade fitoplanctônica. O total de organismos fitoplanctônicos na zona de arrebentação da praia do Cururupe variou de 2,1 x 105 a 9,54 x 107 org/L. O estudo qualitativo do microplâncton relevou 154 taxa, sendo 109 pertencentes ao grupo das diatomáceas, 23 tintinídeos, 20 dinoflagelados e 2 cianobactérias. A assembléia microfitoplanctônica foi composta em sua maioria por espécies bentônicas nos períodos de ventos fortes e principalmente por espécies planctônicas, nos períodos de ventos moderados a fracos. Durante os períodos de vento forte foram encontrados os maiores valores de biomassa (106,5 mg de clorofila-a.L-1) associados às manchas. As espécies Asterionellopsis glacialis e Anaulus australis estiveram presentes em todas as manchas analisadas, com dominâncias esporádicas de uma sobre a outra. As duas espécies atingiram elevadas densidades celulares nas manchas: A. australis (1,81 x 106 a 7,78 x 108 org/L) e A. glacialis (4,72 x 105 a 1,81 x 109 org/L), sugerindo uma forte contribuição das manchas aos diversos níveis tróficos do ambiente de praia. Palavras-chave: Fitoplâncton, clorofila-a, zona de arrebentação, praias arenosas. XI STUDY OF SURF-ZONE DIATOMS IN THE CURURUPE BEACH, ILHÉUS – BA. ERIK COSTA TEDESCO Adviser: Profa. Dra. SYLVIA MARIA MOREIRA SUSINI RIBEIRO ABSTRACT Patches formed by surf diatoms accumulation in the sur-zone and their forcing factors had been studied in Ilhéus - BA, throughout the year of 2005. The direction and intensity of the winds associated to cold fronts seem to be the main feature responsible for the changes in the physical and chemical variables, determining the phytoplanktonic community. The total of organisms in the sur-zone of Cururupe beach varied from 2,1 x 105 to 9,54 x 107 org/L. The qualitative study of microplankton identified 154 taxa, being 109 diatoms, 23 tintinnids, 20 dinoflagellates and 2 cyanobacteria. The microphytoplanktonic assembly was composed, in its majority, by benthic species in strong wind periods and mainly by planktonic species, in moderate or weak wind ones. During strong wind events, the biggest biomass values were found (106,5 g Chl-a L-1) associated to the patches. The species Asterionellopsis glacialis and Anaulus australis were present in all patches analyzed, which occasionally were dominated by the former or the latter species. These two species reached high cellular densities in the patches, A. australis (1.81 x 106 to 7,78 x 108 org/L) and A. glacialis (4,72 x 105 to 1.81 x 109 org/L), suggesting a strong contribution of the patches to the higher trophic levels in the beach environment. Keywords: Phytoplankton, chlorophyll-a, surf-zone, sand beaches. XII 1. INTRODUÇÃO As praias de areia ao longo das costas litorâneas dos continentes mundiais eram consideradas, até pouco tempo atrás, como ambientes dominados por consumidores e tido como relativamente pobres em vida (BROWN, 1964; MCLACHLAN, 1980). Estudos recentes, realizados em numerosas praias de areia expostas, de média e alta energia, em latitudes temperadas e quente-temperadas, têm demonstrado a presença de elevada concentração de células fitoplanctônicas, (elevada produção primária) contrariando a idéia freqüentemente aceita de que estas regiões são dominadas por populações de organismos heterotróficos. As diatomáceas estão entre os organismos fotossintéticos mais abundantes nas águas marinhas, e um dos habitats nos quais elas ocorrem são as zonas de arrebentação das praias ou zonas de surfe (“surf-zone”). Algumas zonas de arrebentação de praias arenosas do mundo apresentam manchas, persistentes e visíveis, de coloração marrom escura, causada pelo acúmulo localizado de células de diatomáceas, geralmente de uma ou duas espécies (TALBOT et al., 1990; CAMPBELL, 1996). Existem poucas trocas ou perdas destas diatomáceas da região da zona de arrebentação para as regiões adjacentes, e estas espécies apresentam adaptações para permanecerem dentro da zona de arrebentação (TALBOT e BATE, 1987). Segundo McLachlan (1980) e Lewin e Schaefer (1983) a zona de arrebentação pode ser considerada como um ecossistema semifechado. Revisões sobre este assunto (LEWIN e SCHAEFER, 1983; TALBOT et al., 1990) têm demonstrado tratar-se de um fenômeno natural e não floração causada 1 por poluição da água ou qualquer outra causa antropogênica (BATE e MACLACHLAN, 1987). Estas manchas marrons se assemelham à manchas de óleo devido à elevada viscosidade e à coloração quase negra, e têm sido erroneamente consideradas como decorrentes de poluição por óleo (BATE et al., 1990). Sabe-se atualmente que elas são formadas pelo acúmulo de células na espuma superficial, resultante da habilidade destas diatomáceas em ascender à superfície, presas às bolhas de ar que se formam durante a arrebentação das ondas (LEWIN e SCHAEFER, 1983). Talbot e Bate (1988a) propuseram o seguinte modelo para a formação e o subseqüente desaparecimento das manchas, baseado em numerosas observações. No início da manhã, as células começam a se dividir. No momento da divisão elas se desprendem da camada mucosa. A perda do muco, por processo ainda desconhecido, faz com que as células sejam liberadas do sedimento pela ação das ondas. Estas entram na coluna de água, tornando-se planctônicas, e se prendem a bolhas de ar geradas pelas ondas. As células se concentram na interface água-ar, onde completam seu processo de divisão. No final da tarde, as células recentemente divididas, novamente desenvolvem uma camada de muco, que lhes confere uma superfície ativa, permitindo substituir as bolhas de ar por grãos de areia. Desta maneira, a população se torna episâmica à noite, até que as divisões se iniciem com o amanhecer. As questões relativas, de como o muco é formado e removido das células, são ainda desconhecidas (TALBOT et al., 1990). Estas manchas de diatomáceas ocorrem na zona de arrebentação de praias extensas e rasas, de regiões quentes a temperadas, com areia fina, e durante períodos em que os ventos sopram em direção à costa (ODEBRECHT et al., 1995; CAMPBELL, 1996). 2 Numerosos fatores ambientais têm sido considerados importantes para tornar uma praia particular, um ambiente propício para acumulação destas diatomáceas. Lewin e Schaefer (1983) e Talbot et al. (1990) citam a topografia da praia, um comprimento mínimo de praia, hidrologia, direção e velocidade do vento, suprimento de nutrientes e chuvas, como determinantes importantes. Talbot et al. (1990) propuseram um modelo de requerimentos para as “áreas ativas”, ou seja, áreas prováveis de se observar este fenômeno, e relataram que no hemisfério sul elas estariam restritas às latitudes de 29º S a 34º S. Segundo estes autores, os requerimentos meteorológicos necessários para a acumulação das diatomáceas na zona de arrebentação seriam: as ondas periódicas de elevada energia que acompanham as passagens dos distúrbios atmosféricos (frentes), ou os sistemas ciclônicos de baixa pressão gerados a oeste na região circumpolar, ao longo do oceano Antártico, e que se movem para leste. Entretanto, o próprio autor ressalta que a costa leste da América do Sul ainda não estudada, parece ser uma das áreas mais interessantes para este tipo de estudo. Somente seis espécies em todo o mundo têm sido relacionadas a este tipo de fenômeno: Anaulus australis Drebes e Schulz, Asterionella socialis Lewin e Noris, Asterionellopsis glacialis (Castracane) Round, Attheya armatus (West) Crawford, Aulacodiscus kittonii Arnott e Aulacodiscus africanus Cottam. MacLachlan e Bate (1984) concluem que os ecossistemas das zonas de arrebentação são baseados principalmente na cadeia macroscópica: fitoplâncton – zooplâncton - peixes, embora a alça microbiana na coluna de água seja também importante. A fauna macrobêntica e a fauna intersticial, embora ricas, são de menor importância no fluxo de energia. Campbell e Bate (1988) estimaram que a espécie Anaulus australis produzisse cerca de 120 kg C m-1 ano-1, na zona de arrebentação 3 da praia adjacente à desembocadura do rio Sundays, na Baía de Algoa, na África do Sul. Na praia do Cassino, no sul do Brasil, Gianuca (1983, 1985) relata que as manchas formadas por Asterionellopsis glacialis são a maior fonte de alimentos para os principais organismos bentônicos filtradores tais como Mesodesma mactroides, Donax hanleyanus e Emerita brasiliensis. A única referência a este fenômeno na costa nordeste é o trabalho de Franco (1998), em Sergipe, entre as latitudes 10 e 11º S, entretanto por ter sido publicado em português, em periódico nacional de pequena penetração internacional, não tem sido considerado nas grandes revisões sobre o assunto. “Verdete” é o nome vulgar utilizado pelos pescadores na costa nordeste do Brasil para denominar este fenômeno, freqüente nas praias do sul da Bahia, e caracterizado pela formação de manchas de coloração marrom escura, ou quase preta, na zona de arrebentação das praias. Devido à coloração bastante escura e à elevada viscosidade da água nestas manchas, são erroneamente confundidas com manchas causadas por poluição de óleo. Estas manchas são observadas por pescadores à muitos anos na costa leste da Bahia. Apesar do aspecto estranho, os pescadores sabem que determinadas espécies de peixes são atraídas para estas manchas, principalmente a tainha (Mugil sp), e costumam jogar tarrafas para pescar sobre elas. A falta de estudos na costa leste e nordeste do Brasil têm conduzido a teorias errôneas sobre a distribuição deste fenômeno em termos globais. A importância do desenvolvimento de estudos sobre as diatomáceas da zona de arrebentação em nossa costa tem sido reconhecida internacionalmente, como uma das áreas mais interessantes para este tipo de estudo, devido a sua localização e morfologia. 4 1.1. Objetivos Este trabalho visa estudar o aparecimento das manchas causadas pelo acúmulo de diatomáceas na zona de arrebentação, no município de Ilhéus, no litoral sul da Bahia, ao longo do ano, e os possíveis fatores que condicionam seu aparecimento. Procurando confirmar e quantificar a importância destas acumulações, este trabalho tem os seguintes objetivos específicos: • Determinar a composição, a densidade numérica e a biomassa em termos de clorofila-a da população fitoplanctônica da zona de arrebentação da praia do Cururupe, ao longo do ano; • Verificar a presença ou ausência das espécies Asterionellopsis glacialis e Anaulus australis na zona de arrebentação da praia do Cururupe ao longo do ano; • Correlacionar a comunidade fitoplanctônica observada na zona de arrebentação da praia do Cururupe com os parâmetros ambientais, ao longo do ano; • Determinar a composição das espécies presentes no maior número possível de manchas observadas ao longo do litoral do município de Ilhéus; 5 2. ÁREA DE ESTUDO 2.1. Localização A área de estudo é o litoral do município de Ilhéus, que tem seu limite norte na praia do Sargi (39º 02’ 28’’ W e 14º 30’ 06’’ S) e seu limite ao sul na barra do Rio Acuípe (38º 59’ 57’’ W e 15º 05’ 29’’ S), compreendendo uma faixa litorânea de aproximadamente 67 km de extensão, formada por praias arenosas expostas (Figura 1). A barra do Rio Almada e a embocadura do estuário do Rio Cachoeira são as interrupções mais significativas presentes neste trecho. Brasil 39º30’ 39º00’ N W # Ilhéus Bahia # # Sargi E S Tulha Marciano # # # Cururupe 14º30’ Oceano Atlântico # # 15º00’ # 10 0 10 km Acuípe Fonte: Figueiredo, A. F. 2006 Figura 1: Mapa da área de estudo com os pontos de coleta. 6 A faixa litorânea compreendida a norte da barra do Rio Sargi até a praia de Pé de Serra Grande (39º02’01’’ W e 14º28’53’’ S - extensão), município de Uruçuca, foi inserida no presente trabalho por se tratar de faixa contínua (2,5 km) de praia com características morfodinâmicas semelhantes às áreas da porção norte do litoral de Ilhéus, onde é freqüente a ocorrência do fenômeno. 2.2. Aspectos Fisiográficos O comportamento morfodinâmico das praias tem sido foco de vários trabalhos descritivos desde a década de 60. Um dos trabalhos mais utilizados e aceitos para a classificação das praias é o modelo evolutivo de estágios morfodinâmicos, proposto por Wright e Short (1984), a partir de longas séries temporais de praias australianas. Foram reconhecidos três estados ou estágios morfodinâmicos distintos, associados a diferentes regimes de ondas e marés, caracterizados por dois extremos (estado dissipativo e estado refletivo) e quatro estados intermediários. No estado dissipativo, observa-se uma ampla zona de surfe, declividade suave, areia fina e incidência de ondas de energia moderada. Os estados intermediários são caracterizados por uma progressiva redução da largura da calha longitudinal, em decorrência da migração do banco submarino da zona de arrebentação em direção à praia. Inclui praias com ondas de energia moderada, sedimento com areia média a grossa e praias mais instáveis e mais complexas. No outro extremo, estão as praias de estado refletivo, caracterizadas por uma zona de surfe estreita, declive acentuado, sedimento com areia média a grossa, com ondas do tipo mergulhante ou ascendentes, apresentando berma de praia elevada (WRIGHT e SHORT,1984). 7 Apoluceno (1998) desenvolveu a caracterização dos estágios morfodinâmicos das praias do litoral de Ilhéus, considerando a classificação de Wright e Short (1984). As praias a partir do extremo norte até um limite de cerca de 7 km a norte da desembocadura do Rio Almada foram classificadas como praias em estágio morfodinâmico dissipativo. A partir desse trecho, até a desembocadura do Rio Almada, persiste o estágio morfodinâmico intermediário, com presença de correntes de retorno abundantes e barras. Esta distribuição observada no local é resultado da presença do porto, que estendeu a região de sombra (região de baixa energia) de S e SSE, que anteriormente limitava-se ao setor da Enseada do Malhado, impedindo o desenvolvimento de praias dissipativas no trecho costeiro adjacente ao promontório. Para a maior parte das praias ao sul do Morro de Pernambuco, inferiu-se um estágio dissipativo, à exceção do trecho de Olivença, marcado pela presença de promontórios rochosos, onde foram encontradas praias em estágio morfodinâmico intermediário. Segundo Bittencourt et al. (2000), no estado da Bahia, a plataforma continental pode ser subdividida em dois trechos bem definidos. O primeiro trecho, localizado ao sul de Ilhéus, apresenta um baixo gradiente batimétrico e isóbatas com contornos bastante irregulares, alcançando a plataforma continental, expressiva largura em frente aos municípios de Belmonte e Caravelas. O segundo trecho, ao norte de Ilhéus, apresenta uma plataforma continental bastante estreita, com um forte gradiente batimétrico e isóbatas paralelas à linha de costa. 2.3. Climatologia Sob o ponto de vista climático, a região de Ilhéus se enquadra em uma área intertropical úmida. Sua temperatura média anual na zona litorânea é de 23ºC, e a 8 média do mês mais “frio” 21,7ºC. Os totais pluviométricos anuais são sempre superiores a 1.900mm, com uma média anual de 2.000mm, sendo setembro e outubro os meses mais secos, e março e abril os mais chuvosos, caracterizando clima úmido (SRH, 2004). De acordo com Bittencourt et al. (2000), a região estudada está situada dentro da Zona de Divergência da Célula Anticiclônica Semi-Estacionária do Atlântico Sul. Sazonalmente essa célula tende a se expandir e contrair. Durante o inverno, a zona de alta pressão cobre uma vasta área do país, enquanto durante o verão ela retorna para o oceano. Na zona costeira, esse movimento sazonal da zona de alta pressão controla a posição da Zona de Divergência (ZD). Durante o inverno, a ZD localiza-se a aproximadamente 20°S, enquanto que no verão ela migra em direção ao equador (13°S). Este padrão de circulação permite que, na costa do estado da Bahia, predominem ventos de NE durante o verão e o inverno, devido à migração da célula em direção sul e ao avanço de frentes frias, os ventos predominantes sejam de SE, gerando um padrão de ondas nesse sentido, além dos ventos de E que sopram durante o ano inteiro. Este padrão geral de circulação atmosférica é suscetível a distúrbios, particularmente quando da atuação de fenômenos atmosféricos como El Niño, que pode vir a interromper a ação dos ventos de SSE nessa região. 2.4. Hidrografia O município de Ilhéus está inserido em duas importantes bacias hidrográficas: a do Rio Almada e a do Rio Cachoeira, sendo a última, a principal da região. 9 A Bacia do Rio Almada encontra-se entre as coordenadas 14°26’ - 14°50’ S e 39°03’ - 39°44’ W, tendo como seu limite sul a Bacia Hidrográfica do Rio Cachoeira. Ocupa uma área de aproximadamente 1.910 km2 e é composta pelo rio Almada, tendo como principais tributários o Rio do Braço, Ribeirão do Boqueirão e Riacho Sete Voltas à margem direita, e o Rio São José e os ribeirões de Jussara e Braço Norte à margem esquerda. O Rio Almada, principal formador da Bacia, de regime perene, tem origem na Serra Pereira, no município de Almadina e percorre 135 km banhando as cidades de Almadina, Coaraci, Itajuípe e Ilhéus. Faz parte dessa bacia a Lagoa do Itaípe (Lagoa Encantada), com uma de 7 km2 de espelho d’água, localizada no município de Ilhéus (BAHIA, 2001a). A Bacia Hidrográfica do Rio Cachoeira (BHRC), maior das bacias da região leste da Bahia, encontra-se situada entre as coordenadas 14º 42' - 15º 20' S e 30º 01' - 40º 09' W. A sua área de drenagem é de 4.600 km2, abrangendo doze municípios: Firmino Alves, Floresta Azul, Jussari, Itaju do Colônia, Ibicaraí, Itapé, Itabuna, Ilhéus, Lomanto Júnior, Santa Cruz da Vitória (microrregião Ilhéus-Itabuna), Itororó e Itapetinga (microrregião Itapetinga). A população total da BHRC é de cerca de 600.000 habitantes (BAHIA, 2001a). Os rios Salgado e Colônia são os mais importantes afluentes da bacia do Rio Cachoeira. A sub-bacia do Rio Salgado possui uma área de drenagem de aproximadamente 1.020m2 e perímetro de 178 km. O Rio Salgado nasce na Serra do Salgado, aproximadamente a 4 km do povoado de Ipiranga, no município de Firmino Alves e passa a percorrer outros quatro municípios, Santa Cruz da Vitória, Floresta Azul, Ibicaraí e Itapé. Em toda a sua extensão de 88 km tem como principais afluentes, à margem esquerda, os Ribeirões Água Vermelha, do Luxo e 10 Salomé, Córrego Grande e Ribeirão Grande; à margem direita, os Ribeirões do Limoeiro, dos Barbados, do Batista e Rio de Dentro (BAHIA, 2001b). A sub-bacia do Rio Colônia apresenta uma área de drenagem de aproximadamente 2.339 km2 e perímetro de 323 km. Com uma extensão do seu curso de água principal de 137 km, abrange os municípios de Itororó, Itapetinga, Itaju do Colônia e Jussari, tendo sua confluência com o Rio Salgado no município de Itapé, passando a receber o nome de Rio Cachoeira. Após percorrer 50 km nos municípios de Itapé, Itabuna e Ilhéus, tem sua foz no local conhecido como Coroa Grande (município de Ilhéus), onde mistura suas águas com as dos rios Santana e Almada (FIGUEIREDO, 2005). Na porção sul do município de Ilhéus, localizam-se ainda os rios Cururupe e Acuípe, que compreendem duas pequenas bacias de drenagem costeira. O Rio Acuípe está situado no limite sul do município de Ilhéus e suas águas são utilizadas como nível de base natural, assumindo-se um baixo grau de perturbação ambiental, apesar de ser utilizado para recreação (ALVES, 2003). O Rio Cururupe está sujeito a uma pequena exploração turística, com a presença de cabanas e hotéis na região de sua desembocadura. Até o ano de 2003, funcionava em suas margens, a cerca de 1 km a montante de sua desembocadura, o depósito de resíduos sólidos (lixão) do município de Ilhéus, sugerindo um determinado grau de perturbação ambiental. No entanto, segundo Alves (2003), esse rio atende as exigências da resolução nº 257/2005 do CONAMA, não chegando a ser problemática a sua utilização para recreação de contato primário (classe 7, para águas salobras). 11 2.5. Condições Oceanográficas As características hidrográficas têm implicações diretas sobre a comunidade fitoplanctônica, antes de serem refletidas nos elos superiores da cadeia alimentar. De forma geral a circulação oceanográfica na plataforma brasileira se dá através das Correntes de Contorno Oeste. Na Região Central (entre Baía de Todos os Santos e o Cabo de São Tomé) a Água Tropical, com salinidade mais elevada e pobre em nutrientes, é transportada na direção sul ao largo da quebra da plataforma continental, através da Corrente do Brasil (BRANDINI et al., 1997). Segundo Ekau e Knoppers (1999), a Corrente Sul-Equatorial (CSE) atinge a costa nordeste brasileira entre 11 e15º S. Após se bifurcar, uma porção se dirige para noroeste, como Corrente da Costa Norte do Brasil e outra porção menor flui para o sul, formando a Corrente do Brasil (CB) que percorre a costa leste e sudeste brasileira. Tanto a Corrente do Brasil como a Corrente da Costa Norte do Brasil apresentam características típicas de águas oligotróficas, com baixas concentrações de nutrientes e elevados valores de temperatura e salinidade. No entanto, sobre a plataforma continental há o predomínio da massa de Água Costeira (AC), de origem continental caracterizada por apresentar temperatura superior à 22ºC e salinidade inferior a 35, com concentrações de nutrientes extremamente variáveis em função das taxas de drenagem e da geomorfologia local. Considerações descritivas sobre a circulação marinha da costa de Ilhéus, foram realizadas por Resende (2001) em abril de 2000. O trabalho foi baseado na observação do comportamento de corpos de deriva (garrafas), na dispersão de poluentes, em informações hidrográficas históricas e no saber empírico das populações locais de pescadores. Um total de 500 garrafas, marcadas com quatro cores distintas, foi lançado em uma radial defronte ao município de Ilhéus. Quatro 12 diferentes proximidades da costa foram utilizadas para o lançamento das garrafas. As garrafas apresentaram um transporte resultante prioritariamente para o norte, exceto para as garrafas lançadas na porção interna da plataforma continental (isóbata de 15m), as quais derivaram para o sul. O transporte de poluentes derramados em acidentes ocorridos entre janeiro e março de 2001, nesse trecho da costa baiana, indica uma deriva preponderantemente no sentido sul. Os resultados obtidos apontam a existência de uma complexa circulação de plataforma, aparentemente independente do padrão de circulação oceânica, em larga escala. Segundo Apoluceno (1998), na região de Ilhéus, há o predomínio de ondas decorrentes da ação de ventos de quadrante Leste (E) durante quase todo o ano, à exceção do período de transição primavera / verão. Durante o período de primavera e verão, as ondas oriundas de ventos Norte (N) e Nordeste (NE) são mais freqüentes em relação àquelas de quadrante SE. 13 3. METODOLOGIA 3.1. Dados Meteorológicos Os dados meteorológicos foram fornecidos pela estação meteorológica do Aeroporto de Ilhéus (INFRAERO). Para inferências sobre a variabilidade dos dados biológicos foram considerados os parâmetros meteorológicos de temperatura do ar (ºC), precipitação pluviométrica (mm), direção (°) e intensidade (m/s) dos ventos, referentes aos dois dias que precederam cada uma das coletas, assim como aqueles referentes aos dias de coleta. Foram consideradas também as médias mensais da temperatura do ar e precipitação pluviométrica durante o período estudado, visando perceber a existência de períodos com maiores ou menores pluviosidade (épocas seca e chuvosa) ao longo do ano. 3.2. Amostragem Temporal As amostragens foram realizadas em três pontos 1, 2 e 3 selecionados, na zona de arrebentação da praia do Cururupe (praia alvo), Ilhéus – BA (03 de dezembro de 2004 a 18 de agosto de 2005), visando determinar se há diferença na composição da comunidade microplanctônica. Foram estabelecidos um ponto na desembocadura do Rio Cururupe e dois outros localizados a norte e ao sul longe da influência de água doce. Esta estratégia amostral teve como objetivo monitorar a ocorrência das manchas de Asterionellopsis glacialis e Anaulus australis, visando verificar a existência de sazonalidade destas espécies e os fatores que provocam a formação das manchas, ao longo do ano. 14 Foi realizada ainda uma amostragem extra na zona de arrebentação da praia do Cururupe, com coletas diárias ao longo de uma semana (28 de setembro a 03 de outubro de 2005) visando acompanhar a formação de manchas, durante a passagem de uma frente fria ou de aumento do “swell” causados por ventos do quadrante sul. Os seguintes parâmetros físicos, químicos e biológicos foram considerados: 3.2.1. Temperatura e Salinidade As amostras de água foram coletadas na zona de arrebentação, com o auxílio de balde plástico. Os dados de temperatura foram obtidos através de um termômetro de mercúrio padrão, no momento da coleta, e a salinidade medida in situ, utilizando-se um refratômetro (ATAGO S/Mill-e 0-100%). 3.2.2. Nutrientes Inorgânicos Dissolvidos As amostras de água para determinação das concentrações de nutrientes inorgânicos dissolvidos (amônia, nitrato, nitrito, fosfato e silicato) foram filtradas em laboratório, imediatamente após a coleta, em filtros de fibra de vidro WHATMAN GF/F (47 mm de diâmetro) e congeladas em frascos de Nalgene, até o momento das análises. As metodologias utilizadas para a análise dos nutrientes dissolvidos foram as técnicas descritas por: Strickland e Parsons (1972) para nitrato; Grasshoff (1983) para nitrito; Solorzano (1969) para amônia e Koroleff (1983 a e b) para silicato e fosfato, respectivamente. 15 3.2.3. Biomassa Clorofiliana A análise de clorofila-a foi obtida através do método fluorimétrico com correção para feopigmentos de acordo com Lorenzen (1967). As amostras de água para análise da clorofila foram coletadas com balde, em sub-superfície, acondicionadas em frascos plásticos e mantidas no gelo até o momento da filtração. As amostras foram filtradas em filtros de fibra de vidro WHATMAN GF/F (47 mm de diâmetro), a uma pressão negativa inferior a 20 cm de mercúrio, mantidos secos e congelados, até o momento da extração. O volume filtrado variou de acordo com a turbidez da água. Os filtros foram acondicionados em envelopes de papel alumínio dentro de um frasco com sílica gel e estocados em congelador. Para a extração dos pigmentos, cada filtro foi colocado em um tubo de ensaio contendo 10 mL de acetona a 90% e mantidos no escuro por 24h no congelador. A fluorescência das amostras foi lida em um espectrofotômetro Lambda EZ 201, antes e após acidificação com duas gotas de HCl 10%. A calibração foi feita com água destilada. Os valores finais foram expressos em µg.L-1. 3.2.4. Análise Quantitativa do Fitoplâncton As amostras destinadas à análise quantitativa do fitoplâncton foram coletadas com auxílio de balde plástico, em sub-superfície, acondicionadas em frascos de 125 mL e fixadas com solução de formol neutralizada (hexametilenotetramina), a uma concentração final de 0,4%. As contagens e identificações foram realizadas em um microscópio invertido ZEISS, modelo Axiovert 40 CFL, segundo a metodologia descrita por Utermöhl (1958). Cada amostra foi corada com solução de Rosa de Bengala e deixada em repouso em cubetas de sedimentação de 2 ou 10 mL de volume, variando de acordo com a quantidade de 16 detrito presente na amostra, e contada após 24 horas de sedimentação. Utilizou-se uma câmara úmida para abrigar as amostras durante o período de sedimentação, para evitar a evaporação e conseqüente formação de bolhas, o que poderia dificultar a análise microscópica. O aumento de 200x foi usado para contar células maiores que 20 µm ou cadeias, em transectos, meia cubeta ou em toda área da cubeta de sedimentação, variando de acordo com a concentração de células. As células menores que 20 µm foram contadas com aumento de 400x, em transectos, também variando de acordo com a concentração de células. Foram contados entre 74 a 9.845 organismos o que corresponde a um erro mínimo estimado de cerca de 10% (LUND et al., 1958). 3.2.5. Análise Qualitativa do Microplâncton Volumes variáveis de água do mar sub-superficial (40 a 160L - dependendo da quantidade de material em suspensão) foram filtrados em redes de 20 µm de malhagem, com auxílio de baldes. As amostras foram acondicionadas em frascos de 250 ml e fixadas com formol neutralizado a 4% de concentração final. Estas amostras foram observadas e identificadas em um microscópio, com contraste de fase, da marca Zeiss, modelo Axiostar Plus. A identificação dos organismos baseouse em bibliografia especializada (KOFOID e CAMPBELL, 1929; CUPP, 1943; SOURNIA, 1986; RICARD, 1987; BALECH, 1988; CHRÈTIENE-DINET, 1990; TOMAS, 1996; POMPEU, 1998; TENENBAUM et al., 2004; TENENBAUM, 2006, dentre outras). Devido a grande quantidade de sedimento encontrado nas amostras, algumas células não puderam ser identificadas ao nível de espécie. 17 3.3. Amostragem nas Manchas As amostragens nas manchas foram realizadas pela comunidade envolvida (pescadores, pessoas que possuem bares em frente à orla, que observam diariamente o mar) quando visualizadas (verdetes). Foram distribuídos “kits” simples, contendo frascos de 125 mL, com formol neutralizado a 4% de concentração final e um copo plástico para coleta da água superficial na mancha. As pessoas envolvidas foram instruídas sobre o procedimento da coleta e periodicamente visitadas para o recolhimento do material e posterior análise no laboratório. Nestas coletas, somente o fitoplâncton foi analisado. Esta estratégia teve como objetivo verificar a abrangência do fenômeno ao longo do litoral entre Pé de Serra Grande – Acuípe, e quais espécies as compunham. 3.4. Tratamento dos Dados Visando revelar tendências e evidenciar possíveis relações entre variáveis ambientais, bióticas e abióticas foram executadas Análises de Componentes Principais (ACP). Foram analisadas as matrizes de dados ambientais (variáveis bióticas e abióticas) e de espécies observadas, referentes a cada uma das amostragens (quinzenal e diária). As variáveis abióticas consideradas na matriz de dados ambientais foram: temperatura da água (TAG), salinidade (SAL), precipitação pluviométrica (PRE), nitrito (NIT), nitrato (NAT), amônio (AMO), silicato (SIL), fosfato (FOS), intensidade do vento (INT) e temperatura do ar (TAR). As variáveis bióticas foram: clorofila-a (CLO) e feopigmentos (FEO). 18 Para a matriz de espécies observadas em cada uma das amostragens, foram considerados somente os taxa com freqüência superior a 15% no total das amostras. Os totais dos organismos foram transformados em Log (x+1). Após observar os resultados da ACP das variáveis abióticas optou-se pela utilização dos padrões de ventos dominantes para a separação de duas épocas no ano, uma vez que essa variável parece ter um papel importante no processo de formação das manchas. Ficou estabelecido como sendo o período de setembro a março, referente ao “verão” e o período de abril a agosto, referente ao “inverno”. Com o objetivo de verificar a existência de diferenças nos valores de clorofila-a, feopigmentos, total do fitoplâncton, do microfitoplâncton, do nanoplâncton, de Anaulus australis e de Asterionellopsis glacialis, entre os períodos de coleta (“verão” e “inverno”) e os diferentes pontos, foram realizadas Análises de Variância (ANOVA). 19 4. RESULTADOS 4.1. Dados Meteorológicos A precipitação total, durante o período amostral de dezembro de 2004 a outubro de 2005, foi de 2.091 mm. Os meses de abril (327 mm), maio (352,5 mm) e junho de 2005 (258,3 mm) foram os mais chuvosos totalizando 937,8 mm, enquanto que os meses menos chuvosos foram: dezembro de 2004 (52,6 mm) e outubro de 2005 (66,9 mm) (Figura. 2). 400 30 25 300 20 250 200 15 150 10 Temperatura do Ar (ºC) Pluviosidade Acumulada (mm) 350 100 5 50 0 0 dez/04 jan/05 fev/05 mar/05 abr/05 mai/05 jun/05 Precipitação Acumulada jul/05 ago/05 set/05 out/05 Temperatura do Ar Figura 2. Médias mensais de temperatura do ar (ºC) e precipitação acumulada mensal (mm) ao longo do período de estudo. A Tabela 1 apresenta os dados de vento para o período de estudo, com uma predominância dos ventos de quadrante NE e E, durante os meses de setembro a fevereiro e ventos de quadrante SW e W nos meses de março a julho. Nos meses de 20 maio a agosto, observa-se uma tendência maior ao predomínio de ventos de quadrante sul. Tabela 1. Valores numéricos de predominância e velocidade (m/s) dos ventos, temperatura média do ar (ºC) e pluviosidade acumulada em Ilhéus, durante os meses de estudo. Ventos Data Dez/04 Jan/05 Fev/05 Mar/05 Abr/05 Mai/05 Jun/05 Jul/05 Ago/05 Set/05 Out/05 a 1 Predominância (º) a 2 Predominância (º) Velocidade Média (m/s) 40 (NE) 60 (NE) 40 (NE) 30 (NE) 250 (SW) 270 (W) 220 (SW) 250 (SW) 270 (W) 40 (NE) 40 (NE) 3,4 3,2 3,5 3,0 3,1 3,5 3,5 3,9 3,7 3,9 3,8 30 (NE) 40 (NE) 30 (NE) 270 (W) 270 (W) 220 (SW) 240 (SW) 240 (SW) 140 (SE) 90 (E) 90 (E) Temperatura do ar (ºC) 26,3 26,6 26,6 26,8 25,6 24,8 23,6 22,3 23,0 24,3 25,4 Pluviosidade Acumulada (mm) 52,6 223,3 222,0 200,5 327,0 352,5 258,3 129,0 160,2 98,7 66,9 4.2. Amostragem Temporal 4.2.1. Monitoramento Quinzenal Os valores de temperatura da água na praia do Cururupe variaram de 24ºC, em julho de 2005, a 30ºC, em fevereiro, abril e maio de 2005, com uma média de 27°C para o período de dezembro de 2004 a 18 de agosto de 2005. A média dos valores de salinidade obtidos para o mesmo período foi de 34, com valor mínimo de 24 e máximo de 37 (Figura 3). 21 Figura 3. Temperatura do ar (ºC)*, temperatura da água (ºC), precipitação pluviométrica (mm)* e salinidade durante o período de estudo. * = médias referentes aos dois dias que precederam cada uma das coletas, assim como aqueles referentes aos dias de coleta. A Tabela 2 (Apêndice 1) mostra a variação temporal da concentração dos nutrientes inorgânicos dissolvidos (nitrito, nitrato, silicato, fosfato e amônia) ao longo do monitoramento quinzenal. As concentrações de nitrito e nitrato variaram desde valores abaixo do limite de detecção até máximos de 0,26 e 1,13 µM, com médias de 0,05 e 0,20 µM, respectivamente. A concentração de silicato variou entre o mínimo de 0,21 µM e o máximo de 45,38 µM, sendo o valor médio 7,33 µM. Os valores de fosfato variaram de concentrações abaixo do limite de detecção até um máximo de 0,38 µM, com uma média de 0,18 µM. Amônio variou entre um valor mínimo de 0,18 µM, até um máximo de 4,56 µM, apresentando uma média de 1,47 µM. 22 A estimativa da biomassa fitoplanctônica através da análise de clorofila-a apresentou valores extremos de 1,54 µg.L-1 no ponto 2 (06 de janeiro de 2005) e 106,5 µg.L-1 no ponto 1 (17 de junho de 2005), com uma média de 16,25 µg.L-1 para todo o período de estudo. Os maiores valores de clorofila-a foram registrados no período de abril a agosto (Figura 4), correspondendo aos picos de ocorrência dos organismos do microfitoplâncton. Figura 4. Concentração de clorofila-a e número de células de Anaulus australis e Asterionellopsis glacialis na zona de arrebentação da praia do Cururupe, durante as amostragens quinzenais. As amostras de clorofila-a e feopigmentos referentes ao dia 05 de maio de 2005 foram perdidas devido ao descongelamento provocado por uma queda de energia ocorrida no laboratório de Oceanografia Biológica da UESC, onde as mesmas encontravam-se armazenadas. Os valores de feopigmentos variaram desde concentrações abaixo do limite de detecção (03 de dezembro de 2004 - ponto 2) até 23 88,78 µg.L-1 (17 de junho de 2005 - ponto 1), com uma média de 11,12 µg.L-1 (Figura 5). Figura 5. Concentração de feopigmentos na zona de arrebentação da praia do Cururupe, durante as amostragens quinzenais. O total de organismos do fitoplâncton encontrado durante o monitoramento quinzenal variou de 2,1 x 105 (17 de dezembro de 2004 - ponto 1) a 9,54 x 107 org./L (18 de agosto de 2005 - ponto 1), na praia do Cururupe (Figura 6). O microfitoplâncton (organismos maiores que 20 µm) apresentou grande variação nos períodos estudados, tendo sido mais abundante nos períodos de 04 de março, 19 de abril, 19 de maio, 03 e 17 de junho e 18 de agosto de 2005, com médias de 8,74 x 106, 1,60 x 108, 2,12 x 108, 1,18 x 108, 7,41 x 107 e 3,17 x 108 org./L, respectivamente, formando as manchas de Asterionellopsis glacialis e Anaulus australis. Nos outros períodos coletados o fitoplâncton foi numericamente dominado pelo nanoplâncton (organismos 24 menores que 20 µm), variando de 7,41 x 105 org./L (03 de dezembro de 2004) a 3,39 x 107 org./L (05 de maio de 2005). Figura 6: Concentração de clorofila-a e variação do número de organismos fitoplanctônicos durante as amostragens quinzenais. O grupo das diatomáceas foi responsável pela quase totalidade do microfitoplâncton, perfazendo a totalidade dos organismos em 82% das coletas. Nos demais 18% das amostras, as diatomáceas variaram de 84 a 99% dos organismos contados; seguidas pelos dinoflagelados (1 a 16%) e pelas euglenofíceas (1%) (Figura 7). 25 Figura 7. Contribuição dos organismos do microplâncton para o total do fitoplâncton durante as amostragens quinzenais. 26 Figura 8. Contribuição dos organismos do nanoplâncton para o total do fitoplâncton durante as amostragens quinzenais. O nanoplâncton foi dominado pelos cocolitoforídeos (43%), seguidos pelos flagelados (33%), diatomáceas (24%) e dinoflagelados (1%). Os grupos das crisofíceas e das cianobactérias, tiveram ocorrências eventuais e de pouca expressividade, não chegando a totalizar 1% dos organismos contados (Figura 8). No ponto 1, durante as coletas de 18 de agosto de 2005 foram verificadas as mais elevadas concentrações das espécies Asterionellopsis glacialis (6,72 x 107 org/L) e Anaulus australis (2,2 x 107 org/L) (Figura 9). 27 Figura 9. Variação do número de células de Anaulus australis e Asterionellopsis glacialis durante as amostragens quinzenais. Foram coletadas manchas (verdetes) na zona de arrebentação em cinco ocasiões, correspondendo a 28% das amostragens. Vale salientar que, em outras oito ocasiões (44% das amostragens), apesar das manchas não terem sido visualmente perceptíveis, foram constatadas altas densidades de células (104 a 106 org/L) de Asterionellopsis glacialis e/ou Anaulus australis, durante as contagens (Figura 10). Em três dessas ocasiões (18 de fevereiro, 4 e 21 de março de 2005) foi observada a presença de manchas, no entanto não sendo possível a coleta uma vez que as mesmas localizavam-se na faixa mais externa da zona de arrebentação. 28 Figura 10. Número de células de Anaulus australis e Asterionellopsis glacialis durante as amostragens quinzenais. Os traços abaixo da indicação das datas (eixo X) identificam amostras coletadas na presença de manchas visíveis, enquanto que os asteriscos (*) indicam as amostras nas quais não foi possível identificar visualmente as manchas, porém apresentaram altas densidades de células de A. glacialis e/ou A. australis, durante as contagens. Na análise qualitativa do microplâncton foi considerado também o grupo dos tintinídeos, devido a sua elevada representatividade, superando os grupos dos dinoflagelados e das cianobactérias, ficando atrás somente do grupo das diatomáceas. A Tabela 3 (Apêndice 2) apresenta a lista dos organismos microplanctônicos identificados durante todo o período de estudo. Um total de 154 taxa foram identificados nas amostras quinzenais destinadas ao estudo qualitativo do microplâncton, sendo 109 pertencentes ao grupo das diatomáceas, 23 tintinídeos, 20 dinoflagelados e 2 cianobactérias. No que se refere às diatomáceas, os gêneros Chaetoceros com 14 espécies (C. atlanticus, C. coarctatus, C. compressus, C. concavicornis, C. convolutus, C. curvisetus, C. danicus, C.decipiens, C. diversus, C. eibenii, C. laciniosus, C. laevis, C. peruvianus e 29 C. tetrastichon), Rhizosolenia com 9 espécies (R. acuminata, R. hebetata, R. imbricata, R. pungens, R. robusta, R. setigera, R. simplex, R. striata e R. styliformis) e Odontella com 8 espécies (O. alternans, O. aurita, O. longicruris, O. mobiliensis, O. pulchella, O. pulcra, O. sinensis e Odontella sp) foram os mais representados. Dentre os dinoflagelados, o gênero Ceratium foi o mais representado, com 11 espécies identificadas (C. contortum, C. contrarium, C. extensum, C. furca, C. fusus, C. karsteni, C. macroceros, C. massiliense, C. trichoceros, C. tripos e C. vultur) e entre os tintinídeos o gênero Eutintinnus com 8 espécies (E. apertus, E. colligatus, E. lusus-undae, Eutintinnus sp1, Eutintinnus sp2, Eutintinnus sp3, Eutintinnus spl e E. tenue). As cianobactérias foram representadas pelos gêneros Anabaena e Trichodesmium. Somente 18 espécies apresentaram freqüência maior que 30% ao longo das 50 amostras coletadas para a análise qualitativa do microplâncton. Sendo 13 diatomáceas (Asterionellopsis glacialis, Anaulus australis, Chaetoceros curvisetus, C. decipiens, Delphineis sp1, Guinardia striata, Helicotheca tamesis, Odontella mobiliensis, Proboscia alata, Rhizosolenia pungens, R. robusta, R. styliformis, Thalassionema nitzschioides), 3 tintinídeos (Favella ehrenbergii, Tintinnopsis nordqvisti, Tintinnopsis sp1), 1 dinoflagelado (Ceratium trichoceros) e uma cianobactéria (Trichodesmium sp). 4.2.2. Amostragem Extra (entrada de frente fria) Os resultados referentes às amostragens diárias ao longo de uma semana visando entender o processo de formação das manchas das variáveis físicas, químicas e biológicas serão apresentados a seguir. Os dados meteorológicos podem ser visualizados na Figura 11. 30 25 35 20 30 15 25 10 20 5 15 0 Salinidade 40 Temperatura da água (ºC) Temperatura do ar (ºC) Precipitação (mm) 30 10 1 2 3 28.09.05 Temp ar (3 dias) 1 2 29.09.05 3 1 2 3 1 30.09.05 2 3 01.10.05 Precip(3 dias) 1 2 3 02.10.05 Salinidade 1 2 3 03.10.05 Temp da água(ºC) Figura 11. Temperatura do ar (ºC)*, temperatura da água (ºC), precipitação pluviométrica (mm)* e salinidade durante as coletas diárias ao longo de uma semana. * = médias referentes aos dois dias que precederam cada uma das coletas, assim como aqueles referentes aos dias de coleta. A Tabela 4 apresenta os dados de vento, referentes à amostragem diária realizada ao longo de uma semana, na tentativa de acompanhar a formação de manchas durante a passagem de uma frente fria. Tabela 4. Valores numéricos de predominância e velocidade (m/s) dos ventos, temperatura média do ar (ºC) e precipitação (mm), durante as amostragens diárias. Data 28/Setembro 29/Setembro 30/Setembro 01/Outubro 02/Outubro 03/Outubro Ventos Direção (º) Velocidade média (m/s) 90 (E) 5,1 210 (SW) 5,1 50 (NE) 5,1 130 (SE) 6,2 130 (SE) 6,2 130 (SE) 7,2 31 Temperatura do ar (ºC) 25 23 23 24 24 24 Precipitação (mm) 7,6 7,9 26,8 0,3 0 0 A média dos valores obtidos para a temperatura da água foi 27ºC, onde o valor mínimo foi 26ºC durante os dias 28 e 30 de setembro e o máximo alcançado no dia 02 de outubro (29ºC). A salinidade média foi de 35, com valor um máximo de 37 (29 de setembro) e mínimo de 34 (02 de outubro). As concentrações dos nutrientes inorgânicos dissolvidos podem ser visualizadas na Tabela 5. A concentração de silicato variou de 0,095 µM a 0,857 µM, com uma média de 0,434 µM. Amônio apresentou valores extremos de 1,044 µM e 4,240 µM, com média de 1,886. µM. A concentração de nitrato variou entre o mínimo de 0,016 µM e o máximo de 0,078 µM, sendo o valor médio 0,044 µM. Nitrito e fosfato apresentaram valores que variaram desde concentrações abaixo do limite detectável até máximos de 0,012 µM e 1,138 µM, respectivamente. Tabela 5. Variação temporal da concentração de nutrientes inorgânicos dissolvidos durante as coletas diárias ao longo de uma semana (µM). Data 28/9/2005 28/9/2005 28/9/2005 29/9/2005 29/9/2005 29/9/2005 30/9/2005 30/9/2005 30/9/2005 1/10/2005 1/10/2005 1/10/2005 2/10/2005 2/10/2005 2/10/2005 3/10/2005 3/10/2005 3/10/2005 Média Mínimo Máximo CV Ponto 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 Nitrito 0,012 0,012 0,004 0,004 0,004 0,000 0,004 0,000 0,000 0,000 0,000 0,008 0,000 0,000 0,008 0,012 0,000 0,004 0,004 0,000 0,012 0,005 Nitrato 0,062 0,070 0,053 0,053 0,033 0,016 0,029 0,021 0,021 0,078 0,045 0,049 0,053 0,053 0,041 0,066 0,029 0,016 0,044 0,016 0,078 0,019 Amônio 1,875 2,386 2,067 1,939 1,811 1,172 4,240 2,450 1,875 2,386 1,619 1,747 1,747 1,492 1,428 1,492 1,044 1,172 1,886 1,044 4,240 0,718 Silicato. 0,666 0,286 0,857 0,286 0,476 0,286 0,095 0,476 0,571 0,286 0,476 0,476 0,476 0,476 0,190 0,381 0,476 0,571 0,434 0,095 0,857 0,179 Fosfato. 0,046 0,138 0,092 0,000 0,000 0,000 0,000 0,046 0,046 0,138 0,046 0,046 0,092 0,046 0,138 0,138 0,092 0,138 0,069 0,000 0,138 0,053 A estimativa da biomassa fitoplanctônica através da análise de clorofila-a, apresentou baixa variação com valores próximos a média (3,1 µg.L-1), com exceção 32 do ponto 3 (28 de setembro), onde a presença de uma mancha elevou bastante a concentração de clorofila-a, alcançando um máximo de 15,6 µg.L-1. O valor mínimo de 1,2 µg.L-1 foi obtido durante o dia 30 de setembro, no ponto 1 (Figura 12). 0,10 16 0,09 14 0,08 10 0,06 0,05 8 0,04 6 Clorofila-a (µ g/L) Nº de Organismos/L x10 7 12 0,07 0,03 4 0,02 2 0,01 0,00 0 1 2 28.09.05 3 1 2 29.09.05 Anaulus australis 3 1 2 3 30.09.05 1 2 3 01.10.05 Asterionellopsis glacialis 1 2 02.10.05 3 1 2 3 03.10.05 Clorofila-a Figura 12. Concentração de clorofila-a na zona de arrebentação da praia do Cururupe, durante as coletas diárias ao longo de uma semana. Os valores de feopigmentos apresentaram uma média de 0,9 µg.L-1 e variaram de concentrações abaixo do limite de detecção até um máximo de 6,4 µg.L1 no ponto 3 (28 de setembro) (Figura 13). 33 7 6 Feopigmentos (µ g/L) 5 4 3 2 1 0 1 2 3 28.09.05 1 2 3 29.09.05 1 2 3 30.09.05 1 2 3 01.10.05 1 2 3 02.10.05 1 2 3 03.10.05 Figura 13. Concentração de feopigmentos na zona de arrebentação da praia do Cururupe, durante as coletas diárias ao longo de uma semana. Nº de Organismos / L x 10 6 1,5 1,0 0,5 0,0 28.09.05 29.09.05 30.09.05 Microplâncton 01.10.05 02.10.05 03.10.05 Nanoplâncton Figura 14. Contribuição dos organismos do fitoplâncton durante as coletas diárias ao longo de uma semana (média dos três pontos). 34 O estudo quantitativo do fitoplâncton durante a amostragem diária ao longo de uma semana revelou um mínimo de 3,3 x 105 org/L e máximo de 2,6 x 106 org/L, com média de 1,1 x 106 org/L nesta amostragem (Figura 14). O microfitoplâncton apresentou um mínimo de 2 x104 org/L (30 de setembro ponto 1) e um valor máximo de 1,3 x 106 org/L (28 de setembro - ponto 3) e média de 2,5 x 105 org/L. Durante esta semana, o nanoplâncton dominou o total de organismos do fitoplâncton, variando de 2,7 x 105 org/L (30 de setembro - ponto 3) a 1,4 x 106 org/L (28 de setembro - ponto 3), com uma média de 8,7 x 105 org/L. O microplâncton foi representado exclusivamente por diatomáceas (Figura 15), enquanto o nanoplâncton foi composto por flagelados (51%) e cocolitoforídeos (49%) (Figura 16). 14 Nº de Organismos / L x 10 5 12 10 8 6 4 2 0 1 2 28.09.05 3 1 2 29.09.05 3 1 2 3 1 30.09.05 2 01.10.05 3 1 2 02.10.05 3 1 2 3 03.10.05 Diatomáceas Figura 15. Contribuição dos organismos do microplâncton para o total do fitoplâncton durante as coletas diárias ao longo de uma semana. 35 12 Nº de Organismos / L x 10 5 10 8 6 4 2 0 1 2 3 28.09.05 1 2 29.09.05 3 1 2 3 30.09.05 1 2 3 1 01.10.05 Cocolitoforídeos 2 3 02.10.05 1 2 3 03.10.05 Flagelados Figura 16. Contribuição dos organismos do nanoplâncton para o total do fitoplâncton durante as coletas diárias ao longo de uma semana. As espécies Anaulus australis e Asterionellopsis glacialis estiveram presentes em todos os seis dias da amostragem. A espécie A. australis foi encontrada em todas as dezoito amostras ao longo dos seis dias de coleta, apresentando uma variação de 3 x 103 org/L (02 de outubro - ponto 1) a 6,82 x 105 org/L (01 de outubro, ponto 2), com uma média de 1 x 105 org/L (Figura 17). A. glacialis esteve ausente nos dias 30 de setembro (ponto 1) e 02 de outubro (ponto 3), alcançando um máximo de 9,97 x 105 org/L (28 de setembro - ponto 3) e apresentando média de 1,1 x 105 org/L. 36 Na análise qualitativa do microplâncton foram identificados 51 taxa, sendo 33 pertencentes ao grupo das diatomáceas, 9 tintinídeos, 7 dinoflagelados e 2 cianobactérias. Dentre as diatomáceas, o gênero Odontella foi o mais abundante, (O. longicruris, O. mobiliensis, O. pulchella e O. sinensis), no que se refere aos dinoflagelados, o gênero Ceratium (C. fusus, C. tenue, C. trichoceros, C. tripos e C. vultur) apresentou maior diversidade e entre os tintinídeos os gêneros Eutintinnus (E. apertus, E. lusus-undae, Eutintinnus sp1 e Eutintinnus spl) e Tintinnopsis (T. campanula, T. nordqvisti, T. tocantinensis e Tintinnopsis sp1) com 4 espécies cada, foram os mais representados. Assim como na amostragem quinzenal, as cianobactérias foram representadas pelos gêneros Anabaena e Trichodesmium (Tabela 6). Nº de Organismos / L x 10 4 40 68,2 99,7 30 20 10 0 1 2 3 28.09.05 1 2 29.09.05 3 1 2 3 30.09.05 Anaulus australis 1 2 3 01.10.05 1 2 3 1 02.10.05 2 3 03.10.05 Asterionellopsis glacialis Figura 17. Variação do número de células de Anaulus australis e Asterionellopsis glacialis durante as coletas diárias ao longo de uma semana. 37 Tabela 6. Lista do microplâncton encontrado na Praia do Cururupe durante as coletas diárias ao longo de uma semana (28 de setembro a 03 de outubro de 2005) acompanhando a entrada de uma frente fria. Anaulus australis Asterionellopsis glacialis Bacillaria paxillifera Bellerochea malleus Campylosira cymbeliformis Cerataulina pelagica Cerataulus turgidus Chaetoceros coarctatus Chaetoceros curvisetus Chaetoceros decipiens Delphineis sp1 Ethmodiscus gazellae Florella portocensis Guinardia striata Gyrosigma sp1 Haslea sp1 Helicotheca tamesis Eutintinnus apertus Eutintinnus lusus-undae Eutintinnus sp1 Eutintinnus spl Favella ehrenbergii Ceratium fusus Ceratium tenue Ceratium trichoceros Ceratium tripos Anabaena sp DIATOMÁCEAS Hemiaulus membranaceus Hemidiscus cuneiformis Licmophora abbreviata Meuniera membranacea Odontella longicruris Odontella mobiliensis Odontella pulchella Odontella sinensis Paralia sulcata Planktoniella muriformis Pleurosigma sp Rhizosolenia acuminata Rhizosolenia pungens Rhizosolenia robusta Thalassionema nitzschioides Triceratium favus TINTINÍDEOS Tintinnopsis campanula Tintinnopsis nordqvisti Tintinnopsis tocantinensis Tintinnopsis sp1 DINOFLAGELADOS Ceratium vultur Dynophysis tripos Pyrocystis robusta CIANOBACTÉRIAS Trichodesmium sp 4.3. Amostragem nas Manchas Foram consideradas 10 amostras coletadas em manchas nas praias de Ilhéus, 6 durante o período de abril a outubro de 2005, e 4 coletadas em 2003, durante o programa piloto do projeto. Em todas as manchas coletadas no presente estudo, Asterionellopsis glacialis e Anaulus australis estiveram presentes se alternando quanto à dominância. Em determinadas ocasiões o domínio numérico de uma espécie sobre a outra alcançou 99%. Do total de manchas coletadas, sete foram dominadas por A. glacialis e somente três por A. australis (Tabela 7). 38 Tabela 7: Porcentagem de Anaulus australis e Asterionellopsis glacialis nas manchas coletadas ao longo do litoral de Ilhéus. Local Data Anaulus australis (%) Asterionellopsis glacialis (%) Areia Branca 24.04.03 66 34 Pérola do Mar 24.04.03 30 70 Pérola do Mar 18.05.03 12 88 Milionários 26.06.03 1 99 Cururupe 19.04.05 2 98 Cururupe 19.05.05 31 69 Cururupe 03.06.05 11 89 Cururupe 17.06.05 58 42 Cururupe 18.08.05 21 79 Ponta da Tulha 12.10.05 99 1 O número de células destas duas espécies nas manchas variou entre 3,2 x 107 org/L em 18 de maio e 2,6 x 109 org/L em 24 de abril, ambas coletadas na Praia dos Milionários (Cabana Pérola do Mar) durante o ano de 2003, sendo as máximas concentrações de células de A. glacialis (1,8 x 109 org/L) e A. australis (7,8 x 108 org/L) também observadas na mancha do dia 24 de abril de 2003 – Pérola do Mar (Figura 18). Figura 18. Variação do número de células de Anaulus australis e Asterionellopsis glacialis nas manchas (verdetes) durante os anos de 2003 e 2005. 39 4.4. Tratamento dos Dados 4.4.1. Monitoramento Quinzenal A análise de componentes principais das variáveis abióticas e bióticas foi efetuada com a finalidade de revelar as principais tendências da variabilidade dos dados obtidos e expressar a complexidade das relações existentes entre as espécies e os parâmetros ambientais no ecossistema de zona de arrebentação da Praia do Cururupe. O resultado da ACP das variáveis abióticas das amostragens quinzenais pode ser observado na Figura 19. O plano fatorial separou quatro componentes principais, contribuindo para 74,83% da explicação da variância dos dados, sendo 31,73% referente ao eixo um e 19,00% relativa ao eixo dois (Tabela 8). Tabela 8. Coeficiente de correlação linear das variáveis ambientais com os quatro primeiros eixos (>0,05). Eixos fatoriais Variância explicada (%) Temperatura da água Salinidade Precipitação pluviométrica Clorofila-a Feopigmentos Nitrito Nitrato Amônio Silicato Fosfato Intensidade do vento Temperatura do ar I 31,73 II 19,00 III 14,65 IV 9,45 0,438 -0,28 0,316 -0,075 -0,054 -0,390 -0,243 -0,054 0,189 -0,211 -0,358 0,445 0,18 -0,114 0,214 0,557 0,582 -0,043 0,154 0,197 -0,191 0,327 -0,206 -0,096 -0,203 -0,508 -0,087 0,063 0,024 -0,068 0,333 0,381 0,617 -0,142 0,128 -0,104 0,091 0,266 -0,39 -0,241 -0,141 -0,296 0,306 0,54 -0,186 0,106 -0,409 0,071 A distribuição das estações sobre o plano fatorial I-II, mostra que o lado positivo do eixo um é formado principalmente pela temperatura do ar, da água, precipitação e silicato e no lado oposto pelo nitrito, intensidade do vento e nitrato. Esta distribuição indica que o primeiro eixo está associado ao regime de ventos e chuva da região. De um modo geral, no lado negativo deste eixo observam-se as 40 estações de maior hidrodinâmica decorrente da incidência dos ventos de quadrante S e SE com elevada intensidade e no lado oposto aquelas relacionadas ao período mais calmo, no qual a influência da pluma de água doce proveniente do rio Cururupe é mais notada. II (19,00%) FEO 0.9 CLO Ventos Fortes (S e SE) 0.7 FOS 0.5 0.3 PRE AMO NAT TAG 0.2 -0.9 -0.7 NIT -0.5 -0.3 SAL -0.2 0.2 0.3 “Runoff” -0.2 0.5 0.7 TAR 0.9 I (31,73%) SIL INT -0.3 Ventos Fracos -0.5 -0.7 -0.9 Figura 19: Análise em componentes principais: posicionamento das estações no plano fatorial I-II em função das variáveis ambientais. TAG = temperatura da água, SAL = salinidade, PRE = precipitação pluviométrica, NIT = nitrito, NAT = nitrato, AMO = amônio, SIL = silicato, FOS = fosfato, INT = intensidade do vento, TAR = temperatura do ar, CLO = clorofila-a, e FEO = feopigmentos. Os pontos em destaque representam as estações com ocorrência de manchas. O segundo eixo está mais correlacionado com o feopigmento, clorofila-a e fosfato no lado positivo e no lado negativo, com a intensidade do vento, silicato e salinidade. Este eixo parece estar associado a variação da biomassa clorofiliana, o que pode ser visto através da separação das estações onde foram observadas manchas de Asterionellopsis glacialis e Anaulus australis, em relação às demais. O resultado da ACP das espécies pode ser observado na Figura 20. O plano fatorial l-ll foi responsável por somente 36,38% da variância, sendo 18,27% relativa 41 ao eixo um e 18,11% relativa ao segundo eixo. O percentual acumulado só ultrapassou 50% no quarto eixo (Tabela 9). Tabela 9. Coeficiente de correlação linear das espécies com os quatro primeiros eixos (>0,05). Eixos fatoriais I II III IV Variância explicada (%) 18,27 18,11 10,70 9,52 0,004 0,220 0,198 -0,232 -0,140 0,010 -0,017 0,449 -0,002 -0,231 0,091 0,242 -0,220 0,473 0,494 0,518 0,475 0,129 0,153 0,351 -0,113 -0,093 -0,108 -0,282 -0,254 -0,204 0,204 0,256 0,054 -0,119 0,028 0,070 0,193 0,200 0,156 0,349 0,581 -0,095 0,467 0,033 0,234 0,154 0,331 0,107 0,071 -0,186 -0,253 0,340 0,514 0,097 -0,452 -0,006 0,149 -0,189 0,198 0,190 0,390 -0,009 -0,116 0,094 Anaulus australis Asterionellopsis glacialis Bellerochea malleus Campylosira cymbelliformis Cerataulus turgidus Delphineis sp Helicotheca tamesis Nitzschia longissima Paralia sulcata Pleurosigma sp Scripssiella sp SP1 Thalassionema nitzschioides Thalassiosira sp1 Thalassiosira sp2 No primeiro eixo destacaram-se principalmente Thalassiosira sp2, Thalassiosira sp1 e Nitzschia longissima, no lado positivo e Campylosira cymbeliformis, Pleurosigma sp e Thalassionema nitzschioides, no lado negativo do eixo (Figura 20). O segundo eixo apresentou elevada correlação positiva com Anaulus australis, Asterionellopsis glacialis e Cerataulus turgidus e correlação negativa com Paralia sulcata e Scripsiella sp. A linha pontilhada na Figura 20 mostra uma nítida separação das espécies predominantes no período de maior turbulência (parte superior) daquelas mais abundantes no período de calmaria (inferior). 42 II (18,11%) 0.7 Ventos Fortes (Ressuspensão) ANA AST 0.6 CER 0.4 TNI SP1 0.3 CAM BEL 0.1 -0.6 -0.4 -0.3 THA1 -0.1 0.1 HEL -0.1 0.3 0.4 0.6 0.7 NIT DEL I (18,27%) THA2 SCR -0.3 PLE PAR -0.4 Ventos Fracos (Calmaria) -0.6 Figura 20: Análise em componentes principais: posicionamento das estações no plano fatorial I-II em função das espécies. AST = Asterionellopsis glacialis, ANA = Anaulus australis, CAM = Campylosira cymbeliformis, CER = Cerataulus turgidus, BEL = Bellerochea malleus, SP1 = diatomácea cêntrica não identificada, TNI = Thalassionema nitzschioides, THA1 = Thalassiosira sp1, THA2 = Thalassiosira sp2, NIT = Nitzschia longíssima, SCR = Scripssiella sp, DEL = Delphineis sp, HEL = Helicotheca tamesis, PLE = Pleurosigma sp e PAR = Paralia sulcata. Os pontos em destaque representam as estações com ocorrência de manchas. 4.4.2. Amostragem Extra (entrada de frente fria) Os resultados obtidos para o período de entrada de uma frente fria, na tentativa de verificar os possíveis fatores responsáveis pela formação das manchas, serão apresentados a seguir. A ACP das variáveis abióticas e bióticas separou quatro eixos responsáveis por 81,82% da variância dos dados (Tabela 10). O primeiro eixo contou com um percentual de explicação de 33,40% e o segundo com 23,36%, totalizando 56,76% da explicação da variância. 43 Tabela 10. Coeficiente de correlação linear das variáveis ambientais com os quatro primeiros eixos (>0,05). Eixos fatoriais Variância explicada (%) Temperatura da água Salinidade Precipitação pluviométrica Clorofila-a Feopigmentos Nitrito Nitrato Amônio Silicato Fosfato Intensidade do vento Temperatura do ar I 33,40 II 23,36 III 14,42 IV 10,64 -0,388 0,428 -0,010 0,243 0,292 0,041 -0,074 0,211 0,138 -0,261 -0,412 0,462 0,014 0,097 0,455 -0,379 -0,397 -0,224 -0,219 0,281 -0,381 -0,340 -0,208 -0,025 -0,124 0,037 -0,105 -0,228 -0,107 0,589 0,494 0,324 -0,368 0,244 -0,061 0,118 0,046 -0,329 0,464 0,342 0,314 -0,211 0,333 0,464 0,060 0,119 -0,130 -0,231 A Figura 21 mostra uma nítida oposição entre a temperatura do ar e salinidade (lado positivo) e a temperatura da água e intensidade dos ventos (lado negativo) do eixo um. O eixo dois apresenta forte correlação com a precipitação pluviométrica (lado positivo) e as concentrações de feopigmentos, clorofila-a, silicato e fosfato (lado negativo). A distribuição das amostras sobre o plano fatorial I-II, sugere que o eixo representa diferentes condições climáticas de ventos fortes e ventos amenos, e o eixo dois, a pluviosidade. 44 II (23,36%) 1.04 PRE 0.83 AMO 0.63 0.42 Ventos Fortes SAL 0.21 Ventos Fracos TAG -1.04 -0.83 -0.63 -0.42 -0.21 0.21 0.42 0.63 0.83 I (33,40%) -0.21 INT NAT TAR1.04 -0.42 NIT -0.63 FOS SIL -0.83 CLO FEO -1.04 Figura 21: Análise em componentes principais: posicionamento das estações no plano fatorial I-II em função das variáveis ambientais. TAG = temperatura da água, SAL = salinidade, PRE = precipitação pluviométrica, NIT = nitrito, NAT = nitrato, AMO = amônio, SIL = silicato, FOS = fosfato, INT = intensidade do vento, TAR = temperatura do ar, CLO = clorofila-a, e FEO = feopigmentos. O ponto em destaque representa a estação com ocorrência de mancha. O resultado da ACP da matriz de espécies separou três fatores responsáveis por 78,03% da explicação dos dados (Tabela 11). Tabela 11. Coeficiente de correlação linear das espécies com os quatro primeiros eixos (>0,05). Eixos fatoriais Variância explicada (%) Anaulus australis Asterionellopsis glacialis Bellerochea malleus Campylosira cymbeliformes Cerataulus turgidus Thalassionema nitzschioides I 31,15 II 28,58 III 18,30 0,042 0,367 0,572 0,130 0,457 0,557 -0,696 -0,445 0,203 -0,361 -0,154 0,349 -0,156 -0,519 -0,217 0,672 0,453 0,049 O primeiro fator explica 31,15% da variância dos dados e é formado principalmente pelas variáveis Thalassionema nitzschioides, Bellerochea malleus e 45 Cerataulus turgidus, no lado positivo. O segundo fator que corresponde a 28,58% de explicação é formado pelas variáveis Anaulus australis, Asterionellopsis glacialis e Campylosira cymbeliformis e parece estar refletindo o número de células fitoplanctônicas, com as estações com valores mais altos apresentando-se no lado negativo e o oposto sendo encontrado no lado positivo (Figura 22). II (28,58%) 1.5 1.2 0.9 TNI 0.6 BEL 0.3 -1.5 -1.2 -0.9 -0.6 -0.3 0.3 0.6 0.9 1.2 1.5 I (31,15%) CER -0.3 -0.6 CAM -0.9 AST -1.2 ANA -1.5 Figura 22: Análise em componentes principais: posicionamento das estações no plano fatorial I-II em função das espécies. AST = Asterionellopsis glacialis, ANA = Anaulus australis, CAM = Campylosira cymbeliformis, CER = Cerataulus turgidus, BEL = Bellerochea malleus e TNI = Thalassionema nitzschioides, O ponto em destaque representa a estação com ocorrência de mancha. Os resultados das análises fatoriais executadas para o total de células do fitoplâncton, do microplâncton, do nanoplâncton, de Anaulus australis e de Asterionellopsis glacialis são apresentados nas Tabelas 12-19. Foram observadas diferenças entre os períodos de “verão” e “inverno” (vento forte e fraco), com os valores mais elevados encontrados no período de inverno, para todos os grupos considerados (Figuras 23-27). 46 Com relação aos pontos amostrados, o fitoplâncton e o microplâncton não apresentaram diferenças, em nenhum dos períodos. Considerando o nanoplâncton, o ponto 2 no verão diferiu do 3 no verão e dos demais pontos no inverno. Além disso, os pontos 1 e 3 no inverno diferiram entre si. Para o total de Anaulus australis e de Asterionellopsis glacialis houve diferença entre o ponto 2 no verão e os demais pontos de inverno, com valores sempre mais baixos no ponto 2. Foram testadas ainda as variáveis clorofila-a e feopigmentos, porém não foram encontradas diferenças. Todas as análises utilizaram um nível de significância α= 0,05. Tabela 12. Análise de Variância fatorial (ANOVA) do número total de células do fitoplâncton na Praia do Cururupe, entre períodos do ano e pontos de coleta. FV: fatores de variação, SQ: soma dos quadrados, GL: graus de liberdade, QM: quadrado médio, F: valor do teste F e P: probabilidade exata. FV SQ GL QM F P Períodos 73,11 1 73,11 26,03 0,000* Pontos 14,72 2 7,36 2,62 0,084 2,18 0,125 Período x Pontos 12,26 2 6,13 Erro 123,56 44 2,81 24,0 Número total de células do fitoplâncton 23,5 23,0 22,5 22,0 21,5 21,0 20,5 20,0 19,5 19,0 Verão Inverno Figura 23: Amplitude (erro padrão) e média do número total de células do fitoplâncton na zona de arrebentação da Praia do Cururupe. 47 Tabela 13. Análise de Variância fatorial (ANOVA) do número de células do microfitoplâncton na Praia do Cururupe, entre períodos do ano e pontos de coleta. FV: fatores de variação, SQ: soma dos quadrados, GL: graus de liberdade, QM: quadrado médio, F: valor do teste F e P: probabilidade exata. SQ GL QM F P Períodos 117,73 1 117,73 14,61 0,000* Pontos 30,02 2 15,01 1,86 0,167 1,29 0,284 FV Período x Pontos 20,82 2 10,41 Erro 354,49 44 8,06 24 Número de células do microfitoplâncton 23 22 21 20 19 18 17 16 Verão Inverno Figura 24: Amplitude (erro padrão) e média do número de células do microfitoplâncton na zona de arrebentação da Praia do Cururupe. 48 Tabela 14. Análise de Variância fatorial (ANOVA) do número de células do nanoplâncton na Praia do Cururupe, entre períodos do ano e pontos de coleta. FV: fatores de variação, SQ: soma dos quadrados, GL: graus de liberdade, QM: quadrado médio, F: valor do teste F e P: probabilidade exata. SQ GL QM Períodos 16,71 1 16,71 15,05 0,000* Pontos 11,73 2 5,87 5,28 0,009* Período x Pontos 6,12 2 3,06 2,76 0,074 Erro 48,85 44 1,11 FV F P 22,0 Número de células do nanoplâncton 21,5 21,0 20,5 20,0 19,5 19,0 Verão Inverno Figura 25: Amplitude (erro padrão) e média do número de células do nanoplâncton na zona de arrebentação da Praia do Cururupe. Tabela 15. Teste Tukey HSD para a variável nanoplâncton entre períodos do ano e pontos de coleta. Períodos Verão Verão Verão Inverno Inverno Inverno Pontos 1 2 3 1 2 3 1 0 Verão 2 0,810300 0 3 0,228981 0,022968 0 49 1 0,010743 0,000318 0,995360 0 Inverno 2 0,243556 0,011370 0,993326 0,715903 0 3 0,035165 0,000929 0,999988 0,996802 0,933227 0 Tabela 16. Análise de Variância fatorial (ANOVA) do número de células de Anaulus australis na Praia do Cururupe, entre períodos do ano e pontos de coleta. FV: fatores de variação, SQ: soma dos quadrados, GL: graus de liberdade, QM: quadrado médio, F: valor do teste F e P: probabilidade exata. SQ GL QM F P Períodos 317,25 1 317,25 16,01 0,000* Pontos 155,52 2 77,76 3,92 0,027* Período x Pontos 79,68 2 39,84 2,01 0,146 Erro 871,83 44 19,81 FV 22 Número de células Anaulus australis 21 20 19 18 17 16 15 14 13 12 11 10 Verão Inverno Figura 26: Amplitude (erro padrão) e média do número de células de Anaulus australis na zona de arrebentação da Praia do Cururupe. Tabela 17. Teste Tukey HSD para a variável Anaulus australis entre períodos do ano e pontos de coleta. Períodos Verão Verão Verão Inverno Inverno Inverno Pontos 1 2 3 1 2 3 1 0 Verão 2 0,160827 0 3 0,994778 0,137165 0 50 1 0,124623 0,000211 0,653893 0 Inverno 2 0,670611 0,002545 0,986425 0,857276 0 3 0,621314 0,002025 0,979470 0,891599 0,999999 0 Tabela 18. Análise de Variância fatorial (ANOVA) do número de células de Asterionellopsis glacialis na Praia do Cururupe, entre períodos do ano e pontos de coleta. FV: fatores de variação, SQ: soma dos quadrados, GL: graus de liberdade, QM: quadrado médio, F: valor do teste F e P: probabilidade exata. SQ GL QM F P Períodos 256,97 1 256,97 11,14 0,002* Pontos 168,21 2 84,11 3,65 0,034* Período x Pontos 114,59 2 57,29 2,48 0,095 Erro 1015,08 44 23,07 FV Número de células de Asterionellopsis glacialis 24 23 22 21 20 19 18 17 16 15 14 13 12 Verão Inverno Figura 27: Amplitude (erro padrão) e média do número de células de Asterionellopsis glacialis na zona de arrebentação da Praia do Cururupe. Tabela 19. Teste Tukey HSD para a variável Asterionellopsis glacialis entre períodos do ano e pontos de coleta. Períodos Verão Verão Verão Inverno Inverno Inverno Pontos 1 2 3 1 2 3 1 0 Verão 2 0,195840 0 3 0,942804 0,071765 0 51 1 0,331813 0,000729 0,980379 0 Inverno 2 0,726660 0,004490 0,999971 0,982276 0,000000 3 0,645046 0,003068 0,999722 0,993806 0,999992 0,000000 5. DISCUSSÃO As zonas de arrebentação formam um sistema único, com propriedades ecológicas características, podendo ser consideradas como um ecossistema semifechado. Esse ambiente é formado pela faixa da praia compreendida entre a porção externa das células de circulação (zona de arrebentação externa) e o limite superior da zona de varrido das ondas (MCLACHLAN, 1980; LEWIN e SCHAEFER, 1983). A região estudada é definida como zona intertropical úmida, apresentando altas temperaturas e elevadas taxas de precipitação pluviométrica. No presente estudo, a temperatura média do ar foi dois graus (°C) mais elevada que os valores propostos por SRH (2004) para a porção litorânea do município de Ilhéus. Entretanto, a precipitação pluviométrica acumulada não diferiu do valor freqüentemente citado para essa faixa do litoral, sendo o mês de maio o que apresentou a maior taxa pluviométrica. É importante ressaltar que no estado da Bahia a estação chuvosa é relativamente bem distribuída ao longo de todo o ano, muitas vezes não sendo encontrada uma estação propriamente seca (COELHO e SANTOS, 1995). Diversas forçantes físicas como ação dos ventos e aporte de águas continentais, bem como a interação com o oceano profundo, ditam a dinâmica da circulação sobre a região de plataforma continental. Na plataforma continental de Ilhéus há o predomínio da Água Costeira (AC) de origem continental, com concentrações de nutrientes extremamente variáveis em função da precipitação pluviométrica e das características geomorfológicas locais. Por outro lado, devido à 52 pequena extensão da plataforma continental neste trecho, pode haver uma ação determinante da circulação oceânica de larga escala levando a uma maior influência da Água Tropical (AT) sobre a dinâmica das correntes na plataforma (RESENDE, 2001). No presente estudo os valores de temperatura da água e salinidade apresentaram consideráveis oscilações inter-quinzenais. A temperatura da água variou de até 6ºC durante o período de estudo. A entrada de frentes frias com ventos de quadrante sul pode contribuir para as menores temperaturas encontradas durante esses eventos. Paralelamente, o volume relativamente pequeno de água na zona de arrebentação, torna esse ambiente mais suscetível a variações na temperatura. Foram observadas oscilações consideráveis na salinidade, relacionadas à influência da pluma estuarina do Rio Cururupe durante algumas amostragens, uma vez que as coletas foram realizadas sempre entre o início e o final da manhã, independentemente do estágio da maré (enchente ou vazante). Os valores de salinidade mais baixos encontrados no ponto 2, estão associados a essa interferência, uma vez que esse ponto está localizado na desembocadura do Rio Cururupe e devido a isso, sofre influência direta do aporte de água doce proveniente da descarga desse rio. Durante o período de verão, onde se observou uma baixa hidrodinâmica e maior influência da pluma estuarina na zona de arrebentação, o ponto dois apresentou diferença para número de células do nanoplâncton e número de células de Anaulus australis e Asterionellopsis glacialis, com relação a todos os pontos do período de inverno (Tabelas 15, 17 e 19). O regime pluviométrico da região litorânea do município de Ilhéus é influenciado por fatores ambientais (relevo e influência marítima) que contribuem para uma precipitação média anual mais elevada nesse setor (2.000mm). A distância 53 entre a estação meteorológica e o local de coleta deve ser levado em consideração. Chuvas fortes na região de drenagem do Rio Cururupe podem não ser detectadas pelo pluviômetro localizado na estação meteorológica do Aeroporto de Ilhéus. No entanto, sua influência será refletida, por exemplo, na salinidade da zona de arrebentação da praia adjacente. A utilização de uma única estação meteorológica exige uma maior cautela para analisar a influência dos dados de chuva nas variáveis físico-químicas das águas da praia do Cururupe, uma vez que esses dados fornecem somente informações sobre pluviosidade local. A circulação atmosférica normal, na qual predominam ventos oriundos de NE é perturbada pela entrada de frentes frias que fazem com que os ventos predominantes sejam de SE, gerando um padrão de ondas nesse sentido, além dos ventos de E, que sopram durante todo o ano (BITTENCOURT et al., 2000). Outro aspecto importante relacionado ao vento é o seu efeito no fluxo de água entre os estuários e a área costeira adjacente. No inverno ocorrem principalmente ventos de quadrante sul, que contribuem para o aumento da dinâmica da zona de arrebentação. Esses ventos provavelmente deslocam grandes quantidades de sedimento em direção à costa e podem promover o deslocamento de águas superficiais em direção ao estuário. Um melhor conhecimento dos processos de circulação nas praias de Ilhéus contribuiria para a elucidação dessas questões. Por outro lado, ventos de NE predominantes durante o verão podem causar renovação de água na zona de arrebentação. A baixa hidrodinâmica neste período pode estar contribuindo para uma maior influência das águas estuarinas observada neste trabalho. No entanto são raros os dados sobre circulação costeira para a região, o que não permite uma discussão mais aprofundada sobre os processos costeiros que ocorrem na região de Ilhéus. Foi observado um predomínio dos ventos 54 de NE com aumento da importância de ventos de quadrante sul nos meses de inverno, devido a maior intensidade e freqüência de entrada de frentes frias. Ondas, marés e correntes são os principais agentes físicos oceanográficos que regem a hidrodinâmica marinha, responsáveis pelo transporte e deposição de sedimentos ao longo das zonas costeiras. A incidência oblíqua de ondas na linha de costa é responsável pela formação de correntes litorâneas, através das quais as massas de água se deslocam paralelamente à linha de praia (SILVA, 1998). Processos de deriva semelhantes a este, poderiam explicar a ocorrência de manchas encontradas ao longo das praias de Olivença, as quais segundo Apoluceno (1998) apresentam estágios morfodinâmicos intermediários. Outro aspecto importante é a presença ao longo da costa de Ilhéus, de pequenos cursos de água conhecidos na região sul do país como sangradouros. Estes cursos de água também influenciam no escoamento das águas continentais para o oceano, uma vez que fazem parte da drenagem da zona costeira, escoando as águas de origem pluvial coletadas na planície costeira. Pouco se conhece sobre o padrão de drenagem, o comportamento morfodinâmico, a distribuição espacial e a influência no balanço sedimentar dos sangradouros no ambiente costeiro. Apesar disso, sua importância tem sido reconhecida como agente erosivo, transportador e deposicional do sistema costeiro (SILVA, 1998). As taxas de precipitação pluviométrica podem representar um fator de extrema importância sobre aporte de nutrientes proveniente dos “sangradouros”. A ACP das variáveis abióticas mostra de forma simplificada as relações entre as variáveis ambientais discutidas até aqui, bem como suas relações com a biomassa clorofiliana. O principal fator ambiental responsável pela distribuição da biomassa fitoplanctônica foi a intensidade do vento. Esta forçante provocou a 55 ressuspensão do fundo promovendo o aumento na concentração dos nutrientes (nitrito, nitrato e fosfato) e de células do sedimento (observar os pontos acima da linha pontilhada na Figura 19. Nos períodos de vento fraco, a baixa hidrodinâmica costeira permitiu uma maior influência da pluma estuarina na região da zona de arrebentação. Além disso, as elevadas temperaturas observadas neste período parecem associadas aos picos de elevada pluviosidade. A maior influência da pluma estuarina e das chuvas explicariam as maiores concentrações de silicato observadas no período de vento fraco (pontos abaixo da linha pontilhada na mesma figura). As regiões de zona de arrebentação de praias arenosas são tidas como ambientes com elevada concentração de nutrientes, o que faz com que organismos com tamanho celular mais elevado (nano e microplâncton) sejam favorecidos na competição com as porções menores (picoplâncton). As diatomáceas de zona de arrebentação apresentam comportamento e adaptações fisiológicas que lhes conferem vantagens sobre as demais. O domínio das diatomáceas é esperado para o ambiente de zona de arrebentação, onde condições de elevada instabilidade ambiental proporcionam vantagens na competição com os demais grupos de organismos. A turbulência na coluna de água parece constituir um dos principais fatores determinantes do sucesso das diatomáceas nesse ambiente. Os diferentes componentes (nano e microplâncton) respondem de forma distinta às alterações ambientais. Características como tamanho, motilidade e relação superfície/volume são os principais mediadores destas respostas. As pequenas dimensões e as altas taxas de reprodução das células nanoplanctônicas (menores que 20 µm), favorecem a manutenção de um elevado número de organismos mesmo em condições de oligotrofia (RIBEIRO, 1996). Uma forte 56 evidência disso foi encontrada no presente estudo, onde de maneira geral o fitoplâncton foi numericamente dominado pelos organismos deste grupo. No entanto, sob condições de elevada hidrodinâmica na zona de arrebentação em decorrência da passagem de frentes frias, foram observados elevados picos episódicos do microplâncton, causados principalmente pelo aumento nas concentrações celulares das diatomáceas Asterionellopsis glacialis e Anaulus australis. A ACP dos principais taxa do microfitoplâncton apresentou baixa porcentagem de explicação. De acordo com Margalef e Gonzalez-Bernáldez (1969) uma baixa explicação da variância pode ser esperada pela complexa interrelação entre o número de células das espécies fitoplanctônicas. No entanto, ainda que se tenha uma explicação relativamente baixa, a projeção das variáveis no espaço determinado pelos componentes correspondente é valida (LEGENDRE e LEGENDRE, 1984). A ACP dos principais taxa do microfitoplâncton sugeriu a separação de dois agrupamentos, o primeiro associado a condições de elevada turbulência da coluna de água e o segundo associado a temperaturas mais elevadas e condições de baixa turbulência (Figura 20). As espécies Asterionellopsis glacialis, Anaulus australis, Bellerochea malleus, Campylosira cymbeliformis, Cerataulus turgidus, diatomácea cêntrica não identificada (sp1) e Thalassionema nitzschioides formaram o primeiro grupo. Este grupo, formado em sua maioria por espécies bentônicas, esteve associado ao período de ventos de elevada intensidade predominantemente do quadrante sul (“inverno”) e a salinidades mais elevadas. Durante este período foram encontrados os maiores valores de biomassa relacionados a ressuspensão das células fitoplanctônicas e às manchas formadas por Asterionellopsis glacialis e Anaulus 57 australis, devido a maior turbulência na coluna de água (Figura 20). A ocorrência da diatomácea Campylosira cymbeliformes, espécie bentônica de hábito episâmico, associada às elevadas densidades de Anaulus australis e Asterionellopsis glacialis nas manchas pode também ser visualizada na (Apêndice 3). O segundo grupo foi composto pelos taxa Thalassiosira sp1, Thalassiosira sp2, Nitzschia longíssima, Scripsiella sp, Delphineis sp, Helicotheca tamesis, Pleurosigma sp e Paralia sulcata. Esse grupo formado principalmente por espécies planctônicas, parece estar relacionado à condição de ventos fracos (“verão”), com maior pluviosidade e maior influência da pluma de água doce. O efeito do distúrbio ambiental conduz a maior ou menor organização da comunidade, dependendo da sua intensidade e/ou freqüência. Para fitoplâncton distúrbios ambientais moderados possibilitam a coexistência de espécies características de etapas mais iniciais de desenvolvimento do sistema com as das etapas mais maduras, contribuindo para uma elevada diversidade (RIBEIRO, 1996). Deste modo, distúrbios em maior intensidade tendem a diminuir a riqueza de espécies, caracterizada pelo predomínio de poucas espécies. Essa situação ocorre durante a formação das manchas, onde as espécies Asterionellopsis glacialis e Anaulus australis são as principais responsáveis pelos picos de clorofila-a, evidenciando uma expressiva contribuição dessas espécies para a biomassa fitoplanctônica da zona de arrebentação das praias de Ilhéus durante as acumulações. A relação entre concentração de clorofila-a e valores de número de organismos encontrados no presente trabalho, muitas vezes, não apresenta correlação direta. De forma geral, os dois parâmetros apresentaram aumentos simultâneos, entretanto foram observadas situações nas quais, apesar de elevadas 58 densidades celulares, os valores de clorofila-a foram relativamente baixos. Este fato pode estar relacionado ao estado fisiológico das células, que influi na concentração de clorofila por célula; baixa concentração pode indicar uma fase de senescência celular. Os elevados valores de feopigmentos acompanhando os picos de clorofila-a nas manchas sugerem um forte forrageio (“grazing”) do zooplâncton, uma vez que as amostras não foram pré-filtradas, visando eliminar a influência dos organismos do zooplâncton nas leituras. O acompanhamento diário visando estudar a formação das manchas ao longo da entrada de uma frente fria, não foi bem sucedido. Na semana anterior à coleta o vento rondou de sul (S) forte à nordeste (NE) moderado. No início da série de coletas, o vento passou de leste (E) a sudoeste (SW), e depois a nordeste (NE) moderado e, no final, a sudeste (SE) forte. No entanto, a frente se dissipou para o oceano, interferindo no hidrodinamismo da zona de arrebentação, tornando as condições não propícias à formação de manchas. A temperatura da água e a salinidade apresentaram variações relativamente pequenas, com tendência ao aquecimento da água da zona de arrebentação ao longo dos cinco primeiros dias e com baixos valores de salinidade, explicados pela pelas fortes chuvas caídas nos três primeiros dias de coleta. A ACP das variáveis abióticas sugere que o eixo um representa a influência do vento, visualizado através do agrupamento das estações dos três primeiros dias de coleta, associadas aos ventos moderados, onde a salinidade da água era mais elevada (lado positivo); as estações dos três últimos dias, agrupadas no lado oposto, apresentavam uma massa de água mais quente e salinidade mais baixa, associada presença de fortes ventos de sudeste e temperaturas do ar mais baixas (Figura 21). 59 A salinidade mais baixa observada nos três últimos dias é, provavelmente, conseqüência da forte precipitação ocorrida nos dias anteriores. Por outro lado, a temperatura da água ainda elevada neste período é devido ao seu elevado calor específico, que necessita de um tempo maior para responder as variações de temperatura. O eixo dois está associado à precipitação pluviométrica no lado positivo e à biomassa no lado negativo. As estações localizadas próximo à extremidade positiva deste eixo correspondem aos dias de maior pluviosidade; em oposição, as estações localizadas na extremidade negativa, apresentam biomassa clorofiliana mais elevada. Provavelmente a elevada biomassa observada no ponto 3 do primeiro dia de coleta (ponto em destaque na Figura 20), com formação de mancha, foi decorrente dos eventos dos dias anteriores, não amostrados. Em relação à análise quantitativa, o fitoplâncton foi sempre dominado pelos organismos do nanoplâncton, e os valores mais elevados tanto do nanoplâncton quanto do microfitoplâncton foram observados no primeiro dia de coleta (Figura 14). Mostrando uma correlação clara entre concentração de clorofila-a (ponto em destaque na Figura 20) e o número total de organismos encontrados (Figura 14). Apesar de não ter sido possível acompanhar a formação de manchas, um indicativo da importância das forçantes físicas nesse processo pode ser observado na comunidade fitoplanctônica, composta principalmente pelo grupo das diatomáceas bentônicas, indicando um aumento na hidrodinâmica da zona de arrebentação como efeito da aproximação da frente fria (Figura. 22). Diferentes teorias tentam explicar o mecanismo de formação das manchas na zona de arrebentação das praias arenosas ao longo do mundo. Inicialmente esse fenômeno foi definido como uma “floração”. No entanto, florações são eventos 60 provocados por elevadas taxas de divisão celular relacionadas as condições ambientais favoráveis (luz, temperatura e nutrientes) ou até mesmo à poluição. Essa idéia foi refutada, uma vez que as manchas são formadas através do acúmulo de células devido a sua habilidade de ascender até a camada mais superficial da coluna de água, aderidas as bolhas de ar geradas pela ação das ondas (LEWIN e SCHAEFER, 1983). Esse deslocamento vertical, juntamente com as condições hidrodinâmicas, resulta nas elevadas concentrações de células encontradas nas manchas. A utilização dos termos “mancha” ou “acumulação” é mais indicada para se referir ao fenômeno, uma vez que os termos “bloom” ou “floração” correspondem a eventos de explosão populacional decorrentes de elevada taxa de reprodução. Os nutrientes parecem estar indiretamente envolvidos nesse processo, contribuindo para a manutenção das altas densidades de células durante os eventos. Rörig (1997) não encontrou relação entre clorofila-a e nutrientes em seu trabalho na Praia do Cassino – RS, onde os valores de nutrientes sempre foram altos e não-limitantes. Por outro lado, Resende (1995) associou acumulações mistas de Asterionellopsis glacialis e Anaulus australis a nutrientes disponibilizados por ressuspensão de sedimentos durante a passagem de frentes na Praia de Pontal do Sul, PR. No presente trabalho, aumento de nutrientes (principalmente nitrato, nitrito e fosfato) na zona de arrebentação está mais correlacionado à ressuspensão dos sedimentos de fundo do que ao aporte continental, exceto o silicato. Outros mecanismos envolvidos na formação das manchas são os ciclos de advecção e/ou migração de células, descritos para as diatomáceas Anaulus australis (TALBOT et al., 1990) em praias da África do Sul e Attheya armatus (LEWIN et al., 1975, na costa dos Estados Unidos. Correntes de retorno transportam as células para áreas além da zona de arrebentação onde as condições de calmaria levam a 61 uma sedimentação mais rápida. São então formados estoques de células na superfície do substrato ou até mesmo nas camadas mais superficiais do sedimento. Condições de elevada dinâmica levam a um aumento da largura da zona de arrebentação provocando a ressuspensão desses estoques. As células ressuspendidas, juntamente com as células já presentes na coluna de água são transportadas para a zona de arrebentação. Segundo Rörig (1997), na Praia do Cassino a formação das manchas pode ser justificada pelo somatório do efeito de ressuspensão dos estoques do sedimento (células atrás da zona de arrebentação), e as células já em suspensão, aliada a advecção em direção à costa promovida pela alta energia de ondas. Assim, as células podem ter diferentes destinos como: formar manchas (uma ou mais), permanecer na coluna de água sem acumular em superfície, ser transportadas para áreas laterais ou, até mesmo, para mar aberto. Tais fatores tornam complexa a quantificação segura do fluxo de células entre os diferentes setores. Em coletas realizadas no estuário do Rio Cachoeira em setembro de 2000 e agosto de 2001, a espécie Asterionellopsis glacialis alcançou valores elevados, superiores a 1,0 x 105 org/L em algumas estações. Estas células foram freqüentemente observadas envoltas por muco e aderidas a detritos inorgânicos (grãos de areia), devido à elevada hidrodinâmica local provocada pelos fortes ventos do quadrante sul, durante a passagem de frentes frias (TEDESCO e RIBEIRO, 2002). Talvez a ocorrência de células de A. glacialis no interior do estuário do Rio Cachoeira possa também ser justificada por um efeito promontório provocado pela presença do molhe do porto de Ilhéus, que juntamente com a ação dos ventos de quadrante sul direcionariam as células da zona de arrebentação das praias para a região da pluma do rio, ou até mesmo, para o interior do estuário. 62 Importantes processos fisiológicos estão associados ao ciclo de ressuspensão/sedimentação das diatomáceas de zona de arrebentação. Condições de elevada energia e luminosidade no ambiente podem favorecer altas taxas de produção de carbono orgânico dissolvido (COD) por essas diatomáceas (ABREU et al., 2003). Células cobertas por muco com diferentes características adesivas permitem a essas diatomáceas mudarem entre o habitat epibêntico e a coluna de água. Durante a manhã as diatomáceas se aderem a bolhas de ar, acumulando-se na zona de arrebentação. Por outro lado, o muco mais viscoso produzido durante o período da tarde facilita a aderência das células às partículas de areia em suspensão na coluna de água, aumentando a densidade e realçando assim a taxa de sedimentação durante esse período do dia. Parte da nova biomassa produzida pelas diatomáceas durante a presença das manchas, pode ser transferida para o sedimento depositado além da zona de arrebentação, através das correntes de retorno. O aumento da energia das ondas na zona de arrebentação poder dar início a um novo ciclo de sedimentação e ressuspensão (TALBOT e BATE, 1988 a e b; ODEBRECHT et al., 1995; RORIG e GARCIA, 2003). De acordo com Talbot e Bate (1988) a produção de muco por diatomáceas de zona de arrebentação, é uma característica comum entre este grupo de organismos, no entanto Rörig (1997) sugere que a adesão de Asterionellopsis glacialis a bolhas de ar e sedimento ocorre de forma simultânea. Sob condições de elevada turbulência há um maior fornecimento de bolhas de ar para serem aderidas as células envoltas pelo muco. Com a diminuição da turbulência, a instabilidade das bolhas de ar faz com que o peso dos sedimentos, também aderidos nas massas de células com muco, favoreça o afundamento das mesmas. Assumindo que as bactérias são as principais consumidoras de carbono orgânico dissolvido (COD) em 63 diversos ecossistemas aquáticos e considerando que grande parte da produção primária de diatomáceas de zona de arrebentação se dá na forma dissolvida, era esperado um aumento significativo na biomassa de bactérias nas primeiras horas ou dias, após os picos de biomassa das diatomáceas. Entretanto, isso não foi observado por Abreu et al. (2003) na Praia do Cassino – RS, onde o crescimento bacteriano não se mostrou estimulado pelo aumento no COD produzido nas acumulações de Asterionellopsis glacialis. Após o aparecimento das manchas o número de bactérias chegava a quase zero. Os autores sugerem uma forte defasagem (“decoupling”) entre atividade de bactérias heterotróficas e produção de diatomáceas no ambiente de zona de arrebentação da Praia do Cassino. As cinco principais razões apontadas pelos autores são: infecção viral (lise celular); forrageio (predação); qualidade do COD (peso molecular); competição por nutrientes (principalmente N e P) e produção de antibiótico. Outro importante processo fisiológico diz respeito à adaptação às condições de baixa luminosidade. Segundo Du Preez e Bate (1992), Anaulus australis é capaz de ativar o mecanismo fotossintético após ter sido mantida por dois meses sob condições de escuridão. Assim células provenientes dos estoques do substrato estariam aptas a retomar a atividade fotossintética normal, mesmo tendo permanecido sob condições de baixa luminosidade durante um determinado tempo. Sugere-se comportamento similar para Asterionellopsis glacialis, uma vez que esta é encontrada formando manchas juntamente com A. australis (Talbot et al., 1990; Resende, 1995). Odebrecht et al. (1995), em trabalho realizado na Praia do Cassino (RS), constataram variações significativas no número de células de Asterionellopsis glacialis entre amostras diurnas e noturnas, com menores valores nas amostras 64 coletadas no turno da noite. No presente estudo, apesar de não terem sido coletadas amostras no período noturno, foram observadas manchas na zona de arrebentação à noite. Fato semelhante também foi registrado por Rörig (1997). De maneira geral, nas manchas registradas no presente trabalho as duas espécies estavam presentes. Entretanto, na maior parte das vezes, Asterionellopsis glacialis foi numericamente dominante, e em alguns eventos Anaulus australis alcançou densidades celulares mais elevadas. Resende (1995) também registrou a co-ocorrência e a dominância entre Asterionellopsis glacialis e Anaulus sp na zona de arrebentação da Praia do Pontal do Sul (PR), durante o verão de 1993. Neste período as células de Anaulus foram presentes na maior parte das amostras de inverno, variando entre 2,0 x 103 e 5,1 x 105 org/L, associadas com ventos de quadrante sul. Entretanto, sob fortes ventos de quadrante sul, associados à entrada de uma frente fria, as duas espécies alcançaram altas concentrações nos dias 18 e 19 de janeiro: Anaulus sp (6,1 - 9,5 x 106 org/L) e A. glacialis (3,0 - 5,2 x 106 org/L), acompanhados por elevados valores de clorofila-a. No presente trabalho, as duas espécies também atingiram elevadas densidades celulares nas manchas: Anaulus australis (1,81 x 106 org/L a 7,78 x 108 org/L) e Asterionellopsis glacialis (4,72 x 105 org/L a 1,81 x 109 org/L). Os máximos registrados para as duas espécies ocorreram em uma mancha mista, no dia 24 de abril de 2003, coletada na Praia dos Milionários. O valor máximo encontrado para Asterionellopsis glacialis (1,8 x 109 org/L) no litoral de Ilhéus assemelha-se aos máximos encontrados na Praia do Cassino (7,09 x 108 org/L – ODEBRECHT et al., 1995; 1,30 x 108 org/L – ABREU et al., 2003; 4,40 x 108 org/L – RORIG e GARCIA, 2003). Entretanto, a média de células de A. 65 glacialis nas manchas observadas na região de Ilhéus (7,23 x 106 org/L) foi um pouco mais baixa que os valores encontrados por Rorig e Garcia (2003) para a Praia do Cassino (RS) (2,53 x 107 org/L). Rorig et al. (1997) registraram acumulações similares promovidas por Anaulus sp na zona de arrebentação da Praia dos Navegantes (SC). Em outubro de 1995, estes autores encontraram 4,4 x 1010 org/L desta espécie nas manchas. Este valor, supera o encontrado no presente estudo durante o evento de maior densidade celular de Anaulus (7,78 x 108 org/L). No entanto, deve-se levar em consideração o fato de se tratar de uma mancha mista, onde também foi observada uma elevada concentração de Asterionellopsis glacialis (1,81 x 109 org/L). Apesar das manchas causarem um aspecto estranho à água do mar, pescadores artesanais costumam jogar tarrafas e redes nestas manchas em busca das espécies de peixes associados a este fenômeno. Com base nas observações realizadas, peixes como a tainha (Mugil spp) e o robalo (Centropomus spp) são freqüentemente encontrados nas manchas, onde se beneficiam direta ou indiretamente do rápido incremento da biomassa fitoplanctônica. Diversos estudos sugerem uma forte contribuição das manchas aos diversos níveis tróficos do ambiente de praia (GIANUCA, 1983; 1985; McLACHLAN e BATE, 1984; BROWN e McLACHLAN, 1990; RORIG et al., 1997, RORIG, 1997; ABREU et al., 2003). O fitoplâncton contribui para as cadeias tróficas pelágicas e bentônicas da zona de arrebentação (zooplâncton > invertebrados > bentônicos > peixes residentes). Essa biomassa produzida pode ser exportada (peixes visitante, aves ou advecção) para o mar e para o continente. Por outro lado, a matéria orgânica dissolvida sustentará a alça microbiana onde será convertida em material particulado, tornando-se novamente disponível às cadeias tróficas pelágicas e 66 bentônicas. Outra porção poderá formar depósitos na praia, onde servirá de alimento para a fauna detritívora ou se tornará fonte de nutrientes para a vegetação do supralitoral. O excedente de matéria orgânica particulada e dissolvida não consumido pelas bactérias é canalizado para o fundo, gerando uma elevada produção secundária bentônica. 67 6. CONCLUSÕES • Acumulações de Asterionellopsis glacialis e Anaulus australis são freqüentes na zona de arrebentação das praias arenosas do litoral de Ilhéus (14° 30” S), contrariando a idéia previamente aceita que no hemisfério sul elas estariam restritas às latitudes de 29º S a 34º S. • A direção e intensidade dos ventos associados à passagem de frentes frias parecem ser os principais responsáveis pelas oscilações nas variáveis físicas e químicas da zona de arrebentação (ressuspensão de nutrientes de fundo), determinando o aparecimento das manchas de Asterionellopsis glacialis e Anaulus australis. • A ocorrência das manchas se dá ao longo de todo o ano, uma vez que a sua principal forçante (vento forte do quadrante sul) pode ocorrer em qualquer época do ano, no entanto, há uma maior freqüência de passagem de frentes frias no período de “inverno”. • O total de organismos do fitoplâncton encontrado na Praia do Cururupe variou de 2,1 x 105 a 9,54 x 107 org./L, sendo numericamente dominado pelo nanoplâncton, com picos episódicos de dominância do microfitoplâncton (manchas) no período de fortes ventos de quadrante sul. • O total de 154 taxa identificados foi dominado pelos grupos das diatomáceas (109 spp), Tintinídeos (23 spp), dinoflagelados (20 spp) e cianobactérias (2 spp). A assembléia microfitoplanctônica da zona de arrebentação da Praia do Cururupe foi composta em sua maioria por espécies bentônicas nos períodos de ventos fortes e principalmente por espécies planctônicas nos períodos de ventos moderados a fracos. • As espécies Asterionellopsis glacialis e Anaulus australis estiveram presentes na zona de arrebentação da Praia do Cururupe durante todo o período de estudo. 68 • Asterionellopsis glacialis e Anaulus australis estiveram presentes em todas as manchas coletadas, com dominâncias esporádicas de uma sobre a outra. 69 7. REFERENCIAS BIBLIOGRÁFICAS ABREU, P. C., RORIG, L. R., GARCIA, V. ODEBRECHT, C. e BIDDANDA, B. Decoupling between bacteria and surf-zone diatom Asterionellopsis glacialis at Cassino Beach, Brazil. Aquatic Microbial Ecology. 2003. 32: 219-228. ALVES, C. P. Comparação da qualidade da água de um estuário não impactado (Rio Acuípe) e outro sujeito à entrada de chorume (Rio Cururupe), Ilhéus – Bahia. Dissertação de Mestrado. Universidade Estadual de Santa Cruz, UESC. Ilhéus, BA. 2003. 74p. APOLUCENO, D. M. A influência do porto de Ilhéus-BA nos processos de acresção/erosão desenvolvidos após sua instalação. Dissertação de Mestrado. Universidade Federal da Bahia, UFBA. Salvador, BA. 1998.132p. BALECH, E. Los dinoflagelados del Atlantico Sudoccidental. Publicaciones Especiales Instituto Español de Oceanografia, 1988. 1: 219p. BAHIA, GOVERNO DO ESTADO(a). Superintendência de Recursos Hídricos – Universidade Estadual de Santa Cruz. Programa de Recuperação das Bacias dos Rios Cachoeira e Almada. Volume I, Tomo I. 2001. 48p. BAHIA, GOVERNO DO ESTADO(b). Superintendência de Recursos Hídricos – Universidade Estadual de Santa Cruz. Programa de Recuperação das Bacias dos Rios Cachoeira e Almada. Volume I, Tomo IV. 2001. BATE, G.C. e MCLACHLAN, A. Surf-zone discoloration by phytoplankton: the consequence of pollution? Mar. Pollut. Bull, 1987. 18: 65-67. BATE, G.C., CAMPBELL, E.E. e TALBOT, M.M.B. Primary productivity of the sandy beach surf-zones of southern Africa. In. Barnes, M. e Gibson, R.N. Trophic relationships in the marine environment. Proc. 24th Europ. Mar. Biol. Symp. Aberdeen University Press, 1990. 41-53. BITTENCOURT, A. C. S. P., DOMINGUEZ, J. M. L., MATIN, L. e SILVA, I. R. Patterns of sediment dispersion coastwise the State of Bahia – Brasil. Anais da Academia Brasileira de Ciências. Rio de Janeiro. 2000. 72: 1-19. 70 BRANDINI, F. P., LOPES, R. L., GUTSEIT, K. S., SPACH, H. L. e SASSI, R. Planctonologia na plataforma continental do Brasil – Diagnose e revisão bibliográfica. Rio de Janeiro, RJ. 1997. 196p. BROWN, A.C. Food relationships on the intertidal sandy beaches of Cape Peninsula, S. Afr. J. Sci., 1964. 60: 35-41. BROWN, A. C. e MCLACHLAN, A. Ecology of Sandy Shores. Elsevier, Amsterdam. 1990. 328p. CAMPBELL, E.E. e BATE, G.C. The estimation of annual primary production in a high-energy surf-zone. Bot. Mar., 1988. 31: 337-343. CAMPBELL, E.E. The global distribution of surf diatom accumulations. Rev. Chil. Hist. Nat., 1996. 69: 495-450. COELHO, P. A e SANTOS, M. C. F. Resultados das amostragens biológicas na pesca de camarões marinhos ao largo de Ilhéus, BA. Boletim Técnico-Científico do CEPENE, Rio Formoso, 1995. 3(1): 109-120. CHRÉTIENE-DINET, M.J. Atlas du Phytoplancton Marin. Editions du CNRS, Paris. 1990. 3: 261p. CUPP, E. E.. Marine Plankton Diatoms of the West Coast of North America. Bulletin of the Scripps Inst. Oceanogr. of the University of California. 1943. 5:237p. DU PREEZ, D. R. e BATE, G. C. Dark survival of the surf diatom Anaulus australis Drees et Schulz. Botanica Marina, 1992. 35: 315-319. EKAU, W. e KNOPPERS, B. An introduction to the pelagic system of the NorthEast and East Brazilian shelf. Archive of Fishery and Marine Research, Hamburg. 1999. 113-132. FIGUEIREDO, A. F. Análise do Risco de Salinização dos Solos da Bacia Hidrográfica do Rio Colônia - Sul da Bahia. Dissertação de Mestrado. Universidade Estadual de Santa Cruz, UESC. Ilhéus. 2005. FRANCO, C.R.P. Notas sobre alguns florescimentos de diatomáceas na costa de Sergipe, Brasil: ocorrência de Asterionellopsis glacialis (Castracane) 71 Round, Aulacodiscus crux Ehrenberg e Odontella spp. Publicações avulsas do centro acadêmico livre de biologia. Departamento de Biologia Universidade Federal de Sergipe, Aracaju. 1998. 2: 43-47. GIANUCA, N.M. A preliminary account of the ecology of sandy beaches in southern Brazil. In MCLACHLAN, A. e ERASMUS, T. (eds.) Sandy Beaches as Ecosystems. Dr W. Junk Publishers, The Hague. 1983. 413-419. GIANUCA, N.M. The ecology of a sandy beach in Southern Brazil. Tese de Doutorado, University of Southampton, 1985. 330p. GRASSHOF, K. Methods of seawater analysis. Weisshein Verlag Chemie. New York. 1983. 417p. KOFOID, C. A. e CAMPBELL, A. S. A conspectus of the marine and freshwater Ciliata belonging to the suborder Tinntinoinea, with descriptions of new species principally from the Agassiz Expedition to the eastern tropical Pacific, 1904 - 1905. Univ. Calif. Publs. Zool., 1929. 34 : 1 - 403. KOROLEFF, K. Determination of silicon. In: Grasshoff, K., Erhardt, M. e Kremling, K., eds. Methods of seawater analysis. 2nd ed. Weinhein, Verlag Chemie. 1983a. 174183. KOROLEFF, K. Determination of phosphorus. In: Grasshoff, K., Erhardt, M. e Kremling, K., eds. Methods of seawater analysis. 2nd ed. Weinhein, Verlag Chemie, 1983b. 125-139. LEGENDRE, L. e LEGENDRE, P. Ecologie numerique, 1. Le traitement dés donnees ecologiques. 2 eme ed. Quebec, Masson Presses de L’Université du Quebec. 1984. 260p. LEWIN, J. e SCHAEFER, C.T. The role of phytoplankton in surf ecosystems. In MCLACHLAN, A. e ERASMUS, T. (eds.) Sandy Beaches as Ecosystems. Dr W. Junk Publishers, The Hague, 1983. 381-389. LEWIN, J., HRUBY, T. e MACKAS, D.. Blooms of surf-zone diatoms along the coast of the Olympic Peninsula, Washington. V. Environmental conditions associated with the blooms. Estuarine, Coastal and Shelf Sci., 1975. 3: 229-241. 72 LORENZEN, C.J. Determination of chlorophyll and phaeopigments : spectrophotometric equations. Limnol. Oceanogr. 1967. 12: 343-346. LUND, J.W.G., KIPLING, C. e LEGENDRE, E.D. The inverted microscope method of estimating algal number and statistical basis of estimations by counting. Hydrobiologia, 1958. 11: 143-170. MARGALEF, R. e GONZALEZ-BERNÁLDEZ, F. Grupo de espécies associadas en el fitoplâncton del mar Caribe (N.E. de Venezuela). Inv. Pesq. 1969. 33: 287-312. MCLACHLAN, A. e BATE, G.C. Carbon budget for a high-energy surf zone. Vie Milieu, 1984. 34: 67-77. MCLACHLAN, A. e LEWIN, J. Observations on surf phytoplankton blooms along the coast of South Africa. Botanica Marina, 1981. 24: 553-557. MCLACHLAN, A. Exposed sandy beaches as semi-closed ecosystems. Mar. Environ. Res., 1980. 4: 59-63. ODEBRECHT, C., SEGATTO, A.Z. e FREITAS, C.A. Surf-zone chlorophyll a variability at Cassino Beach, southern Brazil. Est. Coast. Shelf Sci., 1995. 41: 8190. PARSONS, T.R., MAITA, Y. e LALLI, C.M. A manual of chemical and biological methods for seawater analysis. Pergamon Press. Oxford. 1984. 173 p. POMPEU, M. Microzooplâncton – Tintinnina da região de Abrolhos. Dissertação de mestrado. Instituto Oceanográfico da Universidade de São Paulo, SP. 1998. 84p. REZENDE, K.R.V. Dinâmica temporal do fitoplâncton de zona de arrebentação da praia de Pontal do Sul (Paranaguá – PR). Dissertação de mestrado. Instituto Oceanográfico da Universidade de São Paulo, SP. 1995. 71p. RESENDE, L.F. Estimativa dos padrões de circulação oceânica superficial baseada no lançamento de corpos de deriva e em derramamentos ocorridos no litoral sul do estado da Bahia. Revista Tecnologia e Ambiente, Criciúma. 2001. 7(2): 73-89. 73 RIBEIRO, S. M. M. S. Caracterização taxonômica e ecológica das comunidades pico-, nano- e microplanctônicas, superficial e profunda, da zona eufótica do Atlântico Sul. Tese de doutorado. Instituto Oceanográfico da Universidade de São Paulo, SP. 1996. 155p RICARD, M. Atlas du Phytoplancton Marin. Editions du CNRS, Paris. 1987. 2: 297p. RORIG, L. R. Acumulações da diatomácea Asterionellopsis glacialis e sua relação com as variáveis ambientais na praia do Cassino, Rio Grande, RS. Dissertação de mestrado. Universidade do Rio Grande, RS. 1997.128 p. RORIG, L. e GARCIA, V. M. T. Accumulations of the suf-zone diatom Asterionellopsis glacialis (CASTRACANE) ROUND in Cassino Beach, Southern Brazil, and its relationship with environmental factors. Journal of coastal Research. 2003. 167-177. SILVA, R. P. Comportamento morfodinâmico dos sangradouros entre a praia do Cassino e Chuí, RS. Dissertação de mestrado. Universidade Federal do Rio Grande do Sul, RS. 1998. 146p. SOLORZANO, L. Determination of ammonia in natural waters by the phenolhypoclorite method. Limnol. Oceanogr. 1969. 799-801. SOURNIA, A. Atlas du Phytoplancton Marin. Editions du CNRS, Paris. 1986. 219p. SRH. Bacias Hidrográficas da Bahia – Superintendência de Recursos Hídricos. 2004. 50p. STRICKLAND, J. H. D. e PARSONS, T. R.. A practical handbook of seawater analysis. 2nd ed. J. Fish. Res. Bd. Can. Bull. 1972. 167, 311p. TALBOT, M.M.B. e BATE, G.C. Distribution patterns of rip frequency and intensity in Algoa Bay, South Africa. Mar. Geol. 1987. 76: 319-324. TALBOT, M.M.B. e BATE, G.C. The use of false buoyancies by surf diatom Anaulus birostratus in the formation and decay of cell patches. Estuarine Coastal Shelf Sci., 1988a. 26: 155-167. 74 TALBOT, M.M.B. e BATE, G.C. The response of surf diatom populations to environmental conditions. Changes in the extent of the planktonic fraction and surface. Patch activity. Botanica Marina, 1988b. 31: 109-118. TALBOT, M.M.B., BATE, G.C. e CAMPBELL, E.E. A review of the ecology of surfzone diatoms, with specific reference to Anaulus australis. Ocean. Mar. Biol. Annu. Ver., 1990. 28: 155-175. TEDESCO, E. C. e RIBEIRO, S. M. M. S. Caracterização específica e ecológica do fitoplâncton no litoral sul da Bahia. Simpósio Brasileiro de Oceanografia. Instituto Oceanográfico da Universidade de São Paulo, SP. Brasil. 2002. TENENBAUM, D.R., VILLAC, M.C., VIANA, S.C., MATOS, M., HATHERLY, .M., LIMA, I.V. e MENEZES, M. Phytoplankton Atlas of Sepetia Bay, Rio de Janeiro. Brazil GloBallast Monograp Series. IMO, London, 2004. 1: 132p. TENENBAUM, D.R., GONÇALVES, C.P., PIMENTA, C.M.M., GOMES, E.T., EDUARDO, J., MENDES, M., HATHERLY, M.M.F., VIANA, S.C. Dinoflagelados e Tintinídeos da Região Central da Zona Econômica Exclusiva brasileira: guia de identificação. Museu Nacional, Série Livros, RJ. 2006. 15: 288p. TOMAS, C. R. (ed) Marine Phytoplankton: a guide to naked flagellates and coccolithophorids. Academic Press, Inc. San Diego, California. 1996. 263p. UTERMÖHL, H. Zur Vervollkomnnung der quantitativen phytoplankton methodik. Mitt. Int. Verein. Theor. angew. Limnol., 1958. 9: 1-38. WRIGHT, L. D. e SHORT, A. D. Morphodynamics variability of surf zones and beaches: a synthesis. Marine Geology, 1984. 56: 93-118. 75 APÊNDICES APÊNDICE 1 (Tabela 2): Variação temporal da concentração de nutrientes inorgânicos dissolvidos (µM), ao longo da amostragem quinzenal. Data 3/12/2004 3/12/2004 17/12/2004 17/12/2004 6/1/2005 6/1/2005 20/1/2005 20/1/2005 3/2/2005 3/2/2005 3/2/2005 18/2/2005 18/2/2005 18/2/2005 4/3/2005 4/3/2005 4/3/2005 21/3/2005 21/3/2005 21/3/2005 4/4/2005 4/4/2005 4/4/2005 19/4/2005 19/4/2005 19/4/2005 5/5/2005 5/5/2005 5/5/2005 19/5/2005 19/5/2005 19/5/2005 3/6/2005 3/6/2005 3/6/2005 17/6/2005 17/6/2005 17/6/2005 7/7/2005 7/7/2005 7/7/2005 15/7/2005 15/7/2005 15/7/2005 1/8/2005 1/8/2005 1/8/2005 18/8/2005 18/8/2005 18/8/2005 Média Mínimo Máximo CV Estação 1 2 1 2 1 2 1 2 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 Nitrito 0,016 0,003 0,000 0,013 0,006 0,003 0,006 0,010 0,013 0,010 0,006 0,006 0,022 0,006 0,000 0,000 0,000 0,000 0,087 0,043 0,043 0,021 0,065 0,065 0,000 0,021 0,087 0,153 0,131 0,043 0,065 0,054 0,000 0,087 0,065 0,109 0,065 0,153 0,021 0,131 0,087 0,264 0,264 0,176 0,021 0,043 0,242 0,176 0,043 0,000 0,059 0,000 0,264 0,071 Nitrato 0,027 0,040 0,027 0,035 0,009 0,013 0,021 0,016 0,015 0,036 0,030 0,026 0,114 0,033 0,087 0,332 0,125 0,628 0,000 0,000 0,000 0,000 0,000 0,268 0,913 0,202 0,393 0,000 0,000 0,142 0,000 0,071 0,327 0,344 0,170 0,260 0,219 0,033 1,135 0,238 0,185 0,560 0,407 0,537 0,656 0,580 0,000 0,000 0,434 0,272 0,199 0,000 1,135 0,257 76 Amônio 1,984 1,353 1,488 0,496 1,939 2,390 3,157 1,579 0,947 0,406 0,541 0,271 3,788 0,180 2,661 0,722 0,631 1,082 0,992 0,677 0,586 0,226 0,316 1,218 1,173 0,992 0,677 1,894 0,767 1,849 2,886 3,112 0,812 0,947 1,804 3,608 1,714 1,533 4,555 1,263 1,849 1,353 0,812 1,443 2,345 1,624 1,173 1,398 1,353 1,173 1,475 0,180 4,555 0,973 Silicato. 6,988 10,052 7,467 18,572 6,701 9,860 11,679 8,424 6,893 10,913 7,180 10,626 45,376 17,710 3,299 2,845 2,789 3,355 2,619 3,072 4,545 3,922 5,678 6,585 15,989 6,641 8,907 4,998 4,205 0,523 0,919 0,976 7,491 9,814 5,735 0,636 9,984 6,811 8,228 5,905 6,528 4,262 4,602 5,055 7,264 9,927 4,658 0,409 8,681 0,210 7,330 0,210 45,376 6,847 Fosfato. 0,146 0,098 0,098 0,049 0,049 0,049 0,049 0,000 0,049 0,000 0,000 0,000 0,049 0,234 0,234 0,382 0,320 0,319 0,319 0,319 0,221 0,185 0,185 0,172 0,234 0,221 0,19 0,19 0,123 0,221 0,221 0,234 0,234 0,221 0,368 0,185 0,172 0,185 0,185 0,234 0,283 0,234 0,270 0,234 0,234 0,185 0,136 0,234 0,185 0,182 0,000 0,382 0,098 APÊNDICE 2. (Tabela 3): Lista dos organismos microplanctônicos identificados durante o período de estudo. * TENENBAUM et al. 2004 Actinocyclus crassus Van Heurck DIATOMÁCEAS Amphiprora alata (Ehrenberg) Kütz Anaulus australis Drebes and Schulz Asterionellopsis glacialis (Castracane) Round Auricula complexa (Gregory) Cleve Bacillaria paxillifera (Müller) Hendey Bacteriastrum delicatulum Cleve Bellerochea horologicales Von Stosch Bellerochea malleus (Brightwell) Van Heurck Bleakeleya notata (Grunow) Round Campylosira cymbeliformis Cerataulina pelagica (Cleve) Hendey Cerataulus sp1 Chaetoceros atlanticus Cleve Chaetoceros coarctatus Lauder Chaetoceros compressus Lauder Chaetoceros concavicornis Mangin Chaetoceros convolutus Castracane Chaetoceros curvisetus Cleve Chaetoceros danicus Cleve Chaetoceros decipiens Cleve Chaetoceros diversus Cleve Chaetoceros eibenii (Grunow) Van Heurck Chaetoceros laciniosus Schütt Chaetoceros laevis Cupp Chaetoceros peruvianus Brightwell Chaetoceros tetrastichon Cleve Corethron criophilum Castracane Coscinodiscus asteromphalus Ehrenberg Coscinodiscus gigas Ehrenberg Coscinodiscus sp1 Coscinodiscus sp2 Cyclophora tenuis Castracane Cylindrotheca closterium (Ehrenberg) Reimann e Lewin Dactyliosolen phuketensis (Sundström) Hasle Delphineis sp1 Ethmodiscus gazellae (Janish e Grunow) Hustedt Florella portocensis Fragilariopsis doliolus (Wallich) Medlin e Sims Guinardia flaccida (Castracane) Peragallo Guinardia striata (Stolterfoth) Hasle Gyrosigma balticum (Ehrenberg) Rabenhorst Gyrosigma sp1 Haslea gigantea (Hustedt) Simonsen Haslea sp1 Haslea wawrikae (Husted) Simonsen Helicotheca tamesis (Shrubsole) Ricard Hemiaulus membranaceus Cleve Hemiaulus sinensis Greville Hemidiscus cuneiformis Wallich Isthmia enervis Ehrenberg Isthmia minima Harvey e Bailey Isthmia nervosa Kützing Lampriscus orbiculatum Leptocylindrus danicus Cleve Leptocylindrus minimus Gran Licmophora abbreviata Lioloma pacificum (Cupp) Hasle Lithodesmium undulatum Ehrenberg Meuniera membranacea (Cleve) Silva Navicula transitans var derasa (Grunow) Cleve Nitzschia bilobata Smith Nitzschia longissima (Brébisson) Ralfs Nitzschia sigma (Kützing) Smith Nitzschia sp1 Nitzschiella sp Nitzschiella sp2 Odontella alternans Odontella aurita (Lyngbye) Agardh Odontella longicruris (Greville) Hoban Odontella mobiliensis (JW Bailey) Grunow Odontella pulchella Odontella pulcra Odontella sinensis (Greville) Grunow Odontella sp Paralia sulcata (Ehrenberg) Cleve Plagiogrammopsis vanheurkii Grunow) Hasle Planktoniella muriformis (Loeblich, Wight e Darley) Round Pleurosigma angulatum (Quekett) W. Smith Pleurosigma sp1 Pleurosigma sp2 Pleurosigma sp3 Pleurosigma sp4 Pleurosigma sp5 Proboscia alata (Brightwell) Sundström Pseudonitzschia complexo delicatissima Pseudonitzschia complexo seriata 3 Pseudosolenia calcar-avis (Schultze) Sundström Rhabdonema adriaticum Kützing Rhizosolenia acuminata (H. Peragallo) H. Peragallo Rhizosolenia hebetata Bailey Rhizosolenia imbricata Brightwell Rhizosolenia pungens Cleve-Euler Rhizosolenia robusta Norman 77 APÊNDICE 2. (Tabela 3): Lista dos organismos microplanctônicos identificados durante o período de estudo (Continuação). * TENENBAUM et al. 2004 DIATOMÁCEAS Rhizosolenia simplex Rhizosolenia setigera Brightwell Rhizosolenia striata Rhizosolenia styliformis Brightwell Skeletonema costatum (Greville) Cleve Striatella unipunctata (Lyngbye) Agardh Surirella fastuosa Ehrenberg Synedra undulata (JW Bailey) W. Smith Thalassionema nitzschioides (Grunow) Mereschkowsky Thalassionemataceae* Thalassiosira sp1 Thalassiosira sp2 Toxarium undulatum Bailey Triceratium favus Ehrenberg Triceratium formosum Brightwell f. quinquelobatum (Greville) Hustedt TINTINÍDEOS Climacocylis scalaria Brandt Amphorellopsis acuta (Schmidt) Kofoid e Campbell Codonellopsis morchella (Cleve) Jörgensen Codonellopsis ostenfeldi (Schmidt) Kofoid e Campbell Eutintinnus apertus (Kofoid e Campbell) Kofoid e Campbell Eutintinnus colligatus (Kofoid e Campbell) Kofoid e Campbell Eutintinnus lusus-undae (Entz. Sr.) Kofoid e Campbell Eutintinnus sp1 Eutintinnus sp2 Eutintinnus sp3 Eutintinnus spl Eutintinnus tenue Favella ehrenbergii Claparède et Lachmann Favella ehrenbergii forma coxliella Favella sp1 Leprotintinnus simplex Schmidt Rhabdonellopsis apophysata (Cleve) Kofoid e Campbell Tintinnidium incertum Tintinnopsis baltica Brandt Tintinnopsis campanula (Ehrenberg) Daday Tintinnopsis nordqvisti Brandt Tintinnopsis sp1 Xystonellopsis dicymatica (Brandt) Kofoid e Campbell Ceratium contortum (Gourret) Cleve DINOFLAGELADOS Ceratium contrarium (Gourret) Pavillard Ceratium extensum (Gourret) Cleve Ceratium furca (Ehrenberg) Claparède et Lachmann Ceratium fusus (Ehrenberg) Dujardin Ceratium karsteni Pavillard Ceratium macroceros (Ehrenberg) Vanhöffen Ceratium massiliense (Gourret) Jorgensen Ceratium trichoceros (Ehrenberg) Kofoid Ceratium tripos (Müller) Nitzsch Ceratium vultur Cleve Dynophysis tripos Gourret Ornithocercus thumi (Schmidt) Kofoid e Skogsberg Protoperidinium grande (Kofoid) Balech Protoperidinium sp Pyrocystis fusiformis (Wyville-Thompson) Murray Pyrocystis hamulus semicircularis Cleve Pyrocystis noctiluca Murray ex Haeckel Pyrocystis robusta Kofoid Pyrophacus sp Anabaena sp CIANOBACTÉRIAS Trichodesmium sp 78 APÊNDICE 3: Perfis de variação do número de células dos organismos com freqüência superior a 15%. 79 APÊNDICE 3: Perfis de variação do número de células dos organismos com freqüência superior a 15% (continuação). 80 APÊNDICE 4. Dados brutos de temperatura média do ar (°C)*, temperatura da água (°C), salinidade e precipitação média (mm)*, obtidos durante as amostragens quinzenais (03/12/2004 a 18/08/2005), na Praia do Cururupe. * = médias referentes aos dois dias que precederam cada uma das coletas, assim como aqueles referentes aos dias de coleta. Data Estação 03/12/2004 03/12/2004 17/12/2004 17/12/2004 06/01/2005 06/01/2005 20/01/2005 20/01/2005 03/02/2005 03/02/2005 03/02/2005 18/02/2005 18/02/2005 18/02/2005 04/03/2005 04/03/2005 04/03/2005 21/03/2005 21/03/2005 21/03/2005 04/04/2005 04/04/2005 04/04/2005 19/04/2005 19/04/2005 19/04/2005 05/05/2005 05/05/2005 05/05/2005 19/05/2005 19/05/2005 19/05/2005 03/06/2005 03/06/2005 03/06/2005 17/06/2005 17/06/2005 17/06/2005 07/07/2005 07/07/2005 07/07/2005 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 Temperatura do ar (°C) 26,1 26,1 25,5 25,5 26 26 27 27 27 27 27 26 26 26 27 27 27 27 27 27 26 26 26 25 25 25 24 24 24 25 25 25 25 25 25 23 23 23 23 23 23 Temperatura da água (°C) 28 28 28 26 28 29 28 27 28 28 29 29 28 30 29 29 29 28 29 29 28 28 28 30 29 29 26 27 26 30 30 30 26 27 26 27 27 27 26 26 26 81 Salinidade 32 30 32 30 35 34 35 35 36 34 34 35 24 32 35 33 35 35 33 34 34 35 34 33 27 33 35 36 36 34 34 35 33 31 35 33 34 34 35 36 36 Precipitação Média (mm) 9,5 9,5 2,4 2,4 1,1 1,1 2,4 2,4 4,6 4,6 4,6 8,1 8,1 8,1 3,4 3,4 3,4 3,5 3,5 3,5 11,6 11,6 11,6 9,6 9,6 9,6 0,5 0,5 0,5 9,6 9,6 9,6 5,1 5,1 5,1 2,5 2,5 2,5 0,2 0,2 0,2 APÊNDICE 4. Dados brutos de temperatura média do ar (°C)*, temperatura da água (°C), salinidade e precipitação média (mm)*, obtidos durante as amostragens quinzenais (03/12/2004 a 18/08/2005), na Praia do Cururupe (Continuação). * = médias referentes aos dois dias que precederam cada uma das coletas, assim como aqueles referentes aos dias de coleta. Data Estação 15/07/2005 15/07/2005 15/07/2005 01/08/2005 01/08/2005 01/08/2005 18/08/2005 18/08/2005 18/08/2005 Média Mínimo Máximo CV 42 43 44 45 46 47 48 49 50 Temperatura do ar (°C) 22 22 22 22 22 22 24 24 24 25 22 27 1,68 Temperatura da água (°C) 24 24 24 25 25 26 26 27 27 27 24 30 1,63 82 Salinidade 36 37 37 35 35 35 36 32 35 34 24 37 2,36 Precipitação média (mm) 0,8 0,8 0,8 2,5 2,5 2,5 4,2 4,2 4,2 4,6 0,2 11,6 3,54
Download