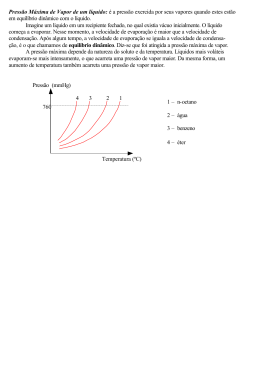
Profª Jana 01.(Ufsc 2012) Chegando ao apartamento dos pais em Florianópolis, Carlos resolve fazer um café. Coloca água para ferver e aguarda. Algum tempo depois comenta: “– Essa água parece que demora mais para ferver aqui do que em Urubici!”. Com base nas propriedades físicas das substâncias, é CORRETO afirmar que: 01) numa altitude menor a camada de ar sobre o local é maior, logo a temperatura de ebulição da água é maior. 02) a pressão de vapor de um líquido não é dependente da temperatura. 04) devido às forças intermoleculares, o ponto de ebulição da água é maior que o do H2S. 08) um líquido entra em ebulição quando sua pressão de vapor é menor que a pressão atmosférica. 16) uma mistura de água com açúcar tem ponto de ebulição maior que água pura. 32) o Mar Morto, na Jordânia, localiza-se a uma altitude de –395 metros, assim, o ponto de ebulição da água neste local deve ser maior que 100 °C. 02. (UFSC-2000) Uma embalagem de celofane, na forma de uma membrana semi-permeável, contendo uma solução 2,0 molar de NaCl, em água, foi mergulhada em um recipiente contendo um líquido desconhecido. Após algum tempo, o volume do líquido dentro da embalagem aumentou. Com relação ao líquido desconhecido, escolha, dentre as proposi-ções, a(s) que é (são) VERDADEIRA(S): 01. pode ser a água. 02. pode ser uma solução de 10 g/L de NaCl em água. 04. pode ser uma solução saturada de NaCl. 08. tem uma temperatura de ebulição maior que a da solução de NaCl. 16. congela em uma temperatura menor que a da solução de NaCl. 03. (UFSC-97)A adição de uma certa quantidade de uma substância iônica na volátil à água irá causar 01. aumento do ponto de congelação 02. diminuição do ponto de ebulição 04. diminuição do ponto de congelação 08. aumento da pressão máxima de vapor 16. abaixamento da pressão máxima de vapor. 04( UFSC-96)Assinale a única proposição correta: 01. A água do mar ferve a uma temperatura mais baixa que a água pura a uma mesma altitude em relação ao nível do mar. 02. A água do mar congela a uma temperatura mais baixa que a água pura a uma mesma altitude em relação ao nível do mar. 04.Uma solução aquosa de sacarose ferve a uma temperatura mais alta que a água pura a uma mesma altitude em relação ao nível do mar. O8. Uma solução aquosa de sacarose congela a uma temperatura mais alta que a água pura a uma mesma altitude em relação ao nível do mar. 16.Entre a água e o éter,o éter tem maior pressão de vapor porque é mais volátil que a água. 32. A adição de um soluto não volátil provocará um aumento da pressão de vapor do solvente. 05 .(UFSC-95) Ao colocar-se uma célula vegetal normal, numa solução salina concentrada, observar-se-á que ela começará a "enrugar" e a "murchar". Sobre esse fenômeno, é CORRETO afirmar: 01. a célula vegetal encontra-se num meio hipotônico em relação à sua própria concentração salina. 02. há uma diferença de pressão, dita osmótica, entre a solução celular e a solução salina do meio. 04. há um fluxo de solvente do interior da célula para a solução salina do meio. 08. quanto maior for a concentração da solução salina externa, menor será o fluxo de solvente da célula para o meio. 16. o fluxo de solvente ocorre através de membranas semipermeáveis. 06. (UFSC 1991) Observe a figura abaixo e selecione as opções CORRETAS. Preto:líquidopuro vermelho: solução (líquido puro + soluto não volátil) 01. A dissolução do soluto, no líquido puro, diminui a pressão do vapor do líquido. 02. Para uma mesma pressão, a temperatura de ebulição do líquido em solução é maior que a do líquido puro. 04. A pressão de vapor do líquido não varia após a dissolução do soluto. 08. Se o líquido fosse a água e o soluto o açúcar, a água, na solução, entraria em ebulição abaixo de 100ºC (P = 1 atm). 32. O abaixamento da pressão de vapor do líquido na solução é proporcional à sua fração molar. 07 . (Uern 2012) Sabe-se que a concentração de uma solução aquosa de cloreto de magnésio MgC 2 é 70g/1000g, fervendo a uma temperatura de 100,76°C e com a constante ebuliométrica molal da água igual a 0,52°C. Qual o grau de ionização desta solução? a) 2. b) 1. c) 0,7. d) 0,5. 08.(Udesc) Osmose é a medida do fluxo de solvente por meio de uma membrana semipermeável, para uma determinada solução. A pressão osmótica de uma solução 0 de KCl(aq) 0,02 mol.L-1 , a temperatura de 25 C, e 11considerando o fator i = 2 e R = 0,0821 L.atm.K mol , é: a) 0,98 atm. b) 0,082 atm. c) 0,49 atm. d) 0,097 atm. e) 0,82 atm. 09. (UFPR 2011) Em países do leste europeu e nórdicos, a adição de etilenoglicol (1,2-etanodiol) à água do radiador de carros é crucial, principalmente no inverno, para que não ocorra o congelamento do líquido. Na maior parte do Brasil, a preocupação é outra: a adição de etilenoglicol tem a função de aumentar a temperatura de ebulição, evitando a fervura e perda do líquido de arrefecimento dos motores. Utilizando a Lei de Raoult, calcule qual a temperatura de ebulição de uma solução 5% (m/m) de etilenoglicol. Considere uma cidade onde a temperatura de ebulição da água pura é de 94,0 ºC. Profª Jana -1 Dados: Constante ebuliométrica (Ke) =0,52 ºC; M (g.mol ) H = 1,008, O = 15,999, C = 12,01. 10. (UFRS) Considerando as três soluções do desenho, pode-se prever que a relação entre as pressões de vapor das mesmas é: Assinale a opção que apresenta a relação CORRETA para a pressão de vapor de A p A em equilíbrio com a solução líquida. a) pA p0A 1 x A 0 b) pA pB 1 xB 0 c) pA pB xA d) pA p0A x A 0 e) pA pB xB a) P1 > P2 > P3. b) P2 > P3 > P1. c) P1 > P3 > P2. d) P3 > P1 > P2. e) P2 > P1 > P3. (massas molares: glicose C6H12O6 = 180 g mol–1; cloreto de sódio NaCl– = 58,5 g mol–1; sacarose C12H22O11 = 342 g mol–1) Resumo : Lei de Raoult 11. (PUC-SP) A dissolução de 3 g de uma substância desconhecida em 100 g de CCl4 eleva o ponto de ebulição do CCl4 de 0,60 ºC. A constante ebuliométrica, KE, do CCl4 vale 5,03 ºC/molal, enquanto a constante criométrica, KC, vale 31,8 ºC/molal para o mesmo solvente. Para uma solução com a composição acima indicada, pede-se calcular: a) o abaixamento do ponto de congelamentode CCl4; b) o peso molecular do soluto desconhecido. 12. (UEL) O eugenol, um composto de fórmula molecular C10H12O2, é um ingrediente ativo do cravo-da-índia. O benzeno,um líquido inflamável e incolor, é um composto tóxico. O eugenol tem um ponto de ebulição de 256 ºC e obenzeno, de 80,10 ºC.Sabendo que uma quantidade de eugenol foi dissolvida em 10,0 g de benzeno e que a constante ebuliométrica Ke do benzeno é +2,53 (ºC molal−1), considere as afirmativas a seguir. I. O ponto de ebulição do benzeno continuará sendo 80,10 ºC, mesmo com a adição de eugenol. II. A quantidade de eugenol necessária para elevar a temperatura em 1,0 ºC é de 0,648 g. III. Se fossem dissolvidas 1,298 g de eugenol em 10,0 g de benzeno, a fração molar de benzeno nesta mistura seria de 0,942. IV. A dissolução do eugenol no benzeno diminuirá a pressão de vapor do benzeno. Assinale a alternativa correta. Para solutos iônicos : fator de correção de Van´t Hoff Ebulioscopia Solutos moleculares a) Somente as afirmativas I e II são corretas. b) Somente as afirmativas I e IV são corretas. c) Somente as afirmativas III e IV são corretas. d) Somente as afirmativas I, II e III são corretas. e) Somente as afirmativas II, III e IV são corretas. Solutos iônicos 13. (Ita 2013) Uma solução líquida constituída por dois componentes A e B e apresentando comportamento ideal, conforme Lei de Rauolt, está em equilíbrio com seu vapor. Utilizando a notação: x A e xB para as respectivas frações em mol das substâncias A e B na solução líquida, p A e pB para as respectivas pressões de vapor de A e B no vapor em equilíbrio com a solução líquida, e Solutos moleculares p0A e pB0 para as respectivas pressões de vapor de A puro e B puro numa mesma temperatura, Crioscopia Solutos iônicos Osmose
Download