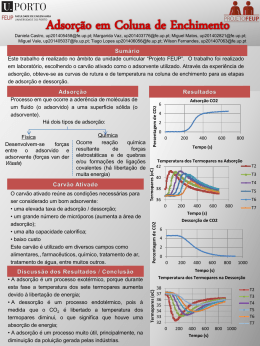
Universidade Estadual de Mato Grosso do Sul - Unidade Universitária de Naviraí Professor: Alberto A. Cavalheiro o PRÁTICA N 3 Título: ISOTERMAS DE ADSORÇÃO Físico-Química Experimental Assuntos envolvidos: Fenômeno de Adsorção, Isotermas, Adsorvato e Adsorvente, Modelo de Langmuir de Adsorção, Determinação de massa adsorvida de HAc em carvão ativado e construção da Isoterma. MATERIAIS 5) Erlenmeyer 6) Bureta 7) Pipeta 8) Funil, filtro e plástico de vedação. 1) Ácido acético 2) Hidróxido de sódio 3) Fenolftaleína 4) Carvão ativado Procedimento prático 1. Soluções NaOH (500 mL) – 1 balão por bancada) Deverão ser preparadas 2 soluções estoques de hidróxido de sódio (NaOH), sendo uma de 0,3 molar e outra de 0,03 molar. O volume final das 2 soluções é de 500mL. A primeira etapa é a preparação das soluções 0,3 molar e, a partir desta, preparar a solução 0,03 molar Balão 1 de NaOH 0,3M: Pese 6 g de NaOH (ver cálculo abaixo) e dissolva em um béquer e transfira quantitativamente para um balão volumétrico de 500mL. Complete até o menisco e homogeneíze. Balão 2 de NaOH 0,03M: Retire 50 mL da solução preparada acima e transfira para um segundo balão de 500mL. Complete até o menisco e homogeneíze. Estocar as duas soluções em frascos de plásticos e etiquetá-los. Deixar espaço na etiqueta para colocar a concentração que será determinada por padronização. Cálculo para preparação do balão 1 de NaOH 0,3M m , MM rearranjando, fica: m = n.MM , logo: m = M .V .MM . M = n , rearranjando, fica: n = V M .V e n= Para M = 0,03 mol.L-1, V = 0,5 L e MMNaOH = 39,99g.mol-1, temos: m = 0,3mol.L−1 .0,5 L.39,99 g .mol −1 = 5,9985 g de NaOH Como o NaOH em pastilhas absorve água e carbonata facilmente, pesar ligeiro excesso (6 g). Cálculo para preparação do balão 1 de NaOH 0,03M M 1.V1 = M 2 .V2 e V1 = M 2 .V2 . Assim: para a diluição de uma solução 0,3 molar que resulte em M1 500 mL de uma solução 0,03 molar, são necessários: 0,03mol.L−1.500mL V1 = = 50mL 0,3mol.L−1 1 2. Padronização das soluções de NaOH com Biftalato de Potássio (C8H5KO4). O biftalato de potássio (MM = 204,23 g.mol-1) tem dois grupos carboxílicos, mas um deles já está neutralizado (sal de potássio). O outro grupo carboxílico pode ser neutralizado com NaOH. Como este sal é solúvel, estável quimicamente e não absorve muita água do ambiente, ele é utilizado como padrão primário, pois há confiança na massa pesada em balança analítica. Cálculo para padronização das soluções de NaOH Na titulação, temos no ponto de viragem do indicador fenolftaleína (passa de incolor para rosa) que o número de mols do biftalato de potássio (Kbft) é igual ao de NaOH (nKbft = nNaOH), logo: mKbft MM Kbft = M NaOH .VNaOH , já que: nKbft = rearranjando, fica: mKbft MM Kbft e nNaOH = M NaOH .VNaOH mKbft = M NaOH .VNaOH .MM Kbft Para titular uma solução de NaOH 0,3 mol.L-1, utilizando aproximadamente 25 mL de solução NaOH, necessitaríamos então de: m Kbft = M NaOH .V NaOH .MM Kbft = 0,3mol .L−1 .0,025 L.204,23 g .mol −1 = 1,5317 g de Kbft Para titular uma solução de NaOH 0,03 mol.L-1, utilizando aproximadamente 25 mL de solução NaOH, necessitaríamos então de 10 vezes menos, já que a solução é 10 vezes mais diluída: m Kbft = M NaOH .V NaOH .MM Kbft = 0,03mol .L−1 .0,025 L.204,23 g .mol −1 = 0,1532 g de Kbft Procedimento para titulação. O biftalato de potássio deve estar seco e em temperatura ambiente. Seque previamente em estufa a 110°C por 2 horas. Retire e esfrie em dessecador. 1. Homogeneíze uma bureta com solução NaOH a ser padronizada. 2. Pese a massa de bfitalato calculada (não é necessário exatidão, e sim precisão) anote a massa precisamente pesada, podendo ser ligeiramente diferente da calculada exatamente. 3. Coloque esta massa em um erlenmeyer e dissolva com 20 mL de água destilada. 4. Adicione a fenolftaleína no erlenmeyer, proceda a titulação em duplicata e anote os volumes. Agora a incógnita é a molaridade da solução de NaOH, pois é ela que queremos aferir. Logo: M NaOH = m Kbft MM Kbft .V NaOH Anote a molaridade obtida (solução padronizada) no frasco. Esta solução será utilizada para titular as soluções de ácido acético no experimento de adsorção. 2 3. Preparação das soluções de HAc. O ácido acético glacial (HAcG) é um líquido puro de densidade 1,049 g.mL e MM = 60,05 g.mol-1. Para isso arranjamos a fórmula de densidade como abaixo: DHAcG = mHAcG VHAcG para mHAcG = DHAcG .VHAcG Queremos uma solução 1 molar de HAc, e como é um líquido, mediremos seu volume, então: nHAcG mHAcG n = m = DHAcG .VHAcG , temos então: HAcG M HAc , mas MM HAcG e HAcG DHAcG .VHAcG = MM HAcG .M HAc Isolando o termo VHAcG, que é o quanto necessitamos retirar VHAc = VHAc do frasco original para preparar a solução, temos: VHAcG = VHAcG MM HAcG .M HAc .VHAc , para 100 mL desta solução 1 molar, temos: DHAcG 60,05 g.mol −1.1mol.L−1.0,1L = = 5,7 mL 1,049.103 g.L−1 Com uma pipeta graduada de 10 mL retire 5,7 mL de ácido acético e coloque em um balão volumétrico de 100mL. Complete até o menisco e homogeneíze. Faça isso na capela. 4. Titule 10 mL da solução original de HAc 1 molar com NaOH padronizado. E proceda com as divisões numéricas para calcular cada concentração que estará em cada béquer com carvão ativado. Anote os valores na coluna M1 da tabela 2. Experimento 1. Pese ~1 g (precisamente) de carvão ativado em um pequeno béquer de 100 mL limpo e seco. Faça isso para 5 béqueres diferentes. Enumere da seguinte forma: 1M, M/3, M/6, M/12 e M/24. 2. Adicione volumes de HAc 1 molar e de água em béqueres separados (utilize uma única pipeta volumétrica de 5 mL). ATENCÃO: não coloque as soluções nos béqueres M/12 e M/24 com carvão ativado ainda, pois o volume é muito grande. Faça num béquer separado e transfira 3 pipetas volumétricas de 10mL para o béquer com carvão posteriormente. Todos os béqueres devem ficar com 30 mL de solução durante a adsorção, conforme tabela 1 abaixo. Béquer 1M M/3 M/6 M/12 M/24 mCA (massa de carvão ativado) (g) V HAc 1M (mL) V H2O (mL) Pipetas volumétricas para a água 30 10 5 5 5 20 25 55 115 2 de 10 mL 1 de 5 mL e 2 de 10 mL 1 de 5 mL e 2 de 25 mL 3 de 5 mL e 4 de 25 mL M HAc (mol.L-1) 3 3. Movimente os béqueres com cuidado para homogeneizar a suspensão. Vede com Parafilm® cada um deles e guarde por uma semana. 4. Semana seguinte, filtrar cada béquer utilizando funil de vidro limpo e seco, colocando um miúdo chumaço de algodão na porção inicial interna do funil e aperte ligeiramente com uma bagueta de vidro. Do filtrado, retirar 10 mL da solução de HAc e titular com NaOH padronizado. Faça em duplicata. Se os dois valores exceder a diferença de 0,3 mL, fazer a terceira titulação. Anote os volumes de NaOH lidos na vureta na coluna V NaOH da tabela 2. Calcule a molaridade de HAc após a adsorção e anote os valores na coluna M2 da Tabela 2. Calcule a diferença de mols de HAc para determinar a quantidade de HAc adsorvida pelo carvão ativado e anote os valores na coluna ∆n da Tabela 2. Construa a seguinte tabela 2. Béquer Solução NaOH utilizada 1M M/3 M/6 M/12 M/24 0,3M 0,3M 0,03M 0,03M 0,03M M1 HAc (antes da adsorção) (mol.L-1) V NaOH (na titulação) (mol.L-1) M2 HAc (após a adsorção) (mol.L-1) ∆n (mols de HAc adsorvido) Cálculos: Molaridade das soluções de ácido acético antes e depois da adsorção M HAc = M NaOH .VNaOH VHAc Mols de ácido acético adsorvido Temos que: nHAc = M HAc .VHAc e então, o número de mols adsorvido é a diferença de mols antes e depois da adsorção, dada por: ∆n = n1 HAc − n 2 HAc e então: ∆n = M 1 HAc .VHAc − M 2 HAc .VHAc Como o volume de solução na se alterou durante o processo, já que o volume de 30 mL ficou fechado no béquer durante a adsorção, ele não muda. Rearranjando, temos: ∆n = ( M 1 HAc − M 2 HAc ).VHAc e e ∆n = ( M 1 HAc − M 2 HAc ).mol.L−1.0,03L ∆n = 0,03( M 1 HAc − M 2 HAc ).mol 4 Fundamentos O fenômeno da adsorção se dá quando substâncias fluidas têm afinidade para aderir à superfície de sólidos. Pode ocorrer adsorção também, mesmo quando não há esta afinidade, quando o sólido é microporoso ou mesoporoso, ou seja, apresenta poros de reduzido tamanho (microporos: φ < 10nm e mesoporos: 10 nm < φ < 500 nm), pois a energia de superfície neste tipo de poros torna energeticamente favorável a adsorção. Por este processo, os gases, líquidos e sólidos, mesmo em concentrações muito pequenas, podem ser seletivamente capturados ou removidos de uma corrente de ar ou um efluente líquido, por meio de materiais específicos, conhecidos como adsorventes. Para adsorventes sólidos, a adsorção pode ser de duas naturezas: física (fisiossorção) ou química (quimissorção). Enquanto a adsorção física se dá de forma não específica, rápida e reversivelmente, envolvendo forças de Van der Walls ou forças de valência secundária entre o adsorvente e a espécie a ser adsorvida (adorvato), pois estão geralmente associadas a baixas entalpias de adsorção (< 10 kJ.mol-1), e resultando em uma adsorção de múltiplas camadas (policamadas), a adsorção química ocorre por interações químicas com transferências de elétrons entre o adsorvente e o adsorbato. As espécies adsorvidas são ligadas por forças de valência (as mesmas de uma ligação química) e estão associadas entalpias de adsorção 20 vezes maiores (> 200 kJ.mol-1). Ocorre de forma específica e mais lenta, resultando numa adsorção em monocamada. Na Figura 1 são representadas as energias envolvidas nos processos de adsorção física e química. A curva P (Physic) representa a energia de adsorção física entre um metal M e X2, como por exemplo, moléculas de gás hidrogênio (H2) se adsorvendo sobre platina (Pt), similar ao que ocorre no EPH (Eletrodo Padrão de Hidrogênio). Para longas distâncias não há nenhuma atração, mas à medida que a distância se encurta, a energia potencial se torna negativa (processo exotérmico e espontâneo), significando que a atração é favorável. São as forças dispersas de London e de van der Waals que estão atuando. Ao encurtar ainda mais a distância, então o potencial tende a aumentar devido à repulsão de Born oriunda da superposição das nuvens eletrônicas dos átomos de platina e hidrogênio. Se a molécula apresenta dipolo (ex: NO, HCl, CO, etc) então haverá a contribuição atrativa de van der Waals pelo lado positivo da molécula, abrandando um pouco a repulsão das nuvens eletrônicas. A altura do mínimo na parte negativa do potencial é proporcional ao calor de adsorção física, como mostrado na figura. 5 A curva C (Chemistry) representa a adsorção química, na qual o adsorvato X2 sofre dissociação a 2X sobre a superfície do metal. No caso do EPH as moléculas de H2 se convertem a 2H sobre o eletrodo de platina (anodo) e então os átomos de hidrogênio se oxidam a H+. Sendo ou não sendo o metal um eletrodo, o processo de dissociação é concomitante com o processo de adsorção física, como nos parece óbvio, pois não há como se dissociar na superfície sem antes chegar a esta superfície, o que se dá por adsorção física. Por isso, a dissociação começa na mesma distância em que a curva P entra no patamar negativo. A altura do mínimo na parte negativa do potencial é proporcional ao calor de adsorção química, similar ao da adsorção física, como mostrado na figura. Observe que a proporção de calores de adsorção física e química é coerente com os calores apresentados no segundo parágrafo deste texto, apesar de a figura não ser fidedigna em escala. O cruzamento das duas curvas (P e C) mostra a energia de ativação para a adsorção química, ou seja, a distância mínima em que os átomos devem chegar para que o processo de ligação química se principie. A aproximação cessa abruptamente e qualquer aproximação física maior que esta, envolverá um alto gasto energético, o que não é favorável. Ao mesmo tempo, o processo de ligação química se acentua, promovendo a interpenetração das nuvens eletrônicas, similar à formação de uma ligação covalente. O mínimo desta curva é atingido quando a distância estável para a ligação química for atingida. A partir deste ponto a repulsão se torna extrema e os átomos ficam estacionados a esta distância representada pelo mínimo de energia. No caso de não haver adsorção química, os átomos ou moléculas estacionam na distância representada pelo mínimo da adsorção física. Figura 1. Seqüência de imagens mostrando a porosidade do carvão ativado. 6 O carvão ativado é um adsorvente largamente utilizado para remoção de moléculas orgânicas tanto de gases como de líquidos. Os odores originados dos alimentos em uma geladeira são compostos orgânicos suspensos em ar, enquanto que o gosto desagradável da água advém de compostos orgânicos dissolvidos em água. Em ambos os casos, o carvão ativado é o mais indicado e comercialmente utilizado para remoção destas substâncias. O carvão ativado exibe uma porosidade 100 vezes maior que o carvão comum, devido à "limpeza" que o material sofre na ativação. Esta limpeza consiste em remover as substâncias contidas nos poros obstruídos do carvão comum levando o carvão previamente pulverizado a fornos ativadores a uma temperatura aproximada de 800 ºC em atmosfera redutora (H2 diluído em N2). Isso cria ligações abertas nos poros (sítios ativos) favoráveis à adsorção química. Observe a seqüência de figuras abaixo e a viagem por microscopia ao interior dos poros de um carvão ativado. Foto 2 Foto 3 Uma partícula de CA. Foto 2 ampliada. Foto 1 Microscópio óptico (Aumento: 25 vezes) Foto 4 Microscópio óptico (Aumento: 100 vezes) Foto 5 Foto 3 ampliada. Foto 4 ampliada. Carvão ativado (CA). Visão a olho nu. Microscópio eletrônico (Aumento: 5.000 veses) Figura 2. Seqüência de imagens mostrando a porosidade do carvão ativado. Microscópio eletrônico (Aumento: 20.000 vezes) 7 Uma curva de quantidade adsorvida (x) à temperatura constante é conhecida como isoterma de adsorção. Esta pode ser construída em função da concentração comum ou molaridade da solução quando o meio for líquido ou em função da pressão relativa (P/P0) quando o adsorvato for um gás. P0 é a pressão de saturação, que ocorre quando a pressão é suficiente para fazer com que o gás se condense no sólido. Bons equipamentos conseguem gerar uma pressão reduzida da ordem de um milionésimo da pressão atmosférica (1 a 2 µmHg), já que o vácuo absoluto é um nível de pressão inatingível na prática. A quantidade de substância adsorvida na superfície decresce com o aumento da temperatura, já que todos os processos de adsorção são exotérmicos. A uma temperatura constante, a quantidade adsorvida aumenta com a concentração do adsorbato (em solução ou na fase gasosa). No caso de fase gasosa é comum utilizar gás nitrogênio a 77 K para os experimentos. Somente a concentrações muito baixas é que x é proporcional à pressão ou a concentração, e a curva apresenta um segmento de reta. Geralmente, a quantidade adsorvida aumenta menos do que proporcionalmente à concentração, devido à saturação gradual da superfície. A Figura 3 mostra duas isotermas típicas, uma em solução e outra em fase gasosa. Na Figura 3.a é mostrado o perfil clássico da dependência da adsorção em função da concentração de adsorvato inicial e em função da temperatura. Pode-se notar também a tendência a um valor constante, caracterizado pela saturação da superfície do sólido. Na Figura 3.b é mostrado o perfil clássico da dependência da adsorção em função da pressão relativa de adsorvato (nitrogênio a 77K) para dois sólidos distintos. Pode-se notar também a tendência hiperbólica em pressões relativas próximas a 1, devido a condensação do gás na superfície do sólido. a) b) Figura 3. Isotermas de adsorção em um sólido, onde o adsorvato está na fase: a) líquida e b)gasosa. 8 O modelo teórico de Langmuir foi proposto para descrever a adsorção de gases em sólidos, adsorção química. Esse modelo supõe que a superfície do sólido é coberta por um grande número de sítios, sendo que cada sítio pode ser ocupado por uma molécula adsorvida. Os sítios são todos equivalentes e considera-se que as moléculas adsorvidas não interagem umas com as outras nem saltam de um sítio para outro. Além disso, a adsorção completa-se quando todos os sítios forem ocupados, correspondendo a uma monocamada de adsorvato, apesar de que as moléculas de adsorvato podem se desorver a adsorver em outro sítio, em um processo dinâmico de equilíbrio entre adsorção e desorção. Supondo uma determinada quantidade de sítios para adsorção como 100% ou dada pela fração 1 e θ a fração de sítios efetivamente ocupados, temos que os sítios disponíveis será dado por: (1- θ). Como é um equilíbrio dinâmico, esta relação é função das velocidades de adsorção e desorção. Com base nos conceitos genéricos de cinética, descrevemos a velocidade de adsorção e desroção, respectivamente, como: VA = k A .C .(1 − θ ) (velocidade de adsorção). Esta expressão significa que a lei de velocidade é de segunda ordem, pois depende da concentração da solução e da fração de sítios disponíveis. Ambos os valores são proporcionais a velocidade de adsorção, ou seja, quanto maior a concentração da solução mais rápida a adsorção, o mesmo valendo para os sítios desocupados. VD = k D .θ (velocidade de desorção). Esta expressão diz que a lei de velocidade é de primeira ordem pois depende somente da quantidade de sítios ocupados, ou seja, quantos maior a fração de sítios ocupados, maior a velocidade com que ocorre a desorção. Os dois processos entram em equilíbrio quando VA for igual a VD, ou seja: k A .C.(1 − θ ) = k D .θ Rearranjando e assumindo Keq = kA/kD, temos: kA θ = k D C.(1 − θ ) e K eq = θ C .(1 − θ ) . Rearranjando novamente, temos: C.(1 − θ ).K eq = θ e (C − θ .C ).K eq = θ e K eq .C − K eq .θ .C = θ 9 Isolando θ, temos: K eq .C = θ + K eq .θ .C e K eq .C = θ (1 + K eq .C ) A equação que Langmuir propôs é exatamente esta: K eq .C e 1 + K eq .C θ= =θ K eq .C 1 + K eq .C , mas a equação linearizada deve seguir a equação correspondente dada pela expressão genérica abaixo: C 1 1 = + .C , 1 / m a.b a onde C é a concentração de adsorvato, m é a massa de adsorvente e a e b são duas constantes, sendo a uma constante relacionada a área do sólido e que dará a informação da área superficial, porque está relacionada a cobertura completa da superfície pela monocamada e o valor de b é relacionado a entalpia de adsorção, que se correlaciona com a constante de equilíbrio Keq, pois incorpora a afinidade entre adsorvato e adsorvente. Em casos de sistemas em que a adsorção ocorre com a formação de policamadas, o modelo mais adequado é descrito pela isoterma de Freundlich, a qual corresponde a expressão abaixo (equação 2): χ m = k .C 1 n , onde 1/n é relacionado com a proporção adsorvida e é adimensional e k está relacionado com a capacidade adsortiva mediante o movimento entre as fases liquida e sólida. 1 χ = log k + log C . n m Linearizando a expressão acima, fica: log Anestésicos locais agem por adsorção e seguem as isotermas de Freundlich. O tamanho e a estrutura da molécula do anestésico influencia na intensidade de adsorção e valores de k mais altos dão noção da rapidez com que o anestésico age ou sua duração, enquanto que o valor de 1/n dá a noção da quantidade necessária para produzir o efeito anestésico local. Para o modelo de Langmuir (adsorção em monocamadas) podemos compreender melhor esta relação através Bibliografia: Pesquise na Biblioteca e na internet as referências que embasam este experimento. 10 Tratamento de Dados Partindo da equação que Langmuir dada anteriormente: θ= K eq .C 1 + K eq .C e lembrando que a adsorção cessará quando a razão entre as frações de sítios ocupados e desocupados for constate, temos: θ= χ /m (χ / m )mon , pois o valor de χ / m significa o total adsorvido após o equilíbrio, que pode ser menor que o máximo possível, pois depende da concentração da solução. O valor máximo possível é constituído pela quantidade igualada a monocamada completa, dada pelo valor de (χ / m )mon , ou seja, não será mais possível ocorrer a adsorção quando toda a superfície disponível do sólido já estiver coberta, e esta quantidade é dada pela monocamada. A razão entre estes dois valores dá a fração de fato ocupada. Se o valor de χ / m for máximo, ou seja, igual ao valor de (χ / m )mon , então θ = 1 e todos os sítios possíveis estariam ocupados. Para inserirmos estes termos na equação geral linearizada de Langmuir, procedemos com uma seqüência de rearranjos matemáticos necessários para adequação da expressão. Observe que são apenas rearranjos matemáticos simples, como mudança de membro, distributiva e outras de similar simplicidade. Aplicamos primeiro o inverso nos dois membros e simplificamos a seguir, como segue: 1 θ = 1 + K eq .C K eq .C e 1 θ = 1 K eq .C + K eq .C 1 e K eq .C θ = 1 K eq .C +1 Em seguida, multiplicamos os dois membros pela concentração C e simplificamos a seguir, como segue: 1 = C. + 1 e K .C θ eq C C θ = C +C K eq .C e C θ = 1 +C K eq Finalmente, substituímos θ pela razão similar dada acima, ou seja, θ = χ /m (χ / m )mon , rearranjamos e transferimos (χ / m )mon para o segundo membro da expressão, como segue: C 1 1 C 1 (χ / m )mon .C = 1 + C = + .C = +C e e χ /m K eq χ / m K eq .(χ / m )mon (χ / m )mon χ /m K eq (χ / m )mon 11 Observe que a última equação dada acima segue uma equação de reta (y = a + bx), então: y= 1 1 C a = b = K eq .(χ / m )mon ; (χ / m )mon χ /m ; Assim, devemos construir um gráfico com valores de a será o valor de e; C em y e de χ /m x=C C em x, pois o coeficiente linear 1 1 e o coeficiente angular b será o valor de K eq .(χ / m )mon (χ / m )mon . Na tabela 1 do procedimento experimental encontram-se os valores efetivamente pesados de massa de carvão ativado e a concentração molar de HAc e na tabela 2 encontram-se os valores de ∆n (mols de HAc adsorvido). Reproduza estes valores na tabela 3 abaixo e calcule os valores que comporão os eixos x e y para construção da isoterma de adsorção. Os valores de M1 HAc (antes da adsorção) contidos na tabela 2 serão transpostos para a tabela 3 como C (mol.L-1) e comporão os dados do eixo x do gráfico. Os valores de mCA contidos na tabela 2 são transpostos como tais e os valores de ∆n (mols de HAc adsorvido), deverão ser transpostos para a tabela 3 como nHAc (mol). Com estes valores de mCA e nHAc, calcule os valores de χ / m e, em seguida, juntando-se aos dados de C, calcule os valores de C , χ /m colocando ambos na tabela 3. Tabela 3. Dados para a isoterma de adsorção. eixo x Béquer C (mol.L-1) eixo y mCA (g) nHAc (mol) χ / m (nHAc/mCA) (mol/g) C χ /m (mol.L-1.mol-1.g) 1M M/3 M/6 M/12 M/24 Não misture os mols na equação do eixo y, pois um mol é o disponível e o outro é o efetivamente adsorvido. C 1 1 (eixo y) = + .C (eixo x) χ /m K eq .(χ / m )mon (χ / m )mon Utilize o programa Origin para construção do gráfico. Siga tutorial para saber como proceder. 12
Download