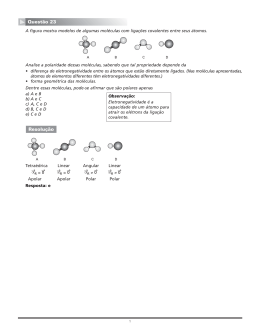
PROFESSOR: EQUIPE DE QUÍMICA BANCO DE QUESTÕES – QUÍMICA INORGÂNICA – 1ª SÉRIE - ENSINO MÉDIO - PARTE 3 ============================================================================================= Ligações Covalentes Questões Objetivas 01- Analise a posição de alguns elementos na Classificação Periódica (Tabela A) e as suas tendências em formarem ligações químicas (Tabela B), como especificado adiante: A única opção que relaciona corretamente o elemento químico e sua característica, quando ocorre a possível ligação, é: (A) 1D; 2A; 3C; 4F. (C) 1D; 2F; 3E; 4C. (E) 1D; 2F; 3A; 4C. (B) 1D; 2B; 3A; 4F. (D) 1D; 2B; 3A; 4E. 02- O NaClO (hipoclorito de sódio) é um sal vendido comercialmente em solução aquosa com os nomes de água sanitária e água de lavadeira, possuindo efeito bactericida e alvejante. No hipoclorito de sódio, o CLORO estabelece: (A) (B) (C) (D) (E) uma ligação iônica e uma ligação covalente normal. somente uma ligação iônica. somente uma ligação covalente dativa. uma ligação covalente normal e uma ligação covalente dativa. somente uma ligação covalente normal. 03- Leia atentamente os seguintes itens: I. HCl, HI, O2 II. CH4, NH3, SiF4 III. H2O, CO2, BF3 IV. N2, I2, SO2 V. CS2, CO, CH4 As substâncias mais polares, em cada item indicado, são: (A) HI, NH3, CO2, SO2, CH4. (C) HCl, NH3, H2O, SO2, CO. (E) HI, CH4, H2O, I2, CS2. (B) HCl, SiF4, BF3, I2,CO. (D) O2, SiF4, H2O, N2, CS2. 04- Um elemento de grande importância do subgrupo 5 A é o fósforo, que ocorre na natureza, principalmente nos minérios da APATITA. Como não é encontrado isolado, costuma ser obtido industrialmente através da redução da rocha fosfática, mediante carvão e areia num forno elétrico. 2 Ca 3(PO4)2 + 6 SiO2 + 10 C P4 + 6 CaSiO3 + 10 CO A partir da variedade alotrópica obtida do fósforo, um grande número de compostos pode ser produzido, como no caso do anidrido fosfórico, segundo a reação abaixo: P4 + 5 O2 2 P2O5 O P2O5 pode reagir com uma, duas e três moléculas de água de acordo com as seguintes reações: P2O5 + 2 H2O H4P2O7 Página 1 de 9 - 10/07/2012 - 11:21 P2O5 + H2O 2 HPO3 P2O5 + 3 H2O 2H3PO4 Com base nos ácidos obtidos, é correto afirmar que a molécula de: (A) (B) (C) (D) (E) HPO3 apresenta 4 ligações covalentes simples e 1 ligação covalente dativa. HPO3 apresenta 3 ligações covalentes simples e 1 ligação covalente dativa. H3PO4 apresenta 3 ligações covalentes simples e 1 ligação covalente dativa. H4P2O7 apresenta 6 ligações covalentes simples e 2 ligações covalentes dativas. H4P2O7 apresenta 10 ligações covalentes simples e 4 ligações covalentes dativas. 05- Relativamente à fórmula estrutural abaixo, é correto afirmar que: (A) (B) (C) (D) (E) existem somente ligações covalentes normais. o oxigênio cede dois elétrons para o cálcio. o enxofre recebe dois elétrons do cálcio. o cálcio, no estado fundamental, apresenta seis elétrons na camada de valência. existem duas ligações iônicas, duas ligações covalentes normais e duas ligações dativas (ou covalentes coordenadas). 06- Assinale a alternativa que apresenta APENAS moléculas contendo geometria piramidal: (A) BF3 – SO3 – CH4 (C) NCl3 – CF2Cl2 – BF3 (E) PH3 – NCl3 – PHCl2 (B) SO3 – PH3 – CHCl3 (D) POCl3 – NH3 – CH4 07"O SiO2 é um sólido de ponto de fusão muito elevado (PF = 1.700°C) e o CO2 é um gás nas condições ambiente. Ambos são polares, mas a grande diferença de pontos de ebulição não se justifica pela diferença de massa molar. Justifica-se, portanto, que o retículo cristalino de SiO2 é _________e o do CO2 é ____________". As lacunas ficam CORRETAMENTE preenchidas, respectivamente com: (A) iônico - molecular. (C) molecular - covalente. (E) covalente - molecular. (B) molecular - iônico. (D) iônico - covalente. 08- Considerando os seguintes haletos de hidrogênio HF, HCl, e HBr, pode-se afirmar que: (A) (B) (C) (D) (E) a molécula mais polar é HF. a molécula mais polar é HCl. todos os três são compostos iônicos. somente HF é iônico, pois o flúor é muito eletronegativo. somente HBr é covalente, pois o Bromo é um átomo muito grande para formar ligações iônicas. 09- Moléculas polares são responsáveis pela absorção de energia de micro-ondas. Assinale abaixo a substância que mais provavelmente absorverá nesta região. (A) BeCl2 (C) CCl4 (E) BF3 (B) H2O (D) CO2 10- O óxido nítrico, NO, é normalmente veiculado pela mídia como um indesejável poluente do meio ambiente. Sabe-se, entretanto, que esta substância é, também, essencial nas atividades digestivas, na regulação da pressão sanguínea e na defesa bacterial, ocorrendo naturalmente em diversos tipos de células do corpo humano. Com relação às ligações químicas presentes na molécula do óxido nítrico, é correto afirmar que: (A) (B) (C) (D) (E) são predominantemente iônicas, resultando em uma espécie química apolar. são covalentes apolares, e a molécula do NO é polar. satisfazem à regra do octeto, e o número de oxidação do nitrogênio é +2. são covalentes polares, e a molécula do NO possui momento de dipolo (µ≠0). são covalentes apolares, e a molécula do NO apresenta forte caráter iônico. Página 2 de 9 - 10/07/2012 - 11:21 11- Assinale a alternativa que caracteriza, respectivamente, a polaridade das substâncias dióxido de carbono, metano e tetrafluormeto. (A) APOLAR - APOLAR - APOLAR. (C) POLAR - APOLAR - POLAR. (E) APOLAR - POLAR - POLAR. (B) APOLAR - APOLAR - POLAR. (D) POLAR - POLAR - POLAR. 12- As ligas metálicas são formadas pela união de dois ou mais metais, ou ainda, por uma união entre metais, ametais e semi-metais. Relacionando, no quadro a seguir, cada tipo de liga com as composições dadas pode-se afirmar que a única correlação correta entre liga e composição encontra-se na opção: (A) I b; II c; III a; IV d. (C) I a; II b; III c; IV d. (E) I d; II a; IIl c; IV b. (B) I c; II b; III d; IV a. (D) I c; Il d; lll b; IV a. 13- Sejam dadas as seguintes moléculas: H2O, BeH2, BCl3 e CCl4. As configurações espaciais dessas moléculas são, respectivamente: (A) angular, linear, trigonal, tetraédrica. (C) angular, linear, piramidal, tetraédrica. (B) angular, trigonal, linear, tetraédrica. (D) trigonal, linear, angular, tetraédrica. 14- A capacidade que um átomo tem de atrair elétrons de outro átomo, quando os dois formam uma ligação química, é denominada eletronegatividade. Esta é uma das propriedades químicas consideradas no estudo da polaridade das ligações. Assinale a opção que apresenta, corretamente, os compostos H2O, H2S e H2Se em ordem crescente de polaridade. (A) H2Se < H2O < H2S. (C) H2S < H2O < H2Se. (E) H2Se < H2S < H2O. (B) H2S < H2Se < H2O. (D) H2O < H2Se < H2S. 15- Para o estudo das relações entre o tipo de ligação química e as propriedades físicas das substâncias X e Y, sólidas à temperatura ambiente, foi realizado um experimento que permitiu as seguintes constatações: I. A substância X, no estado sólido, não conduz a corrente elétrica, porém, no estado líquido, a conduz. II. A substância Y não conduz a corrente elétrica no estado sólido nem no estado líquido. Pode-se, então, concluir que: (A) As substâncias X e Y são covalentes. (C) A substância X é iônica e a substância Y é covalente. (E) A substância Y é um metal. (B) As substâncias X e Y são iônicas. (D) A substância X é um metal. 16- Nesse experimento, o sulfeto de zinco era o material que cintilava quando recebia o choque das partículas alfa. Outra substância que apresenta excelentes características para detecção de tais partículas, utilizando ainda material cintilante, possui ligação interatômica de caráter predominantemente iônico e é formada por um metal representativo e um ametal. A fórmula dessa outra substância é: (A) BaF2. (C) SiO2. (B) BeI2. (D) FeCl2. 17- O dióxido de carbono (CO2) é um gás essencial no globo terrestre. Sem a presença deste gás, o globo seria gelado e vazio. Porém, quando este é inalado em concentração superior a 10 %, pode levar o indivíduo à morte por asfixia. Este gás apresenta em sua molécula um número de ligações covalentes igual a: (A) 4. (C) 2. (E) 0. Página 3 de 9 - 10/07/2012 - 11:21 (B) 1. (D) 3. 18- No composto P2O5, nas ligações P-O, o número de ligações covalentes dativas é: (A) 1. (C) 3. (E) 5. (B) 2. (D) 4. 19- Escolha, entre as substâncias abaixo, aquela que tem as seguintes propriedades: não conduz a corrente elétrica no estado sólido, mas conduz em solução e é solúvel em solventes polares. (A) NaCl. (C) HCl. (E) H2. (B) Na. (D) Cl2. 20- Nos motores de combustão interna, o sulfeto de hidrogênio, presente em combustíveis, é convertido no poluente atmosférico óxido de enxofre IV, como mostra sua equação de combustão abaixo. H2S(G) + 3/2O2 (G) → SO2 (G) + H2O(L) O sulfeto de hidrogênio é extraído dos combustíveis por um solvente que possui baixa polaridade molecular e natureza ácido-básica oposta à sua. As fórmulas eletrônicas do sulfeto de hidrogênio e do óxido de enxofre IV estão, respectivamente, representadas em: 21- O leite materno é um alimento rico em substâncias orgânicas, tais como proteínas, gorduras e açúcares, e substâncias minerais como, por exemplo, o fosfato de cálcio. Esses compostos orgânicos têm como característica principal as ligações covalentes na formação de suas moléculas, enquanto o mineral apresenta também ligação iônica. Assinale a alternativa que apresenta corretamente os conceitos de ligações covalente e iônica, respectivamente. (A) A ligação covalente só ocorre nos compostos orgânicos. (B) A ligação covalente se faz por transferência de elétrons e a ligação iônica pelo compartilhamento de elétrons com spins opostos. (C) A ligação covalente se faz por atração de cargas entre átomos e a ligação iônica por separação de cargas. (D) A ligação covalente se faz por união de átomos em moléculas e a ligação iônica por união de átomos em complexos químicos. (E) A ligação covalente se faz pelo compartilhamento de elétrons e a ligação iônica por transferência de elétrons. 22- Algumas substâncias sólidas são caracterizadas pela repetição organizada de estruturas individuais, constituindo sólidos com formas geométricas definidas – os cristais. Por exemplo, o cloreto de sódio e a sacarose formam cristais cúbicos e hexagonais, respectivamente. A imagem a seguir mostra três sólidos cujas formas são cúbicas. Em (1), (2) e (3) estão representados, respectivamente, cristais de iodo, brometo de potássio e ferro. Sobre as estruturas (1), (2) e (3), é correto afirmar: (A) (B) (C) (D) (E) A molécula individual do cristal (1) apresenta átomos unidos por ligação covalente polar. O cristal (2) é formado por um número de prótons maior do que o número de elétrons. A substância representada em (3) é boa condutora de eletricidade no estado sólido e no líquido. A substância representada em (1) é boa condutora de eletricidade no estado líquido. A substância representada em (2) é boa condutora de eletricidade no estado sólido. Página 4 de 9 - 10/07/2012 - 11:21 23- De acordo com a Teoria da repulsão dos pares eletrônicos da camada de valência, os pares de elétrons em torno de um átomo central se repelem e se orientam para o maior afastamento angular possível. Considere que os pares de elétrons em torno do átomo central podem ser uma ligação covalente (simples, dupla ou tripla) ou simplesmente um par de elétrons livres (sem ligação). Com base nessa teoria, é correto afirmar que a geometria molecular do dióxido de carbono é: (A) trigonal plana. (C) angular. (E) tetraédrica. (B) piramidal. (D) linear. 24- O elemento bromo forma compostos iônicos e moleculares. Assinale a alternativa que apresenta, respectivamente, um composto iônico e um molecular formado pelo bromo. (A) CaBr2 e HBr. (C) NaBr e MgBr2. (B) CBr4 e KBr. (D) KBr e NH4Br. 25- Na tabela são dadas as energias de ligação (kJ/mol) a 25 °C para algumas ligações simples, para moléculas diatômicas entre H e os halogênios (X). Analise as afirmações seguintes. I. Dentre os compostos HX, o HF é o ácido mais fraco e a sua ligação H-X é a mais forte. II. A distância de ligação entre os átomos nas moléculas X‚ é maior no I‚, já que a sua energia de ligação é a mais fraca. III. A molécula com maior momento dipolar é o HI. Está CORRETO o contido em: (A) I, II e III. (C) I e III, apenas. (E) II, apenas. (B) I e II, apenas. (D) II e III, apenas. 26- Para os compostos: CH3CH2CH2OH (R – OH), CH3OCH2CH3 (R – O – R') e CH3CH2COOH (R“ – COOH), a ordem crescente de pontos de ebulição é: (A) R – O – R’, R – OH, R“– COOH. (C) R – OH, R – O – R’, R“– COOH. (E) R – O – R’, R“– COOH, R – OH. (B) R“– COOH, R – OH, R – O – R’. (D) R “– COOH, R - O - R’, R – OH. 27- O experimento a seguir mostra o desvio ocorrido em um filete de água quando esta é escoada através de um tubo capilar. Considerando suas ligações interatômicas e suas forças intermoleculares, a propriedade da água que justifica a ocorrência do fenômeno consiste em: (A) ser um composto iônico. (C) ter ligações covalentes apolares. Página 5 de 9 - 10/07/2012 - 11:21 (B) possuir moléculas polares. (D) apresentar interações de Van der Waals. 28- Considere as substâncias representadas a seguir: I. (C2H5) 2O II. C4H9OH III. C2H6 IV. C3H8 Assinale a alternativa que apresenta as substâncias em ordem CRESCENTE de ponto de ebulição: (A) I, II, III, IV. (C) III, IV, II, I. (E) II, I, III, IV. (B) III, IV, I, II. (D) IV, III, I, II. 29- Para demonstrar a relação entre polaridade e solubilidade, um professor realiza um experimento que consiste em adicionar etanol a uma solução aquosa saturada de sal de cozinha e observar a precipitação do sal. Na falta de sal de cozinha, para realizar o mesmo experimento, o professor poderia utilizar a seguinte substância: (A) metano (C) anidrido carbônico (B) tetracloro metano (D) iodeto de potássio 30- A ingestão acidental de tolueno pode levar a manifestações sistêmicas caracterizadas por estímulo do sistema nervoso central, seguido de depressão, tontura e náuseas. A equação abaixo representa um dos processos de biotransformação do tolueno no organismo humano pela ação da enzima citocromo P-450. Assinale a afirmativa INCORRETA: (A) (B) (C) (D) (E) As forças intermoleculares no tolueno são mais fracas que as forças no ácido benzóico. O tolueno e o ácido benzóico apresentam carbonos com hibridização sp2 e sp3. O ácido benzóico apresenta maior temperatura de fusão que o tolueno. O ácido benzóico será mais solúvel em água que o tolueno. As moléculas de ácido benzóico formam ligações de hidrogênio entre si. 31"(...) o Corpo de Bombeiros de José Bonifácio, a 40km de São José do Rio Preto, interior de São Paulo, foi acionado por funcionários do frigorífico Minerva. O motivo foi um vazamento de amônia." (www.globonews.globo.com) A amônia (NH3) é um gás à temperatura ambiente. Nesta temperatura suas moléculas estão pouco agregadas e, no estado líquido, elas estão mais próximas umas das outras. Assinale a opção que indica a interação existente entre suas moléculas no estado líquido. (A) ligação de hidrogênio. (C) dipolo – dipolo induzido. (E) íon – dipolo. (B) dipolo – dipolo. (D) dipolo induzido – dipolo induzido. 32- Este gráfico representa a variação da temperatura de ebulição, a 1 atm, de séries homólogas de alcoóis e alcanos de cadeia linear, em função da massa molar: Considerando-se esse gráfico e os compostos nele representados, é INCORRETO afirmar que: (A) (B) (C) (D) as curvas I e II correspondem, respectivamente, aos alcoóis e aos alcanos. o aumento da cadeia carbônica aumenta a intensidade das interações intermoleculares. a interação por ligações de hidrogênio é a única presente nos alcoóis. a interação entre dipolos induzidos é a única presente nos alcanos. Página 6 de 9 - 10/07/2012 - 11:21 33- O betacaroteno, cuja fórmula estrutural está representada a seguir, é um pigmento presente em alguns vegetais, como cenoura e tomate. Dentre os solventes abaixo, aquele que melhor solubiliza o betacaroteno é: (A) água (C) hexano (B) etanol (D) propanona 34- No esquema a seguir estão representadas, na forma de linhas pontilhadas, determinadas interações intermoleculares entre as bases nitrogenadas presentes na molécula de DNA - timina, adenina, citosina e guanina. As interações representadas entre a timina e a adenina, e entre a citosina e a guanina, são do tipo: (A) iônica. (C) dipolo-dipolo. (B) metálica. (D) ligação de hidrogênio. 35- Em condições ambientes, os alcoóis de menor peso molecular são líquidos, facilitando a sua dissolução na água. Em relação aos alcoóis indicados abaixo, aquele que apresenta a maior solubilidade em água é o: (A) pentanol (C) isobutanol (E) n-butanol (B) octanol (D) metanol 36- Com o intuito de economizar petróleo e estimular a substituição do combustível de origem fóssil por uma fonte renovável, o governo brasileiro determinou a adição de álcool de cana-de-açúcar à gasolina do petróleo. Para testar o teor de álcool, separaram-se 50,0 mL de gasolina vermelha numa proveta de 100,0 mL e adicionaram-se 50,0 mL de água. Após a agitação, com um bastão de vidro, essa mistura foi deixada em repouso por 5 minutos, para a separação das fases. Em seguida, verificou-se que a fase escura foi reduzida em 12,5 mL. Com base nos dados acima, identifique a opção que informa o teor de álcool na gasolina. (A) 12,5% (C) 37,5% (E) 62,5% (B) 25,0% (D) 50,0% 37- O conhecimento das estruturas das moléculas é um assunto bastante relevante, já que as formas das moléculas determinam propriedades das substâncias como odor, sabor, coloração e solubilidade. As figuras apresentam as estruturas das moléculas CO2, H2O, NH3, CH4, H2S e PH3. Quanto às forças intermoleculares, a molécula que forma ligações de hidrogênio (pontes de hidrogênio) com a água é: (A) H2S. (C) NH3. (E) CO2. Página 7 de 9 - 10/07/2012 - 11:21 (B) CH4. (D) PH3. 38- A vitamina C, cuja estrutura é mostrada a seguir, apresenta vários grupos hidrófilos, o que facilita sua dissolução na água. Por esta razão, ao ser ingerida em excesso, é eliminada pelos rins. Considerando suas atrações interatômicas e intermoleculares, esse caráter hidrossolúvel é justificado pelo fato de a vitamina C apresentar uma estrutura composta de: (A) heteroátomos. (C) dipolos permanentes. (B) íons aglomerados. (D) carbonos assimétricos. 39- Pela análise do quadro, conclui-se que a ordem crescente dos pontos de ebulição dos compostos indicados é: (A) I < II < III < IV < V (C) II < V < I < III < IV (E) IV < III < V < I < II (B) II < I < V < III < IV (D) III < IV < I < II < V 40- Observe as seguintes estruturas de quatro vitaminas lipossolúveis: As vitaminas A e D apresentam a função álcool em suas estruturas, a vitamina E apresenta a função fenol, e a vitamina K, a função cetona. Para manutenção das propriedades de coagulação do sangue, é necessária a absorção da vitamina representada pela estrutura de número: (A) I (C) III (B) II (D) IV Gabarito 01- (E) 02- (E) 03- (C) 04- (A) Página 8 de 9 - 10/07/2012 - 11:21 05- (E) 06- (E) 07- (E) 08- (A) 09- (B) 10- (D) 11- (A) 12- (D) 13- (A) 14- (E) 15- (C) 16- (A) 17- (A) 18- (B) 19- (A) 20- (B) 21- (E) 22- (C) 23- (D) 24- (A) 25- (B) 26- (A) 27- (B) 28- (B) 29- (D) 30- (B) 31- (A) 32- (C) 33- (C) 34- (D) 35- (D) 36- (B) 37- (C) 38- (C) 39- (B) 40- (A) FM/1207/BANCO DE QUESTOES/QUIMICA ORGANICA/QUIMICA ORGANCA - 1a SERIE - ENSINO MEDIO - 2a ETAPA - 2012 - PARTE 3 - LIGACOES CONVALENTES.DOC Página 9 de 9 - 10/07/2012 - 11:21
Download