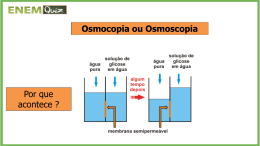
COLÉGIO KENNEDY / REDE PITÁGORAS PLANO DE ESTUDO – TRIMESTRE: 3º PLANO DE ESTUDO Nº 10 DISCIPLINA : Química PROFESSORA: Rose Barbosa ANO/SÉRIE: 3º ANO EM DATA DA AVALIAÇÃO: 14/09/2013 CONTEÚDO(S) A SER(EM) COBRADO(S) NA AVALIAÇÃO: Cinética Química, Soluções e Propriedades Coligativas PÁGINA(S) DO LIVRO DO ALUNO: 90 a 102; 116 a 126 Bom trabalho! Plantão: 13/09/2013 às14h. 1. Um comprimido efervescente de vitamina C intacto, pesando 5 g, quando colocado em um copo contendo água a 25 °C, será dissolvido em dois minutos. Considerando essa informação, analise as situações abaixo: 1) Se o comprimido efervescente estiver em pequenos pedaços, a rapidez da dissolução será maior. 2) O tempo de dissolução do comprimido efervescente intacto será menor quando o comprimido for dissolvido em água a 40 °C. Quais são os fatores que influenciam a rapidez das transformações químicas relacionadas às situações 1 e 2, respectivamente? Explique. ___________________________________________________________________________________________ ___________________________________________________________________________________________ ___________________________________________________________________________________________ ___________________________________________________________________________________________ ___________________________________________________________________________________________ 2. O diagrama abaixo apresenta dois caminhos possíveis para uma reação: Qual curva representa a reação catalisada? Justifique. _________________________________________________________ _________________________________________________________ _________________________________________________________ _________________________________________________________ 3. A velocidade das reações químicas depende de fatores como temperatura, concentração, superfície de contato, presença de catalisador ou inibidor. A reação que ocorre com comprimidos efervescentes, em que há liberação de CO2, é muito usada para ilustrar os efeitos da temperatura e da superfície de contato sobre a velocidade de uma reação. O gráfico abaixo representa a cinética da reação de um comprimido efervescente em três diferentes condições: I. comprimido inteiro e temperatura ambiente; II. comprimido triturado e temperatura ambiente; III. comprimido inteiro e temperatura menor que a ambiente. No gráfico, as curvas A, B e C representam, RESPECTIVAMENTE, quais condições? ____________________________________________________ 1 4. A fabricação industrial do ácido sulfúrico, H2SO4, é realizada a partir de enxofre, oxigênio e água, em 3 etapas, representadas pelo diagrama energético abaixo: Qual é a etapa mais rápida? Por quê? _________________________________________________ _________________________________________________ _________________________________________________ 5. (UEMG) O alumínio é um dos metais que reagem facilmente com íons H+, em solução aquosa, liberando o gás hidrogênio. Três soluções ácidas foram colocadas para reagir com amostras de alumínio, de acordo com as condições apresentadas na tabela abaixo e em temperatura ambiente: Baseando-se na análise dos dados constantes nessa tabela, é CORRETO afirmar que a) a superfície de contato é maior em I. b) a energia cinética média das partículas é maior em II. c) a reação é mais rápida em III. d) a massa da amostra determina a velocidade desta reação. 6. Seja a reação: X → Y + Z. A variação na concentração de X em função do tempo é: Determine a velocidade média de consumo de X no intervalo de 2 a 5 minutos. 7. Com relação à reação: A + 3 B → 2 C + 3 D podemos afirmar que: a) os reagentes (A e B) são consumidos com a mesma velocidade. b) a velocidade de desaparecimento de A é igual à velocidade de aparecimento de C. c) a velocidade de aparecimento de D é três vezes maior que a velocidade de desaparecimento de A. d) os produtos (C e D) são formados com a mesma velocidade. e) a velocidade de desaparecimento de A é o dobro da velocidade de aparecimento de C. 8. O óxido nítrico reage com hidrogênio, produzindo nitrogênio e vapor de água de acordo com a reação: 2 NO (g) + 2 H2 (g) → N2 (g) + 2 H2O (g) Acredita-se que essa reação ocorra em duas etapas: 2 NO + H2 → N2O + H2O (lenta) N2O + H2 → N2 + H2O (rápida) De acordo com esse mecanismo, a expressão da velocidade da reação é: a) v = k [NO]2[H2]. b) v = k [NO][H2]. c) v = k [NO2][H2O]. d) v = k [N2][H2O]. 2 e) v = k [N2][H2O] . 2 9. (CEFET) O estudo cinético, em fase gasosa, à temperatura constante, da reação representada pela equação: 2A(g) + B(g) → C(g) mostrou que a velocidade da reação não depende da concentração de B, mas quadruplica quando a concentração de A é dobrada. Essas observações permitem afirmar que a a) conversão de A em C independe de B. b) expressão da velocidade para a reação é v = K[A]2. c) reação considerada ocorre em apenas uma etapa. d) constante de velocidade K independe da temperatura. e) substância representada por B tem a função de catalisador. 10. (UFLA) Soluções de sulfato de cobre pentahidratado (CuSO4.5H2O) são utilizadas na agricultura para combater fungos parasitas das planatas e fornecer o nutriente cobre aos vegetais por meio de pulverização. Uma solução contendo 10 g desse sal por litro de solução (1% m/V) é utilizada com grande freqüência. A concentração dessa solução em mol/L equivale a (Massa molar do CuSO4.5H2O = 250 g/mol) a) 0,40 b) 4,00 c) 0,04 d) 2,50 e) 1,00 11. Determine o volume de água, que deve ser adicionado a 80 mL de solução aquosa 12 mol/L de hidróxido de sódio, para que a solução resultante seja 1,2 mol/L, deve ser igual a: a) 80 mL. b) 100 mL. c) 800 mL. d) 720 mL. 12. As bebidas fermentadas têm teor alcoólico menor que as destiladas: na cerveja, por exemplo, considera-se 4°GL, aproximadamente. Nas bebidas destiladas, o teor alcoólico é mais elevado; no uísque, por exemplo, há em torno de 45°GL. Suponha que dois amigos resolvam ir a uma boate. Um deles toma cerveja e o outro, uísque. Nessa situação, calcule a quantidade em volume de cerveja que o indivíduo que ingeriu essa bebida precisaria tomar para alcançar a quantidade de álcool presente em 200mL de uísque consumido pelo seu amigo. O volume de cerveja calculado é: Dados: A graduação alcoólica é expressa em °GL e in dica a porcentagem em volume na bebida. a) 90 mL b) 800 mL c) 2250 mL d) 2500 mL e) 2750 mL 13. Considere a tabela abaixo. Nos locais acima citados, foram colocadas batatas para cozinhar em panelas abertas idênticas, contento o mesmo volume de água. É de se esperar que as batatas fiquem cozidas, em menos tempo, a) no Rio de Janeiro, pois a temperatura de ebulição da água é menor do que nos outros locais. b) no Monte Everest, pois quanto maior for a altitude, maior é a temperatura de ebulição da água. c) em São Paulo, pois quanto maior for a poluição atmosférica, menor será a temperatura de ebulição da água. d) na Cidade do México, por estar mais próxima do equador. e) no Rio de Janeiro, pois, ao nível do mar, a água ferve a uma temperatura mais elevada. 3 14. A tabela abaixo mostra a pressão de vapor das substâncias A, B, C e D à mesma temperatura. a) Qual delas é mais volátil? _____________ b) Que substância apresenta interações mais fortes? _____________ c) Qual dessas substâncias possui maior temperatura de ebulição? _______________ 15. (Vunesp) Comparando duas panelas, simultaneamente sobre dois queimadores iguais de um mesmo fogão, observa-se que a pressão dos gases sobre a água fervente na panela de pressão fechada é maior que aquela sobre a água fervente numa panela aberta. Nessa situação, e se elas contêm exatamente as mesmas quantidades de todos os ingredientes, podemos afirmar que, comparando com o que ocorre na panela aberta, o tempo de cozimento na panela de pressão fechada será a) menor, pois a temperatura de ebulição será menor. b) menor, pois a temperatura de ebulição será maior. c) menor, pois a temperatura de ebulição não varia com a pressão. d) igual, pois a temperatura de ebulição independe da pressão. e) maior, pois a pressão será maior. 16. Por que a adição de certos aditivos na água dos radiadores de carros evita que ocorra o superaquecimento da mesma, e também o seu congelamento, quando comparada com a da água pura? a) Porque a água mais o aditivo formam uma solução que apresenta temperaturas de ebulição e de fusão maiores que os da água pura. b) Porque a solução formada (água + aditivo) apresenta pressão de vapor maior que a água pura, o que causa um aumento no ponto de ebulição e de fusão. c) Porque o aditivo reage com a superfície metálica do radiador, que passa então a absorver energia mais eficientemente, diminuindo, portanto, as temperaturas e ebulição e de fusão quando comparados com a água pura. d) Porque o aditivo diminui a pressão de vapor da solução formada com relação à água pura, causando um aumento da temperatura de ebulição e uma diminuição da temperatura de fusão. e) Porque o aditivo diminui a capacidade calorífica da água, causando uma diminuição da temperatura de fusão e de ebulição. 17. Foi observado que o cozimento de meio quilo de batatas em 1 litro de água é mais rápido se adicionarmos 200 gramas de sal à água de cozimento. Considere as seguintes possíveis explicações para o fato: I. a adição de sal provoca um aumento da temperatura de ebulição da água; II. a adição de sal provoca um aumento da pressão de vapor da água; III. o sal adicionado não altera a temperatura de ebulição da água, mas reage com o amido das batatas. Está(ão) correta(s) a(s) explicação(ões): __________________________ 18. As curvas de pressão de vapor, em função da temperatura, para um solvente puro, uma solução concentrada e uma solução diluída são apresentadas na figura a seguir. Considerando que as soluções foram preparadas com o mesmo soluto não volátil, pode-se afirmar que as curvas do solvente puro, da solução concentrada e da solução diluída são, respectivamente, a) I, II e III. b) II, III e I. c) I, III e II. d) II, I e III. e) III, II e I. “Mais importante do que a vontade de vencer é a coragem de começar:” 4
Download