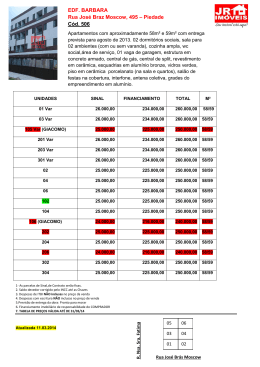
7. Ficoflora Lezilda C. Torgan, Sandra M. Alves da Silva, Vera R. Werner, Zulanira M. Rosa, Luciana de S. Cardoso, Silvana C. Rodrigues, Cristiane B. dos Santos, Carla B. Palma, Jaqueline R. Fortuna, Mariéllen D. Martins, Aline B. Bicca & Andrea S. Weber 112 Introdução As algas, um grupo extremamente diversificado de organismos, constituem a ficoflora dos ecossistemas aquáticos continentais. Compreendem seres microscópicos unicelulares, predominantemente autótrofos, que são a base energética das cadeias alimentares nos ambientes aquáticos. A riqueza e diversidade da ficoflora revelam a diversidade de microhabitats, que são considerados na análise do estado de conservação dos ecossistemas. O conhecimento da ficoflora, nos ambientes aquáticos da Planície Costeira do Rio Grande do Sul, encontra-se mais concentrado em lagoas do litoral norte do Estado. De uma forma geral, a comunidade fitoplanctônica foi mais bem estudada do que a perifítica. Entre os trabalhos que abordaram a composição e aspectos ecológicos da comunidade fitoplanctônica, podemos citar o de Callegaro et al. (1981) para a laguna de Tramandaí e lagoa do Armazém, o de Kremer (1985) para a lagoa das Pombas, os de Vélez (1990) e Garcia & Vélez (1995) para a lagoa Emboaba, o de Konrath (1995) para a lagoa Caconde, o de Salomoni (1997) para as lagoas Marcelino e Pinguela, o de Padilha (2001) para as lagoas Marcelino-Passo e os de Cardoso (2001), Becker (2002) e Cardoso & Motta Marques (2003, 2004) para a lagoa Itapeva. Já a comunidade perifítica foi estudada por Tedesco (1995) na lagoa Caconde e por Fermino (1997) na lagoas Marcelino e Pinguela. Estudos florísticos sobre grupos específicos também foram efetuados para esta região. As diatomáceas e cianobactérias foram estudadas nas lagunas de Tramandaí e do Armazém e esta última, em lagoas e lagunas ao longo da costa estendendo-se desde Torres, ao norte, até Santa Vitória do Palmar, ao sul (Rosa, 1982; Rosa & Callegaro, 1988; Werner, 1988; Rosa & Werner, 1993; Rosa et al., 1994; Werner & Sant’Anna, 1998, 2000 e Werner, 2002a). Além destes trabalhos, podemos citar o de Patrick (1944) sobre diatomáceas da lagoa dos Quadros e o de Rosa & Miranda-Kiesslich (1988), sobre o gênero Pediastrum Meyen (Chlorophyceae) no sistema lagunar da região litoral sul-riograndense. Nos litorais médio e sul do Rio Grande do Sul, os estudos de fitoplâncton abrangeram somente a Laguna dos Patos e lagoas da Estação Ecológica do Taim. Na Laguna dos Patos, as primeiras investigações sobre a composição taxonômica, densidade e distribuição horizontal e vertical do fitoplâncton foram realizadas por Torgan & Garcia (1989, 1990) e Torgan et al. (1995). Estudos relativos à biomassa e categorias de tamanho nesse sistema foram efetuados por Odebrecht et al. (1988). Posteriormente, Torgan (1997) abordou a estrutura e dinâmica desta comunidade e sua interação com variáveis ambientais. Aspectos referentes à variação espacial da estrutura de tamanho desta comunidade, bem como a variação sazonal de diatomáceas em um ciclo anual, foram também abordados, respectivamente, por Torgan et al. (2000) e Torgan et al. (2002). Para a região da Estação Ecológica do Taim foram efetuados estudos sobre a composição taxonômica de diatomáceas, por Callegaro & Salomoni (1988), Lobo et al. (1992), Flôres et al. (1999a, b) e Ludwig et al. (2004); de euglenofíceas pigmentadas, por Alves-da-Silva (1988), de clorofíceas por Rosa & Miranda-Kiesslich (1989) e de cianofíceas por Werner & Rosa (1992). As lagoas e áreas úmidas adjacentes à região norte da Laguna dos Patos careciam de informações sobre a composição e distribuição das espécies da ficoflora; portanto, o presente diagnóstico das microalgas do plâncton e perifíton nesta região vem suprir esta lacuna no conhecimento da biodiversidade, contribuir para a avaliação do estado de conservação desses ecossistemas e identificar áreas prioritárias para conservação. 113 Material e métodos O estudo baseou-se na análise da composição da comunidade de microalgas presentes em dois distintos microhabitats (plâncton e perifíton) presentes em lagoas conectivas, canais e áreas úmidas da região da Lagoa do Casamento, situada nos Municípios de Capivari do Sul e Palmares do Sul, bem como em lagoas isoladas, açude e áreas úmidas (banhados) na região dos Butiazais de Tapes, situada nos Municípios de Barra do Ribeiro e Tapes. As amostragens foram realizadas nos meses de maio e junho (período de águas altas) e em outubro, novembro e dezembro de 2003 (período de águas baixas). Foram selecionadas 21 estações de amostragem distribuídas em seis subáreas: A, B, D e G associadas à região da Lagoa do Casamento e duas subáreas A’ e B’, associadas à região dos Butiazais de Tapes (tab. I). As coletas de fitoplâncton foram realizadas com frascos e rede (malha de 25µm), na subsuperfície da água, na zona pelágica e litorânea dos ambientes aquáticos. Foram também obtidas amostras com o uso de moto-bomba (Sthil P835), onde um volume de 200 a 300l foram concentrados em rede de malha de 25µm. As coletas de perifíton foram efetuadas na zona litorânea, através de espremido manual das raízes e folhas das macrófitas aquáticas. As amostras de frascos foram fixadas com formaldeído na proporção de 2:100ml e as amostras de rede e espremido com solução de Transeau na proporção de 1:1. Parte das amostras foi mantida in vivo também para análise. Efetuou-se oxidação do material com água oxigenada 20 vol e montagem de lâminas permanentes com Naphrax para análise de diatomáceas. Para registro das espécies foram efetuadas fotomicrografias e captura de imagem digital. As amostras encontram-se tombadas no Herbário Prof. Dr. Alarich Schultz (HAS) do MCN/FZB, sob os números HAS 104092–104456. Adotou-se o sistema de classificação de Hoek et al. (1995) para o enquadramento dos táxons em níveis de divisões e classes, com exceção das diatomáceas, que foram classificadas segundo o sistema de Round et al. (1990). Para a classificação, em níveis de ordens e famílias, seguiu-se os seguintes sistemas: Komárek & Anagnostidis (1986, 1989, 1995 e 1999) e Anagnostidis & Komárek (1988, 1990) para as cianobactérias; Popovsky & Pfiester (1990) para os dinoflagelados; Leedale (1967) para as euglenofíceas; Ruzicka (1977) para as desmídias e Komárek & Fott (1983) para as clorococales. A identificação dos espécimes baseou-se na literatura especializada para a taxonomia de cada grupo. Para a divisão Chlorophyta foram estudados apenas representantes das classes Chlorophyceae (ordem Chlorococcales) e Zygnematophyceae. Simultaneamente às coletas de microalgas, foram efetuadas medidas in loco de algumas condições físicas e químicas da água, tais como temperatura, transparência, pH, condutividade, oxigênio dissolvido e sólidos totais dissolvidos. A análise de similaridade entre as áreas e subáreas foi baseada no coeficiente de Czechanovski (Margalef, 1974). Para a análise da distribuição dos táxons no Estado utilizouse das informações contidas no checklist de Bacillariophyta (Torgan et al., 1999), no catálogo de Euglenophyta (Alves-daSilva & Hahn, 2001), no de Chlorophyta (Torgan et al., 2001) e no das demais divisões (Torgan et al., 2003), com exceção de Cyanophyta. Foram considerados de distribuição restrita os táxons que ocorreram em somente uma região fisiográfica do Estado e, de ampla distribuição, aqueles que se fizeram presentes em mais de uma região. Na bioindicação, utilizou-se referências de trofia (oligotróficos, mesotróficos e eutróficos) e de saprobidade (oligossapróbicos, mesossapróbicos e polissapróbicos), segundo a classificação de Lowe (1974). Resultados Condições físicas e químicas da água Os ecossistemas aquáticos das áreas de estudo apresentaram, em geral, baixa transparência. Valores < 0,35m foram registrados nos ambientes mais rasos (banhados) com 0,15 a 0,60m de profundidade e nas lagoas da região da Lagoa do Casamento, onde a profundidade variou entre 2,00 a 2,95m. O canal do Pontos Região P1 LC P2 P3 LC LC P4 P5 Subáreas Sangradouro da lagoa dos Gateados e a lagoa das Capivaras foram os únicos ambientes que apresentaram maior transparência, com valores de 55 e 180cm, respectivamente. A temperatura da água variou entre 14,0 e 24,4ºC, nos meses de maio e junho, estação de outono, e entre 24,4 e 29,8ºC, nos meses de outubro, novembro e dezembro, estação de primavera. As maiores temperaturas ocorreram no banhado entre a Lagoa do Casamento e lagoa do Capivari, local onde a profundidade foi menor, cerca de 0,30m. As lagoas por serem rasas e turbulentas, devido à ação constante dos ventos atuantes nesta região, apresentaram valores relativamente altos de oxigênio dissolvido (>6,0 mg/l). Somente o banhado com Sphagnum, no período de águas altas e o banhado da Fazenda Rincão do Anastácio, no período de águas baixas, demonstraram baixa concentração deste elemento, ou seja, 2,8 a 2,9 mg/l, respectivamente. A porcentagem de O2 foi maior nas lagoas (>60%) e menor (<40%) nos banhados. As águas se apresentaram, em geral, levemente ácidas, com pH entre 6,2 e 6,9. Valores de pH mais baixo (4,3 a 5,4) foram observados somente em lagoas e banhados entre dunas, na região dos Butiazais de Tapes, no período de águas baixas. Ambientes Zonas A banhado entre l. Capivari e l. Casamento L A A banhado entre l. Capivari e l. Casamento lagoa do Capivari L P LC LC A G lagoa do Casamento banhado Fazenda Rincão Anastácio P L P6 P7 LC LC G D banhado Fazenda Rincão Anastácio lagoa dos Gateados Norte L L P8 P9A LC LC D D lagoa dos Gateados Norte lagoa dos Gateados Norte L P P9B P10 LC LC D D lagoa dos Gateados Norte canal do Sangradouro P L P11 P12A LC LC B B lagoa dos Gateados Sul lagoa dos Gateados Sul L P P12B P13 LC BT B B’ lagoa dos Gateados Sul lagoa C P L P14 P15 BT BT B’ B’ lagoa C açude Fazenda São Miguel P L P16 P17 BT BT A’ A’ lagoa das Capivaras lagoa das Capivaras L P P18 P19 BT BT A’ A’ banhado com Sphagnum lagoinha entre dunas L L P20 P21 BT BT A’ B’ banhado entre dunas lagoa R L L/P 114 A condutividade da água foi o fator que evidenciou a diferença entre os ambientes das duas grandes áreas. As lagoas e banhados da região da Lagoa do Casamento apresentaram maior condutividade (média de 170 mS.cm-1) em relação às lagoas e banhados da região dos Butiazais de Tapes (média de 25 mS.cm-1), tanto no período de águas altas como baixas. A alta condutividade dos ambientes da região da Lagoa do Casamento se deve à maior concentração de matéria orgânica e íons dissolvidos provenientes da bacia do lago Guaíba. A média de sólidos totais dissolvidos, medidos no período de águas altas, foi >53 mg/l na área da Lagoa do Casamento e <20 mg/l na região dos Butiazais de Tapes, conferindo com os dados de condutividade nestas duas áreas. Composição e riqueza da ficoflora As lagoas e áreas úmidas, adjacentes à região norte da Laguna dos Patos (regiões da Lagoa do Casamento e dos Butiazais de Tapes) apresentam uma ficoflora rica e diversificada, constituída por 730 táxons genéricos e específicos, distribuídos em cinco divisões taxonômicas. As divisões Chlorophyta, Bacillariophyta e Euglenophyta foram as mais representativas compreendendo 90% dos táxons identificados, seguidas de Cyanophyta (8%) e Dinophyta (2%) (fig. 1a). A lista dos táxons identificados encontra-se no Apêndice I. A divisão Bacillariophyta (diatomáceas) esteve representada por 52 gêneros, 123 espécies, 35 variedades e duas formas taxonômicas. Os gêneros de diatomáceas que se destacaram pela maior riqueza específica foram Nitzschia, Eunotia e Pinnularia, que abrangeram 43% do total de táxons (fig. 1b). Zygnematophyceae, a classe melhor representada de Chlorophyta, esteve composta por 26 gêneros, 198 espécies e 17 variedades. Os gêneros com maior riqueza de espécies foram Cosmarium, Staurastrum e Closterium, perfazendo um total de 61% dos táxons identificados (fig. 1c). A divisão Euglenophyta esteve representada por 13 gêneros, 67 espécies, 32 variedades e três formas taxonômicas. A ordem Euglenales foi a que apresentou maior número de gêneros, compreendendo os despigmentados Astasia e Hyalophacus e os pigmentados Euglena, Lepocinclis, Phacus, Strombomonas e Trachelomonas. Dentre esses, Trachelomonas destacou-se por apresentar maior riqueza, seguindo-se o gênero Phacus e Euglena compreendendo um total de 80% dos táxons identificados. Os demais gêneros apresentaram baixa representatividade (fig. 1d). Tabela I. Relação dos pontos e ambientes amostrados no estudo de microalgas nas subáreas da Lagoa do Casamento (LC) e Butiazais de Tapes (BT), nas zonas (L = litoral e P = pelágica), nos meses de maio, junho, outubro, novembro e dezembro de 2003. a b c d e f g h Entre as Cyanophyta (cianobactérias) documentadas, foram identificados 61 táxons pertencentes a 30 gêneros, 50 espécies e uma forma taxonômica; os demais táxons foram determinados apenas em nível de gênero. Chroococcales foi a ordem mais bem representada por incluir 30 táxons (49,2% do total identificado), seguida da Oscillatoriales com 17 (27,8%), da Nostocales com 11 (18%) e da Stigonematales com três (5%). Microcystis e Phormidium foram os gêneros melhor representados, com cinco táxons cada um, ou seja, o equivalente a 7% do total dos táxons identificados. Seguiram-se Anabaena, Aphanothece, Chroococcus, Merismopedia e Microcystis com quatro cada um (7%). Na figura 1e são apresentadas as porcentagens de táxons identificados no conjunto dos ambientes analisados. Chlorophyta – Chlorophyceae, pertencente à ordem Chlorococcales, esteve representado por 21 gêneros, 43 espécies e quatro variedades. Os gêneros que apresentaram maior número de espécies foram Desmodesmus, Pediastrum e Coelastrum, compreendendo 35% dos táxons identificados (fig. 1f). Dinophyta esteve representado por seis gêneros e sete espécies identificadas, sendo Peridinium o gênero mais rico em espécies, correspondendo 46% dos táxons identificados (fig. 1g). De uma maneira geral, essas duas classes apresentaram menor número de táxons frente aos demais na área de estudo. Relação e similaridade das áreas com base na ficoflora Considerando o conjunto de todos os táxons registrados nos inventários realizados, as regiões dos Butiazais de Tapes e da Lagoa do Casamento demonstraram baixa similaridade, ou seja, um valor percentual de apenas 35%. A região da Lagoa do Casamento apresentou maior riqueza de microalgas, onde se fizeram presentes 622 táxons, em relação aos 270 encontrados na região dos Butiazais de Tapes (fig. 1h). Em geral, todas as divisões apresentaram maior riqueza na região da Lagoa do Casamento, com exceção de Dinophyta, cuja diferença entre as duas áreas foi de apenas um táxon (fig. 2a). A lista de táxons presentes nas referidas áreas encontra-se no Apêndice I. Figura 1. (a) Contribuição relativa dos táxons identificados nos ambientes aquáticos das regiões da Lagoa do Casamento e dos Butiazais de Tapes; (b) porcentagem dos gêneros de Bacillariophyta; (c) porcentagem dos gêneros de Chlorophyta-Zygnematophyceae; (d) porcentagem dos gêneros de Euglenophyta; (e) porcentagem dos gêneros de Cyanophyta (cianobactérias); (f) porcentagem dos gêneros de Chlorophyta-Chlorophyceae; (g) porcentagem dos gêneros de Dinophyta; (h) número de táxons registrados nas regiões de estudo, Lagoa do Casamento e Butiazais de Tapes. 115 Figura 2. (a) Riqueza de espécies das classes de microalgas nas regiões dos Butiazais de Tapes e da Lagoa do Casamento (Planície Costeira do Rio Grande do Sul). Riqueza de espécies nas classes de microalgas nos locais amostrados. (b) Butiazais de Tapes; (c) Lagoa do Casamento. c b a Cyanophyceae Bacillariophyceae Na região da Lagoa do Casamento, os ambientes de áreas úmidas (P1, P2, P5 e P6) foram os macrohabitats preferenciais. Somente no banhado entre as lagoas Capivari e Casamento foi registrado um total de 118 táxons de Euglenophyta, 75 de Bacillariophyta e 70 de Zygnematophyceae e, no banhado da Fazenda Rincão do Anastácio, um total de 280 táxons de diferentes classes (figs. 2b, 2c). As lagoas com conexão direta com a Laguna dos Patos foram ricas em diatomáceas e cianobactérias. Na Lagoa do Casamento destacaram-se pela abundância Aulacoseira distans, A. granulata, Staurosira longirostris e Planktolyngbya limnetica. A riqueza de dinofíceas e euglenofíceas, para as quais foram analisadas amostras relativas ao período de águas altas e baixas, estiveram relacionadas com o período de amostragem. A riqueza foi maior nos meses de maio e junho (período de águas altas), ocasião em que as lagoas receberam maior contribuição das águas Dinophyceae Euglenophyceae Zygnematophyceae da bacia do lago Guaíba. Neste período, as lagoas conectivas à Lagoa do Casamento (lagoas Capivari e lagoa dos Gateados) se mostraram mais similares do que no período de outubro, novembro a dezembro de 2003 (período de águas baixas). Já as lagoas isoladas da região dos Butiazais de Tapes (lagoa C, lagoa R e lagoinha entre dunas) mantiveram similaridade alta entre elas, independente do hidroperíodo. Na região da Lagoa do Casamento, o canal do Sangradouro, um estreito sistema de ligação entre a lagoa dos Gateados e a Lagoa do Casamento, repleto de macrófitas aquáticas fixas e flutuantes, e protegido da ação dos ventos, foi outro ambiente propício ao desenvolvimento de dinofíceas. Em relação ainda a esse grupo, Durinskia baltica foi a única espécie que se fez presente em todas as subáreas amostradas, podendo ser considerada residente e própria dos ecossistemas associados às duas áreas. Peridinium gatunense e P. umbonatum, ocorreram 116 Chlorophyceae também em ambas as áreas no período de águas altas e mantiveram-se presentes, no período de águas baixas, somente na região dos Butiazais de Tapes, mais especificamente, nas lagoas R e C. Informações mais detalhadas sobre a variação espaço-temporal da densidade destas duas espécies são apresentadas por Cardoso & Torgan (2005). Na região dos Butiazais de Tapes a maior diversidade (101 táxons) ocorreu no banhado coberto em parte, por Sphagnum, onde predominaram espécies de Pinnularia, Eunotia e Stenopterobia (Bacillariophyta) e se fizeram presente maior riqueza de gêneros de Zygnematophyceae. As demais lagoas e banhados situados entre dunas desta área, apresentaram uma flora diversificada com representantes dos diferentes grupos algais (fig. 2). Nas figuras 3 a 6 estão ilustradas representantes que se fizeram presentes nos diferentes macrohabitats das regiões da Lagoa do Casamento e dos Butiazais de Tapes. a d b e g h k i l c f j Figura 3. Microalgas representativas de lagoas conectivas na região da Lagoa do Casamento. (a) Chroococcus limneticus; (b) Diadesmis confervacea; (c) Gyrosigma obscurum; (d) Melosira varians; (e) Aulacoseira ambigua; (f) Aulacoseira herzogii; (g) Closterium kuetzingii; (h) Phacus curvicauda var. curvicauda; (i) Euglena acus var. acus; (j) Peridinium gatunense; (k) Phacus suecicus var. suecicus; (l) Pleurotaenium ovatum; (m) Durinskia baltica. Escala = 10Pm. 117 m Discussão a b c d e f g h Figura 4. Microalgas representativas de áreas úmidas na região da Lagoa do Casamento. (a) Aphanocapsa koordersi; (b) Eunotia flexuosa; (c) Lepocinclis ovum var. dimidio-minor; (d) Octacanthium mucronulatum; (e) Durinskia baltica; (f) Lepocinclis salina var. salina; (g) Euglena oxyuris var. oxyuris; (h) Euglena spirogyra var. fusca. Escala = 10Pm. 118 O inventário da diversidade da ficoflora dos ecossistemas aquáticos associados às regiões dos Butiazais de Tapes e da Lagoa do Casamento revelou um número expressivo de primeiros registros para o Rio Grande do Sul. Entre as Dinophyta, apenas três espécies (Peridinium gatunens, P. umbonatum e Durinskia baltica) já haviam sido registradas para o Estado. Peridinium gatunense foi mencionado para açudes da região do curso inferior do rio Jacuí (Rosa et al., 1987), P. umbonatum para a lagoa Emboaba, situada no litoral norte do Estado (Garcia & Vélez, 1995) e Durinskia baltica, como Peridiniopsis oculata (Stein) Bourrelly para o lago Guaíba e lagos artificiais de Porto Alegre (Franceschini, 1992). Os demais táxons encontrados são, portanto, registros pioneiros para o Estado. O conhecimento deste grupo é também bastante limitado no Brasil (Rocha, 2000). As euglenofíceas estiveram bem representadas, sendo registrados pela primeira vez vários estágios palmelóides dos gêneros Euglena e Trachelomonas e de gêneros ou espécies de despigmentadas como Gyropaigne sp., Heteronema sp., Menoidinium gracile, Scytomonas sp. 1, Scytomonas sp. 2 e cf. Sphenomonas sp. São considerados novos registros Trachelomas hemisphaerica e T. raciborskii var. nova f. nova, distinguindo-se ainda, a presença de possíveis novas espécies para a ciência. Tratando-se das cianobactérias, além dos 17 táxons mencionados pela primeira vez para a ficoflórula do Rio Grande do Sul, três outros constituem novos registros para sistemas aquáticos da Planície Costeira do Estado, quais sejam: Chroococcus minimus, Merismopedia cf. elegans e Planktothrix mougeotii. Com relação às clorofíceas, a maioria das espécies de Chlorococcales já foi registrada para outros ambientes aquáticos no Estado, segundo catálogo de Torgan et al. (2001). No entanto, seis táxons constituem-se primeiros registros, a maioria destes encontrado somente na região da Lagoa do Casamento, quais sejam: Keratococcus cf. suecicus (Lagoa do Casamento); Lobocystis planctonica e Raphidocelis sigmoidea (lagoa do Capivari) e Actinastrum hantzschii var. subtile (canal do Sangradouro). Os demais foram encontrados nas duas regiões, Dictiosphaerim sphagnale (Lagoa do Casamento e lagoa C) e Quadrigula closterioides (lagoa C e banhado da Fazenda do Rincão do Anastácio). Com relação às classes melhor representadas em número de táxons na área de estudo, foram registrados 69 táxons de Bacillariophyta, 21 de Zygnematophyceae e 15 táxons de Euglenophyta, como primeira citação para o Rio Grande do Sul, demonstrando a importância das referidas áreas como abrigo de organismos na Planície Costeira do Estado. A presença de um número elevado de espécies de algas nas áreas úmidas pode ser atribuída, primeiramente, à existência de uma extensa zona litorânea com vegetação marginal, fato que propicia o desenvolvimento de representantes de hábito perifítico; entre esses, destacam-se os pertencentes aos gêneros Closterium, a b c d e f g h i j k l m n o p Figura 5. Microalgas representativas de lagoas isoladas na região dos Butiazais de Tapes. (a) Merismopedia glauca; (b) Thompsodinium intermedium; (c) Peridinium sp.; (d) Cyanodiction tubiformis; (e, f) Woloszynskia neglecta; (g) Trachelomonas armata var. steinii; (h) Peridinium umbonatum; (i) Woloszynskia neglecta; (j) Desmidium cylindricum; (k) Strombomonas scabra var. ovata f. minor; (l) Staurodesmus triangularis; (m) Lepocinclis fusiformis var. fusiformis; (n) Strombomonas verrucosa var. verrucosa; (o) Spirogyra sp.; (p) Cosmocladium sp. Escala = 10Pm, exceto j, o, 20Pm. 119 Figura 6. Microalgas representativas de áreas úmidas da região dos Butiazais de Tapes. (a) Pinnularia viridis; (b) Actinotaenium cucurbita; (c) Thompsodinium intermedium; (d) Trachelomonas curta var. curta; (e) Trachelomonas volvocinopsis var. volvocinopsis; (f) Thompsodinium intermedium; (g) Euastrum germanicum. Escala = 10Pm. a b c d e f g 120 Cosmarim, Euastrum (Zygnematophyceae) e Eunotia (Bacillariophyta). Deve-se também à maior disponibilidade de matéria orgânica e nutrientes, provenientes da decomposição desta vegetação, o que pode ser evidenciado pela ocorrência em maior proporção, nesta zona, de espécies de euglenofíceas e de diatomáceas mesotróficas a eutróficas e mesossapróbicas, indicadoras de águas ricas em nutrientes e matéria orgânica (Apêndice I). Nas áreas úmidas ocorre também maior intercâmbio entre água e sedimento, fato que propicia a ocorrência na água de organismos provindos do bentos. Destacaram-se nestas áreas espécies do gênero Pinnularia (Bacillariophyta), observadas em maior número no banhado de Sphagnum, e de euglenofíceas despigmentadas, em especial dos gêneros Gyropaigne e Scytomonas, encontradas no banhado entre as lagoas do Capivari e do Casamento. A diversidade da ficoflora nas lagoas e áreas úmidas associadas à região da Lagoa do Casamento deve-se, em grande parte, à intercomunicação dessas com a bacia hidrográfica do lago Guaíba, que possui uma microflora também diversificada (Torgan & Aguiar, 1978; Torgan et al., 1979; Torgan, 1984; Rosa et al., 1987; Rosa et al., 1988; Franceschini, 1992; Alves-da-Silva, 1997; Fortes et al., 2003; Rodrigues, 2004). Na região dos Butiazais de Tapes, a maior especificidade e diversidade de macrohabitats (açudes, banhados e lagoas isoladas) com características distintas determinaram também uma alta diversidade de microalgas, com a presença de um número significativo de organismos inicialmente desconhecidos, que poderão se constituir em novos registros para a ciência. O hidroperíodo pôde ser considerado um fator preponderante na distribuição das espécies, principalmente, nos ambientes aquáticos da região da Lagoa do Casamento, que se encontram interconectadas na planície de inundação. No período de águas altas, o aumento do nível de água nas lagoas isoladas da região dos Butiazais de Tapes tornou-as mais similares às lagoas abertas da área da Lagoa do Casamento, levando a se obter maior similaridade da ficoflora entre as duas áreas em questão. Ressalta-se a ocorrência de Cylindrospermopsis raciborskii, Geitlerinema amphibium, Microcystis aeruginosa, Planktolyngbya limnetica e Planktothrix mougeotii nas lagoas e banhados da região da Lagoa do Casamento, e de Pseudanabaena catenata na lagoinha entre dunas na região dos Butiazais de Tapes, espécies referidas na literatura como potencialmente tóxicas (Chorus & Bartram, 1999; Sant’anna & Azevedo, 2000). Fenômenos de florações de C. raciborskii, M. aeruginosa e P. mougeoti, inclusive com linhagens tóxicas, foram registradas nos últimos anos nas águas da bacia hidrográfica do lago Guaíba e da Laguna dos Patos (Odebrecht et al., 1987; Torgan, 1989; Yunes et al., 1998a, b; Werner, 2000, 2002b), devido a processos de eutrofização de suas águas. No entanto, não foram verificadas florações algais nos ecossistemas aquáticos associados às áreas do presente estudo. Os resultados do inventário florístico de microalgas realizados nos ecossistemas aquáticos associados às regiões dos Butiazais de Tapes e da Lagoa do Casamento vêm demonstrar que a ficoflora é rica em espécies. O total de 730 táxons registrados amplia, consideravelmente, o conhecimento da biodiversidade de algas da Planície Costeira do Estado. Foi identificado também um número significativo de táxons pertencentes às divisões Bacillariophyta, Euglenophyta e Cyanophyta que, possivelmente, constituem citações novas para a ciência. A grande importância ecológica dos ecossistemas da região norte da Laguna dos Patos fundamenta-se, principalmente, na diversidade de macrohabitats (lagoas isoladas, banhados, canais, açudes e lagoas interligadas à Laguna dos Patos) que funcionam como áreas de desenvolvimento de microalgas e, conseqüentemente, da micro e macrofauna aquática. As áreas apresentaram baixa similaridade em relação à ficoflora. A região da Lagoa do Casamento caracterizou-se por possuir alta riqueza específica, enquanto que a região dos Butiazais de Tapes, por abrigar um elevado número de espécies de distribuição restrita, de primeiros registros para o Estado e outras, até o momento, desconhecidas. Com base nos resultados obtidos, em síntese, pode-se afirmar que as regiões da Lagoa do Casamento e dos Butiazais de Tapes encontram-se em bom estado de conservação e apresentam importantes ecossistemas que merecem ser preservados. Recomenda-se a preservação dos ambientes aquáticos associados às regiões da Lagoa do Casamento e dos Butiazais de Tapes, pela diversidade e singularidade da ficoflora. As lagoas abertas conectadas à Lagoa do Casamento encontram-se mais suscetíveis à eutrofização, à floração de algas nocivas e poluição orgânica oriundas da bacia hidrográfica do lago Guaíba. Essas lagoas estão sujeitas, também, à ação de drenagem, retiradas de água, uso de agrotóxicos e fertilizantes para o cultivo do arroz. Recomenda-se, portanto, o controle do impacto antrópico da orizicultura nesta área, pois o excesso de nutrientes inorgânicos usados nesta monocultura pode causar eutrofização das águas, floração de algas e, como conseqüências, o decréscimo da biodiversidade da ficoflora aquática. Considera-se fundamental a preservação da planície arenosa, onde se localiza a região dos Butiazais de Tapes, para a manutenção das lagoas e banhados entre dunas de areia, que caracteriza um típico ecossistema de restinga. Este ecossistema constitui-se um registro histórico do período de transgressão marinha ocorrida durante o Holoceno. Recomenda-se evitar a implementação de loteamentos e construção de estradas, extração de areia na região dos Butiazais de Tapes, em função da fragilidade dos ambientes aquáticos existentes nesta área, pois são lagoas fechadas alimentadas predominantemente pela água das chuvas. É importante lembrar ainda que a Laguna dos Patos, sistema diretamente relacionado à Lagoa do Casamento, foi considerada uma das áreas prioritárias para conservação da biodiversidade do plâncton, segundo MMA/SBF (2002). Referências bibliográficas Anagnostidis, K. & Komárek, J. 1988. Modern approach to the classification system of cyanophytes. 3 Oscillatoriales. Arch. Hydrobiol., Suppl., 80(1-4):327-472. Anagnostidis, K. & Komárek, J. 1990. Modern approach to the classification system of cyanophytes. 5 Stigonematales. Algol. Stud., 79:1-73. Alves-da-Silva, S. M. 1988. Euglenaceae pigmentadas (Euglenophyta) da Estação Ecológica do Taim, Rio Grande do Sul, Brasil. Iheringia, Sér. Bot., (38):109-126. Alves-da-Silva, S. M. 1997. Levantamento taxonômico e variação temporal das Euglenophyceae de um reservatório raso no município de Triunfo, estado do Rio Grande do Sul. Tese (Doutorado em Ciências Biológicas). UNESP, Rio Claro, São Paulo. 482 p. Alves-da-Silva, S. M. & Hahn. A. T. 2001. Lista das Euglenophyta registradas em ambientes de águas continentais e costeiras do Estado do Rio Grande do Sul, Brasil. Iheringia, Sér. Bot., (55):171-188. Becker, V. 2002. Variação da estrutura e da biomassa fitoplanctônica na lagoa Itapeva (Litoral Norte do Rio Grande do Sul) em função da hidrodinâmica. Dissertação (Mestrado em Ecologia). UFRGS, Porto Alegre. 116 p. Callegaro, V. L. M. & Salomoni, S. 1988. Diatomáceas das Lagoas do Jacaré, Nicola e Mangueira, Estação Ecológica do Taim: novas ocorrências para o Rio Grande do Sul. Iheringia, Sér. Bot., (38):127-148. Callegaro, V. L. M.; Rosa, Z. M. & Werner, V. R. 1981. Comunidades fitoplanctônicas das Lagoas Tramandaí e do Armazém, Tramandaí, Rio Grande do Sul, Brasil. Iheringia, Sér. Bot., (28):3-16. Cardoso, L. S. 2001. Variações da estrutura planctônica da Lagoa Itapeva (Sistema Lagunar Costeiro do Rio Grande do Sul) em função da hidrodinâmica. Tese (Doutorado em Engenharia Hidráulica), UFRGS, Porto Alegre. 466 p. Cardoso, L. S. & Motta Marques, D. M. L. 2003. Rate of Change of the phytoplankton in Itapeva lake (North Coast of Rio Grande do Sul, Brazil) based on the wind driven hydrodynamic regime. Hydrobiologia, 497(1-3):1-12. Cardoso, L. S. & Motta Marques, D. M. L. 2004. Structure of the phytoplankton community in Itapeva lake (north coast of Rio Grande do Sul, Brazil) and its relationship to hydrodynamic aspects: seasonal composition. Acta Limnol. Brasil.; 16(4):401-416 Cardoso, L. S. & Torgan, L. C. 2005. Distribuição e abundância de Peridinium gatunense e P. umbonatum (Dinophyceae) em ecossistemas da zona costeira no sul do Brasil. In: Anais da X Reunião Brasileira de Ficologia. Série livro do Museu Nacional, Rio de Janeiro. p. 517-526. Chorus, I. & Bartram, J. eds. 1999. Toxic cyanobacteria in water: A guide to their public health consequances, monitoring and management. London, E & FN Spon, 416 p. 121 Fermino, F. S. 1997. Estrutura e dinâmica de algas do perifíton de Eichhornia azurea (SW.) Künth em lagoas costeiras eutrofizadas do litoral do Rio Grande do Sul (Osório, RS). Dissertação (Mestrado em Ecologia). UFRGS, Porto Alegre. 127 p. Flôres, T. L.; Moreira-Filho, H. & Ludwig, T. A. V. 1999a. Contribuição ao inventário florístico das Diatomáceas (Bacillariophyta) do banhado do Taim, Rio Grande do Sul, Brasil: I - Epithemia Brebisson ex Kutzing, Rhopalodia O. Muller e Surirella Turpin. Insula, 28:149-166. Flôres, T. L.; Moreira-Filho, H. & Ludwig, T. A. V. 1999b. Contribuição ao inventário florístico das Diatomáceas (Bacillariophyta) do banhado do Taim, Rio Grande do Sul, Brasil: II - Fragilariaceae. Insula, 28:167-190. Fortes, D. F.; Torgan, L. C. & Silva Junior, A. 2003. Composição e variação sazonal do fitoplâncton (Chlorophyta Chlorococcales s.l.) próximo à foz do rio dos Sinos, em área pertencente ao Parque Estadual Delta do Jacuí, RS, Brasil. Iheringia, Sér. Bot., 58(1):103-129. Franceschini, I. M. 1992. Algues d’eau douce de Porto Alegre, Brésil (les Diatomophycees exclues). Berlim, J. Cramer. (Bibliotheca Phycologica, 92). 73 p. Garcia, M. & Vélez, E. 1995. Algas planctônicas da Lagoa Emboaba, Planície Costeira do Rio Grande do Sul: avaliação qualitativa. Bolm Inst. Bioc. UFRGS, (54):75-114. Hoek, C. van den; Mann, D. G. & Jahns, H. M. 1995. Algae: an introduction to phycology. Cambridge, Cambridge University Press, 627 p. Komárek, J. & Anagnostidis, K. 1986. Modern approach to the classification system of Cyanophytes. 2- Chroococcales. Arch. Hydrobiol., Suppl., 56:247-226. Komárek, J. & Anagnostidis, K. 1989. Modern approach to the classification system of cyanophytes. 4 Nostocales. Arch. Hydrobiol., Suppl., 82(3):157-345. Komárek, J. & Anagnostidis, K. 1995. Nomenclatural novelties in chroococcalean cyanoprokaryotes. Preslia, (67):15-23. Komárek, J. & Anagnostidis, K. 1999. Cyanoprokaryota. pt.1 Chroococcales. In: Ettl, H. et al. ed. Süsswasserflora von Mitteleuropa, Jena, Gustav Fisher, v. 19, 548 p. Komárek, J. & Fott, B. 1983. Chlorophyceae-Chlorococcales. pt. 7 In: Huber-Pestalozzi, G. U. A. Das Phytoplankton des Susswassers. Systematik und Biologie. Stuttgart, E Schweizerbart´sche Verlagsbuchlandlung. 1044 p. Konrath, J. 1995. Flutuação temporal da taxa de fixação de carbono particulado, estrutura do fitoplâncton e fatores ambientais em uma lagoa costeira eutrófica (Lagoa Caconde, Osório, RS). Dissertação. (Mestrado em Ecologia) UFRGS, Porto Alegre. 146 p. Kremer, L. M. 1985. Produção primária do fitoplâncton na Lagoa das Pombas, Tramandaí, Rio Grande do Sul. Dissertação (Mestrado em Ecologia), UFRGS, Porto Alegre. 149 p. Leedale, G. 1967. Euglenoid Flagellates. Englewood, Clifs. NJ., Prentice Hall. 242 p. Lobo, E. A.; Callegaro, V. L. M.; Ferraz, G. C. & Silva, S. M. A. 1992. Análise da estrutura da biocenose de diatomáceas em lagoas da Estação Ecológica do Taim, Rio Grande do Sul, Brasil. Acta Limnol. Brasil., 4:277-290. Lowe, R. L. 1974. Environmental requeriments and pollution tolerance of freshwater diatoms. Cincinnati, Ohio, National Environmental Research Center. 334 p. Ludwig, T. V. A.; Flores, T. L.; Moreira Filho, H. & Veiga, L. A. S. 2004. Inventário florístico das diatomáceas (Ochrophyta) de lagoas do sistema hidrológico do Taim, Rio Grande do Sul, Brasil: Coscinodiscophyceae. Iheringia, Sér. Bot., 59(1):97106. Margalef, R.1974. Ecologia. Barcelona, Omega. 951 p. MMA/SBF. 2002. Biodiversidade Brasileira: Avaliação e identificação de áreas e ações prioritárias para conservação, utilização sustentável e repartição dos benefícios da biodiverdade nos biomas brasileiros. Ministério do Meio Ambiente- Secretaria de Biodiversidade e Florestas, Brasília, DF. Série Biodiversidade. n. 5, 404 p. Odebrecht, C.; Seeliger, U.; Coutinho, R. & Torgan, L. 1987. Florações de Microcystis (cianobactérias) na lagoa dos Patos, RS. In: Simpósio sobre Ecosistemas da Costa Sul e Sudeste Brasileira: sínteses dos conhecimentos, Cananéia, SP. Anais. p. 280-287. Odebrecht, C.; Moller, O. & Niencheski, L. F. 1988. Biomassa e categorias de tamanho do fitoplâncton total na lagoa dos Patos, Rio Grande do Sul, Brasil (verão de 1986). Acta Limnol. Brasil., 2:367-386. Padilha, R. 2001. Tipologia de lagoas costeiras do litoral norte do Rio Grande do Sul, com ênfase na comunidade fitoplanctônica. Dissertação (Mestrado em Ecologia), UFRGS, Porto Alegre. 104 p. Patrick, R. 1944. Estudo limnológico e biológico das lagoas da região litorânea sul-riograndense. II. Some new diatoms from the Lagoa dos Quadros. Bolm. Mus. Nac. RJ, Sér. Botânica, (2):1-6. Popovsky, J. & Pfiester, L. A. 1990. Dinophyceaea (Dinoflagellida). In: Ettl, H. et al. eds. Sübwasserflora von Mitteleuropa, 6. Gustav Fischer Verlag, Sttugart. 272 p. Rocha, O. 2000. Perfil do Conhecimento de Biodiversidade em Águas Doces no Brasil. São Carlos, COBIO/MMA, GTB/CNPq, NEPAM/UNICAMP, relatório final da Avaliação do Estado do Conhecimento da Diversidade Biológica do Brasil. 69 p. Rodrigues, S. C. 2004. Estudo comparativo da estrutura da comunidade fitoplanctônica na foz dos formadores do delta do Jacuí, Rio Grande do Sul, Brasil. Dissertação (Mestrado em Ecologia). UFRGS, Porto Alegre. 91 p. Rosa, Z. M. 1982. Diatomáceas marinhas e estuarinas de Tramandaí, Rio Grande do Sul, Brasil. Iheringia, Sér. Bot., (29):49-145. Rosa, Z. M. & Callegaro, V. L. M. 1988. Diatomáceas da Lagoa de Tramandaí e da Lagoa do Armazém, Rio Grande do Sul, Brasil: I- Gênero Navicula Bory. Iheringia, Sér. Bot., (37):17-32. Rosa, Z. M. & Miranda-Kiesslich, A. L. 1988. O gênero Pediastrum Meyen (Chlorococcales - Hydrodictyaceae) do Sistema Lagunar da Região Litoral do Rio Grande do Sul. Iheringia, Sér. Bot., (38):149-169. Rosa, Z. M. & Miranda-Kiesslich, A. L. 1989. Chlorococcales (Chlorophyceae) da Estação Ecológica do Taim, Rio Grande do Sul, Brasil. Ínsula, (19):215-228. Rosa, Z. M. & Werner, V. R. 1993. Diatomáceas da Lagoa de Tramandaí e da Lagoa do Armazém, Rio Grande do Sul, Brasil. II - Gêneros Gyrosigma Hassal, Pleurosigma W. Smith e Mastogloia Thwaites. Iheringia, Sér. Bot., (43):67-87. Rosa, Z. M.; Werner, V. R. & Dacroce, L. 1994. Diatomáceas da Lagoa Tramandaí e da Lagoa do Armazém. Iheringia, Sér. Bot., (45):29-55 Rosa, Z. M.; Torgan, L. C.; Lobo, E. A. & Herzog, L. 1988. Análise da estrutura de comunidades fitoplanctônicas e de alguns fatores abióticos em trecho do rio Jacuí, Rio Grande do Sul, Brasil. Acta Bot. Brasíl., 2(1-2):31-46 Rosa, Z. M.; Ungaretti, I.; Kremer, L. M.; Alves-da-Silva, S. M.; Callegaro, V. L. M. & Werner, V. R. 1987. Ficoflora de ambientes lênticos – Estudo preliminar da região de Charqueadas, Rio Grande do Sul, Brasil, com vistas à avaliação ambiental. Acta Bot. Brasil., 1(2):165-188. Round, F. E.; Crawford, R. M. & Mann, D. G. 1990. The Diatoms. Biology and morphology of the genera. Cambridge, Cambridge University Press. 747 p. Ruzicka, J. 1977. Die Desmidiaceen Mitteleuropas, v. 1, fasc.1. Stuttgart, E. Schweizerbartsche Verlagsbuchhandlung. 292 p. Salomoni, S. E. 1997. Aspectos da limnologia e poluição das lagoas costeiras Marcelino, Peixoto e Pinguela (Osório, RS): uma abordagem baseada no fitoplâncton. Dissertação (Mestrado em Ecologia), UFRGS, Porto Alegre. 141 p. Sant’anna, C. L. & Azevedo, M. T. P. 2000. Contribution to the knowledge of potentially toxic Cyanobacteria from Brazil. Nova Hedwigia, 71:369-385. Tedesco, C. D. 1995. Variação espacial e sazonal de microalgas perifíticas em substrato artificial na margem nordeste da lagoa Caconde - Osório, Rio Grande do Sul. Dissertação (Mestrado em Ecologia), UFRGS, Porto Alegre. 86 p. Torgan, L. C. 1984. Diatomáceas das praias do Guaíba, Rio Grande do Sul. In: Seminário sobre pesquisa da lagoa dos Patos, 1, Porto Alegre, RS. Súmula. Porto Alegre, Fundação para o Desenvolvimento de Recursos Humanos. p. 129-133. Torgan, L. C. 1989. Floração de algas: composição, causas e conseqüências. Insula, (19):15-34. Torgan, L. C. 1997. Estrutura e dinâmica da comunidade fitoplanctônica na Laguna dos Patos, Rio Grande do Sul, Brasil, em um ciclo anual. Tese (Doutorado em Ciências, Ecologia e Recursos Naturais), UFSCar, São Carlos. 284 p. 122 Torgan, L. C. & Aguiar, L. W. 1978. Diatomáceas do “rio” Guaíba, Porto Alegre, Rio Grande do Sul, Brasil. Iheringia, Sér. Bot., (23):19-63. Torgan, L. C. & Garcia, M. 1989. Novas ocorrências (Cyanophyta e Chlorophyta) para a ficoflora planctônica no Rio Grande do Sul, Brasil. Hoehnea, 16:57-64. Torgan, L. C. & Garcia, M. 1990. Ocorrência de Skeletonema subsalsum (A. Cleve) Bethge (Bacillariophyta) no sul do Brasil e suas implicações taxonômicas e ecológicas. Acta Limnol. Brasil., 3:439-457. Torgan, L. C.; Barreda, K. A. & Fortes, D. F. 2001. Catálogo das algas Chlorophyta de águas continentais e marinhas do Estado do Rio Grande do Sul, Brasil. Iheringia, Sér. Bot., (56):147-182. Torgan, L. C.; Barreda, K. A. & Santos, C. B. 2003. Catálogo das algas Cryptophyta, Heterokontophyta, Dinophyta, Haptophyta e Rhodophyta de águas continentais e costeiras do Rio Grande do Sul, Brasil. Iheringia, Sér. Bot., 58(2):227-250. Torgan, L. C.; Becker, V. & Prates, H. M. 1999. Checklist das diatomáceas (Bacillariophyceae) de ambientes de águas continentais e costeiros do Estado do Rio Grande do Sul, Brasil. Iheringia, Sér. Bot., (52):89-144. Torgan, L. C.; Menegheti, J. & Alves-da-Silva, S. M. 1979. Contribuição ao Estudo de Fitoplâncton do Rio Caí, Rio Grande do Sul, Brasil. In: Congresso Nacional de Botânica, 3, Campo Grande. Anais. São Paulo, SBB. p. 141-150. Torgan, L. C.; Odebrecht, C. & Niencheski, L. F. H. 2000. Variação espacial da estrutura de tamanho do fitoplâncton na laguna dos Patos, RS, Brasil. Atlântica, 22:95-111. Torgan, L. C.; Tundisi, J. G. & Niencheski, L. F. H. 2002. Seasonal variation of planktonic diatoms in Patos lagoon, southern Brazil. In: Jacob, J. org. Proceedings of the 15th International Diatom Symposium. Koenigstein, v. 1, p. 459-470. Torgan, L. C; Garcia-Baptista, M.; Odebrecht, C. & Moller, O. O. 1995. Distribuição vertical do fitoplâncton na laguna dos Patos, Rio Grande do Sul, Brasil (verão de 1986). Acta Limnol. Brasil., 7:67-77. Vélez, E. 1990. Variação sazonal da produção primária, biomassa e composição do fitoplâncton da Lagoa Emboaba, Osório, RS. Monografia (Bacharelado em Ciências Biológicas). UFRGS, Porto Alegre. 121 p. Werner, V. R. 1988. Cianofíceas planctônicas da Lagoa de Tramandaí e da Lagoa do Armazém, Rio Grande do Sul, Brasil. Iheringia, Sér. Bot., (37):33-70. Werner, V. R. 2000. Identificação das cianofíceas presentes em amostra de água proveniente da barragem de captação em Camaquã, RS. Análise expedida n. 03/2000-NVI Porto Alegre: MCN-FZB. 1 p. Werner, V. R. 2002a. Cyanophyceae/Cyanobacteria no sistema de lagoas e lagunas da Planície Costeira do estado do Rio Grande do Sul, Brasil. Tese (Doutorado em Ciências Biológicas – Biologia Vegetal), UNESP, Rio Claro. 363 p. Werner, V. R. 2002b Identificação das cianofíceas presentes em amostra de água proveniente do lago Guaíba, Porto Alegre, RS. Análise expedida n. 02/2002-NVI Porto Alegre: MCNFZB. 1 p. Werner, V. R. & Rosa, Z. M. 1992. Cyanophyceae da Estação Ecológica do Taim, Rio Grande do Sul, Brasil. Rev. Bras. Biol., 52(3):481-502. Werner, V. R. & Sant’Anna, C. L. 1998. Morphological variability in Gloeotrichia natans Rabenhorst ex Bornet et Flahault (Cyanophyceae, Nostocales) from southern Brazil. Rev. Bras. Biol., 58(1):79-84. Werner, V. R. & Sant’Anna, C. L. 2000. A new species of Aphanothece (Cyanophyceae, Chroococcales) from shallow coastal lagoon, South Brazil. Nova Hedwigia, 70:113-125. Yunes, J. S.; Yunes, J.; Matthiensen, A.; Rajab, T. M. A.; Salomon, P.; Chaplin, A.; Flayeh, K. A. M. & Codd, G. A. 1998a. Microcystis aeruginosa growth stages and the occurrence of microcystins in Patos lagoon, Southern Brazil. In: VIII International Conference On Harmful Alge, Vigo, Espanha. p. 18-21. Yunes, J. S.; Salomon, P. S.; Niencheski, L. F; Rajab, T. M. A.; Chaplin, A.; Flayeh, K. A. M. & Codd, A. G. 1998b. Effect of nutrient balance and physical factors on blooms of toxic Cyanobacteria in the Patos Lagoon, southern Brazil. Ver. Internat. Verein. Limnol., 26:1796-1800. Divisão Cyanophyta Táxons BT LC Bio Obs x x x pt dt A A A. cf. solitaria Anabaena sp. x x os, pt R Aphanizomenon issatschenkoi Aphanocapsa delicatissima x et A A Anabaena crassa A. aff. inaequalis A. hosaltica A. koordersi x x Aphanothece minutissima A. cf. minutissima A. smithii A. stagnina x x x et A A x x ot, mt A R x x mt, et et A R Calothrix sp. Chroococcus dispersus x x ot, mt R A C. limneticus C. minimus x x et ot, mt A A C. turgidus Coelosphaerium sp. x x ot A RS Cyanodictyon imperfectum C. cf. imperfectum x x mt, et R R C. tubiforme Cyanothece aeruginosa x x et ot RS RS Cylindrospermopsis raciborskii Cylindrospermum stagnale x x et, pt A RS Eucapsis sp. 1 Eucapsis sp. 2 x Geitlerinema amphibium G. splendidum x x Gloeotrichia longicauda Gomphosphaeria aponina x x x x Merismopedia cf. angularis M cf. elegans x x M. glauca M. tenuissima x x M. aff. smithii M. wesenbergii x Microcystis sp. Nostoc cf. piscinalis x Nostoc sp. Oscillatoria limosa O. princeps Phormidium autumnale P. aff. chalybea RS RS ms, pt ms A A ot, mt RS A et RS A x Hapalosiphon arboreus Leptolyngbya perelegans Microcystis aeruginosa M. protocystis x x RS R x x x ot et A A x x et, pt mt, et A A x mt, et et A A RS RS x x x x x et, pt RS A et A RS ms RS x x Nova Continua 123 Apêndice I. Lista de espécies da ficoflora registradas nas regiões da Lagoa do Casamento e dos Butiazais de Tapes (Planície Costeira do Rio Grande do Sul). Morfoespécies pertencentes ao mesmo gênero são indicadas por numeração seqüencial e, quando ocorrem na mesma região, listadas em uma única célula da tabela. Bio = biondicação (saprobidade, os = oligossapróbia, ms = mesossapróbia, ps = polissapróbia; nutrientes, ot = oligotrófica, mt = mesotrófica, et = eutrófica, dt = distrófica; toxicidade, ptox = potencialmente tóxica); distribuição no Rio Grande do Sul (A = ampla; R = restrita; RS = primeiro registro para o Estado); nova = possivelmente nova para a ciência. Divisão Táxons BT P. granulatum Phormidium natans Phormidium sp. Bio x x Planktolyngbya contorta P. limnetica Planktothrix mougeotii Planktothrix cf. mougeotii x x ms x x ot, et et, pt x x Obs x ot, et ot, mt, et Cyclotella sp. 2 Diadesmis confervacea x x A RS Trichodesmium lacustre Número total de táxons x 21 mt, et, pt A 50 Achnanthes cf. grischuna A. locus vulcani x x x x Actinella guianensis Actinocyclus normanii f. subsalsa D. contenta Diploneis subovalis x x E. silesiacum E. cf. spiculum var. spiculum A R Eunotia asterionelloides E. camelus x x R R x R A E. didyma var. didyma E. didyma var. pseudogibosa x x A A x x A A E. indica var. indica E. lineonata A. granulata var. granulata x os, ms, ot, et A E. cf. monodon E. pyramidata var. pyramidata f. pyramidata E. pseudoindica x R x x x B. calcicola B. subrostrata x B. vitrea Caloneis westii x A A x x RS RS ot, et os, ms, A A ot, mt C. bacillum x x x E. cf. silesiacum E. sudetica x x E. vumbae E. yanomami x E. zygodon var. zygodon Eunotia sp. 1, 3, 5, 9, 10, 11, 12, 15 x x Eunotia sp. 4, 7, 13 Eunotia sp. 8, 17, 18, 22 x RS et R A Fallacia auriculata F. pygmaea Cocconeis fluviatilis var. fluviatilis C. placentula var. euglypta x x os, mt, et A A Fragilaria crotonensis var. oregona F. fragilarioides x x C. placentula var. lineata x os, ms, ot, et A F. javanica F. cf. neoproducta x ms, et os, et R R Craticula cuspidata var. cuspidata Cyclostephanos dubius x x x F. vaucheriae Fragillaria sp. Continua 124 x x A A A A x x os, ot, et A A x ot A A A x A x x x x ot, et ot, mt x E. praerupta var. bidens E. praerupta var. tridentata x C.budensis Capartogramma crucicula RS A RS os, dt ms, et Aulacoseira sp. 1 Brachysira brebissonii os, ms, RS x x x x x x R x x A. ambigua f. spiralis A. distans A .nyassensis Aulacoseira sp. x x os, ms, ot, et x E. flexuosa E. incisa x x x A R E. frequentis Encyonopsis sp. A R A.granulata var. angustissima A .herzogii x x A R R Encyonopsis cf. difficiliformis os, et x x ms Nova ot et x x Aulacoseira agassizii A. ambigua x Encyonema cf. mesianum RS RS os, ms A C. stelligera A A et, pt mt x x Obs os, ms, x x Achnanthes sp. Achnanthidium minutissimum Bio x x A A Stigonema sp. 1 Stigonema sp. 2 LC Cyclostephanos sp. 2 Cyclotella meneghiniana mt, et, pt x x BT A A RS x Táxons x et, pt mt Snowella lacustris Spirulina laxissima f. major Divisão Cyclostephanos sp. A x Nova A et Pseudanabaena catenata Radiocystis fernandoi Bacillariophyta LC R RS R n x x x x n n ms, et RS R x R R x A R x ms, ot, et A x Continua Divisão Táxons Frustulia cf. marginata F. pangaea F. cf. rhomboides BT LC x x Bio Nova os, ot, dt x x x A A F. undosa Geissleria aikenensis x x x RS Táxons N. pseudofonticola x x os, ot, et os, ms, A A Nitzschia sp. Nitzschia sp. 1 a 5, 11, 16 a 18, 22, G. cf. pseudoaugur x ot, et et G. turris var. turris Gyrosigma obscurum var. obscurum x x Gyrosigma sp. 2 Hantzschia amphioxys x x os, ms, x Kobayasiella bicuneus Kobayasiella sp. x Lemnicola hungarica Luticola cf. saxophyla x x x Luticola sp. 1, 2 Melosira varians Navicula cryptocephala N. cf. heimancioides x x x x N. cf. leptostriata N. cf. menisculus var. menisculus x x x N. rostellata N. schroeteri x x Naviculadicta sp. x Neidium sp. 1, 3 Neidium sp. 2 x x os, ps, A x x RS x x R R x x x x x A P. acrosphaeria P. biceps x x ot, et os, ms R P. brevicostata var. sumatrana P. certa x x RS RS os, ms RS A P. complexa var. minor P. divergens var. subcapitata x x RS A os, ms A x x R RS os, ms, et A os, ps, et P. divergens var. undulata P. franciscana os, ms ms, ps, x x x R ot os, ot A R P. cf. gibba x os, ms, ot, et A A RS P. hemiptera P. kraeuselii x x ot A RS RS R P. latevittata P. latevittata var. domingensis x x ot RS A P. cf. montgomeryana P. cf. neomajor x x P. nobilefasciata P. cf. oominensis x x P. pinedana var. attenuata P. polyonca var. similis x x x RS RS x x x RS RS x x RS RS RS RS n n RS RS ms, ps A N. brevissima N. cf. filiformis x x ms et A A P. rhombarea var. variarea P. rostratissima x N. gracilis N. hantzschiana x x ot, et os, mt, et A A P. saprophila P. cf. saprophila x x N. cf. Ignorata N. intermedia xx ot, et A R P. tabellaria var. P. subcapitata var. elongata x os, ms, ot, et A P. tabellaria P. viridis x x Pinnularia sp. 9, 10, 14 x x R RS RS A x P. pseudogibba P. rhombarea var. rhombarea x x 27 e 35) Nupela sp. 2 Pinnularia abaujensis var. linearis x x n (spp. 27 e 35) A R x x N. lorenziana N. nana RS (spp. x Nitzschia agnewii N. amphibia x R RS Nupela sp. 1 et Nova RS A A ot, et N. cf. linearis ms ms, et 25 a 29, 35 x x x x x N. subacicularis N. tubicola Hippodonta capitata Obs x A A x x Bio N. scapelliformis N. sigma ms, mt, et G. gracile var. gracile G. parvulum LC N. cf. pumila N. cf. reversa x x Gomphonema affine G. augur var. augur BT ot, et RS A F. rhomboides var. rhomboides F. rhomboides var. elliptica Divisão N. palea RS x x Obs RS RS x x RS R os, ms, RS A mt, et A A Continua RS n Continua 125 Divisão Táxons BT LC Placoneis sp. e sp 2 Planothidium apiculatum x x Planothidium sp. 1 a 4 Pleurosira laevis var. laevis x x Rhopalodia brebissonii R. gibba var. gibba x x Bio Obs Nova Divisão X RS n X RS RS ms, et RS A X X X X X X A A os, ms, R A P. gatunense P. umbonatum cf. Peridinium Thompsodinium intermedium X X X RS RS Woloszynskia neglecta Número total de táxons X 9 X 8 RS X X R R R R Sellaphora laevissima S. seminulum x x ps, ms, RS A S. pupula x ot et os, ps, R x ot, et ms, ot, et x S. longirostris Staurosira sp. x x Staurosirella cf. pinnata S. cf. leptostauron x x Staurosirella sp. Stenopterobia delicatissima x x x S. planctonica S. schweickerdtii x x Stenopterobia sp. 3 e 4 Stephanodiscus lucens x os, ms, et os, et os, ot X X X X Euglena acus var. acus E. acus var. longíssima X X ms X A A E. ehrenbergii var. ehrenbergii E. limnophila var. limnophila X X X ms R A A RS E. mutabilis var. mutabilis E. oxyuris var. oxyuris f. oxyuris X X X os os, ms A A E. sanguinea E. spirogyra var. spirogyra X X X X ms ms R A E. spirogyra var. fusca E. splendens X X X X ms A A E. tripteris var. tripteris Euglena sp. 1, 5 a 7, 9 X X X ms A Euglena sp. 2, 3, 8, 10, 11 Euglena sp. 4 X X X cf. Gyropaigne sp. 1 Heteronema sp. 1 X X X RS RS Hyalophacus ocellatus L. fusiformis var. fusiformis X X X R A L. ovum var. ovum L. ovum var. dimidio-minor X X X A A L. salina var. salina Lepocinclis sp. 1 a 5 X X X A X RS A A R R R RS R x os, ps, mt, et A S. guatemalensis S. minuta x x os A RS S. minuta var. peduliformis S. rumrichorum x Urosolenia eriensis var. morsa Número total de táxons n RS RS x x x x Thalassiosira sp. e sp. 1 Tryblionella victoriae Ulnaria ulna n n RS R x x os, ms, et X cf. Gymnodinium X n Lepocinclis sp. nov. Phacus acuminatus var. acuminatus X RS P. agilis var. okohojiense P. anomalus X X R A x 183 R P. caudatus var. caudatus P. contortus var. contortus X X R A X X A RS X X A A X X A A RS os, ps, ot, et P. curvicauda var. curvicauda P. gigas var. gigas P. hamatus var. hamatus P. horridus var. horridus R Continua 126 X X ms Nova A X X x Durinskia baltica Gymnodinium sp. RS RS ms, ps P. acuminatus var. cf. acuticauda P. aenigmaticus x x 91 Anisonema prosgeobium Astasia sp. Entosiphon sulcatum Entosiphon sp. 1 Surirella cf. angusta Synedra sp. 4 e 6 Thalassiosira weissflogii Dinophyta os, ms, mt, et x Surirella sp. Synedra sp. Euglenophyta RS RS x x Obs Peridinium willei P. cf. lomnickii RS Staurosira construens Bio Katodinium sp. x x LC n R. operculata Stauroneis sp. 1 Stauroneis sp. 2 BT RS R mt, et Stauroneis cf. phoenicenteron Táxons n R R Continua Divisão Táxons LC Bio P. longicauda var. longicauda X ms P. longicauda var. major P. longicauda var. tortus X X R A X X A A X X A R P. mariae var. mariae P. megapyrenoides P. onyx var. onyx P. onyx var. simetrica BT X X P. orbicularis var. orbicularis P. cf. pleuronectes X X P. cf. polytrophos P. cf. pseudonordestii X P. cf. pyrum var. pyrum P. raciborski var. raciborskii X P. raciborskii var. longus P. cf. rudicula X ms ms Obs X X A A X X R R P. suecicus var. suecicus P. undulatus var. undulatus X X A A P. cf. unguis Phacus sp. nov. X X R RS Phacus sp. 1 a 4, 6, 12, 13, 15, 16 Phacus sp. 5, 9 X X X Phacus sp. 7, 8, 10, 11, 14 Scytomonas sp.1 X X X RS Scytomonas sp. 2 cf. Sphenomonas sp. X X RS RS Strombomonas borysteniensis S. ensifera var. ensifera X X A A S. fluviatilis var. fluviatilis S. girardiana var. girardiana X X S. scabra var. scabra S. scabra var. ovata f. minor X X Strombomonas sp. 1, 3, 4 Strombomonas sp. 2 X X X X X X Trachelomonas abrupta var. minor T. acanthophora var. acanthophora X X T. acanthophora var. minor T. armata var. armata X X T. armata var. armata f. inevoluta T. armata var. longispina T. hemisphaerica var. hemisphaerica T. hispida var. hispida A A Chlorophyta A R X X X X A A T. armata var. steinii T. cervicula var. cervicula X X X A A T. cf. curta var. curta T. curta var. minima X X X X A A T. dangeardiana var. glabra T. dastuguei var. dastuguei X X X A A Obs X A R RS A X T. hispida var. coronata T. hispida var. crenulatocollis X X X A A T. hispida var. duplex T. intermedia var. intermedia X X X X A A T. intermedia var. minor T. cf. kelloggii X X X R A X X A A X X A A T. cf. planctonica var. flexicollis T. pulcherrima A A Bio X X X T. cf. oblonga var. oblonga T. oblonga var. attenuata n LC X X T. megalacantha var. megalacantha T. megalacantha var. crenulatocollis A A ms BT T. cf. lacustris T. lemmermanii var. acuminta A A ms Táxons T. decora var. decora T. cf. granulata var. granulata A A A A S. triquetra var. torta S. verrucosa var. verrucosa Divisão A X X ms Nova X X X X ms ms A A X X A A T. pulcherrima var. latior T. raciborskii var. nova f. nova X X R RS T. robusta var. robusta T. rugulosa var. paralella X X A A X T. sculpta T. similis var. spinosa X X X A A T. stokesi var. stokesi T. superba var. superba X X X R R T. varians var. varians T. volvocina var. volvocina X X X R A T. volvocina var. derephora T. volvocina var. punctata T. volvocinopsis var. volvocinopsis T. woycickii var. woycickii ms Nova X X X A A X X X X A R T. zingueri var. zingueri Trachelomonas sp.1 a 6, 8, 9, 11-14 X X X R Trachelomonas sp. 7, 10 Trachelomonas sp. nov. X Número total de táxons Actinastrum hantzschii var. subtile 64 Ankistrodesmus bernardii X RS 150 X RS X X R A. bibraianus A. fusiformis X X X X A. gracilis Botryococcus braunii X X X X X X X A A X R n Chlorophyceae Coelastrum astroideum C. pulchrum C. pulchrum var. cruciatum Continua ms os, ms A A A A Continua 127 Divisão Táxons BT C.sphaericum X Coelastrum sp. Crucigeniella crucifera X Desmodesmus abundans D. brasiliensis X X D. communis D. denticulatus var. linearis X X ms X X ms Nephroclamys subsolitaria Nephrocytium agardhianum X R R Closterium sp. 3, 5, 9, 10 a 11, 27 Cosmarium angulosum A R A A RS ms A A RS X X A RS X A R X X X N. lunatum Nephrocytium sp. X X X X M. tortile Monoraphidium sp. X X ms X RS A A os R R X X R P. duplex P. duplex var. cohaerens X X X P.simplex P. tetras X X X X Quadrigula closterioides Raphidocelis sigmoidea X X X Scenedesmus acuminatus S. obtusus X Scenedesmus sp. Sorastrum americanum X X X ms ms ms X X X X Número toal de táxons por área Actinotaenium cucurbita 30 X 43 Bambusina brebisonii X X A A A A A A RS RS ms A R X X A R C. bioculatum C. comissurale var. crassum X X R A C. constrictum C. denticulatum var. denticulatum X X RS C. elegantissimum C. formosulum X X R RS C. impressulum C. laeve X X X RS R X X A R X R RS C. polygonum var. depressum C. psedoconnatum X X RS A C. pseudoexiguum C. pseudopyramidatum X X R A X X A A C. quadratulum C. quadrum X X R R C. rectangulare C. rectum X R RS C. regnellii C. regnellii var. minimum X X R R C. regnesii C. subcostatum X X A RS C. subcostatum var. minus C. subcrenatum X X RS RS C. subtumidum var. circulare C. trilobulatum X X RS R Cosmarium sp. 1, 17 Cosmarium sp. 2, 4 a 8, 10, 13, 14, 16, X X X X X Nova X X 19, 21, 22, 24, 30, 31, 34, R ms R C granatum C. baileyi C. pyramidatum C. pyramidatum var. pyramidatum X X X Tetraedron minimum Tetrallantos lagerheimii Obs X X C. pachydermum C. phaseolus var. elevatum A R RS R X C. nitidilum C. ornatum X Pediastrum angulosum P. boryanum Bio X X X LC Closterium sp. 2, 4, 6 a 8, 14, 15, 19 a 26, 28 a31 X X Lobocystis planctonica Monoraphidium contortum BT A Dictyosphaerium ehrenbergianum D. pulchellum X Táxons X X K. lunaris K. pseudoaperta Divisão X X X X Kirchneriella contorta K. contorta var. gracillima Nova Closterium kuetzingii C. setaceum D. perforatus Desmodesmus spp. X Obs A X Dimorphococcus lunatus Keratococcus cf. suecicus Bio X D. intermedius D. maximus D. sphagnale Dictyosphaerium sp. Chlorophyta- LC 35, 38, 1, 44, 45 A A Cosmarium sp. 46 Cosmocladium sp. 1 X R Cosmocladium sp. 2 Cylindrocystis brebisonii X X R Cylindrocystis sp. 1 Zygnematophyceae Continua 128 X RS X RS R X R Continua Divisão Táxons BT Cylindrocystis sp. 2 Desmidium cylindricum X X Desmidium sp. 1 Desmidium sp. 2 X X LC Bio Obs A A Euastrum ansatum E. binale X X A A E. denticulatum E. elegans X X E. evolutum E. evolutum var. integrius X X R RS X X R Euastrum sp. 10 a 12, 2, 6 Euastrum sp. 3, 7 X os X X R R M. laticeps var. laticeps M. pinnatifida M. radians X A RS R M. radiosa M. truncata var. truncata X R X X X os X X os X X Octacanthium mucronulatum Pleurotaenium nodosum X X R RS X R Pseudostaurastram lobulatum Sphaerozosma laeve X X X Spirogyra sp. 2 e 3 Spirotaenia condensata X Spondylosium sp. 1 e 2 Staurastrum alternans S. dilatatum S. leptocladum X X R A X X X X Xanthidium antilopeum Zygnema sp. X Número total de táxons Número total geral de táxons A X X X R X R RS X RS X X R A X X X X X X X X X Staurodesmus sp. 1 Teilingia granulata X Sphaerozosma sp. Spirogyra sp. 1 Spondylosium pulchellum S. pulchrum S. setigerum S. teliferum A A Mougeotia sp. 3 a 5 Netrium sp. 1 e 2 Pleurotaenium sp. 2 Pleurotaenium sp. 4 A R A S. validus Staurodesmus sp., sp. 3 a 9 os X Obs X X S. dickiei S. triangularis os Mesotaenium sp. 2 Micrasterias laticceps var. acuminata P. ovatum var. tumidum Pleurotaenium sp. 1, 3 X Bio X Staurastrum sp. 12, 33, 34 Staurodesmus convergens R X X LC S. cuspidatum var. cuspidatum S. dejectus var. apiculatus Hyaloteca sp. 2 Mesotaenium sp. 1 Mougeotia sp. Mougeotia sp. 1 e 2 BT S. quadrispinatum var. spicatum S. rotula 20 a 32, 35 Staurastrum sp. 7, 19 A X X X Táxons Staurastrum sp. Staurastrum sp. 1 a 6, 8 a 11, 13 a 18, X Gonatozygon sp. 1 a 7 Hyaloteca sp. 1 Divisão S. quadrangulare R A X E. germanicum Euastrum sp. Nova X Continua 129 X RS X X RS R X X A A X X RS X X X 55 270 188 622 A os A R Nova
Download