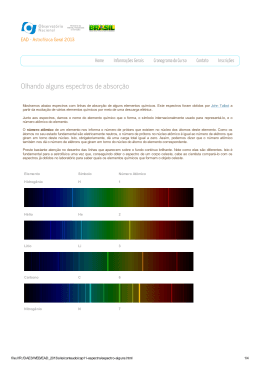
Uma nova visão da luz: construa o seu próprio espectrómetro Traduzido por Paulo Santos Ramos Arranje um CD e uma caixa de cereais, e o que obtém? Com uma pequena ajuda de Mark Tiele Westra, o seu próprio espectrómetro! È tempo de explorar as maravilhas da cor, escondidas no mais prosaico dos objectos. A luz branca não é realmente branca consiste em várias cores diferentes. A composição da cor o seu espectro – pode ser estudado por um dsipositivo chamado espectrómetro. Neste artigo, descrevemos como pode construir um espectrómetro completamente funcional com pouco mais que uma caixa de cereais e um disco compacto. Vamos usar este instrumento caseiro para entrar no maravilhoso mundo das cores escondidas atrás dos objectos do dia-adia, como lâmpadas incandescentes, lâmpadas fluorescentes, monitores de computador e a luz de velas. Vamos explorar! Como separar a luz Existem várias maneiras de separar a luz nas suas diferentes cores. Uma forma é usar um prisma, tal como Newton fez. Devido ás variações no índice de refracção, as diferentes cores seguem diferentes caminhos através do prisma, levando á separação das cores. Outra forma é usar uma rede de difracção, que consiste num numero elevado de pequenos sulcos, colocados paralelamente uns aos outros numa superficíe, tal como se mostra a seguir. A interacção destes pequenos sulcos com as ondas de luz conduzem a que as diferentes cores sejam reflectidas em diferentes direcções. Um prisma separa a luz branca nas suas cores Uma ampliação de 6250X constituintes da supeficie de um disco compacto Imagem cedida por Mark Tiele Westra Imagem cedida por Mark Tiele Westra IÉ uma sorte que toda a gente tenha uma rede de difracção de alta qualidade em casa: os discos compactos (compact disc CD). As bonitas cores que podem ser vistas quando a luz reflecte na superfície de um CD, são uma clara indicação de que este funciona como uma rede difractora. Mas porquê? A ilustração em cima mostra o aspecto que uma grande ampliação da superfície dum CD deverá apresentar. Construindo um espectrografo Pode-se aproveitar estas redes de difracção caseiras para construir o nosso próprio espectrómetro. Este é constituído por dois elementos importantes: um CD, o qual separa a luz nas suas diferentes cores, e uma pequena fenda no lado oposto da caixa, a qual produz um feixe estrito de luz. A fenda é feita num dos lados da caixa usando papel grosso e fita adesiva. Um Construção de um modelo mais básico pode ser feito usando espectrómetro numa caixa as duas lâminas de uma máquina de barbear descartável, que são colocadas de cereais. O CD é viradas com as faces afiadas viradas uma colocado num ângulo de para a outra, como se mostra na figura. Se 60ºem relação ao fundo a fenda for demasiado larga, o espectro será difuso, e se for demasiado estreita, o da caixa espectro será demasiado ténue. Uma Imagem cedida por Mark abertura de 0.2 mm deverá funcionar bem, mas o melhor é experimentar. A qualidade Tiele Westra do espectro obtido é dependente da qualidade da fenda, mas o melhor portanto esta deverá ser feita com cuidado. No lado oposto da caixa, é montado um CD (o autor usou um CD-RW vazio) a um ângulo de 60º com o fundo da caixa. No cimo, é aberto um orifício, através do qual se observa o CD. A luz de fundo é removida da caixa, tapando todos os pequenos orifícios á volta do CD, bem como os lados do CD, com fita preta. Para observar um espectro, a fenda é dirigida para uma fonte de luz (quanto mais próxima melhor), e o investigador observa através do orifício no topo da caixa. Mova a caixa um pouco para procurar o melhor ponto de observação. Fotografias do espectro observado podem ser obtidas com uma câmara digital, com funcionalidade “macro” para focagem de proximidade, acoplada à caixa com fita adesiva. A câmera deve ter preferencialmente focagem manual, uma vez que pode ser difícil obter espectros bem definidos com a focagem automática. O espectrómetro construído pelo autor. A imagem inferior direita mostra a fenda feita com lâminas de barbear Imagem cedida por Mark Tiele Westra Medições È hora de experimentar! A nossa primeira tentativa é observar o espectro duma lâmpada incandescente comum. O resultado é mostrado em baixo. Espectro duma lâmpada inandescente Imagem cedida por Mark Tiele Westra Podemos observar, todas as cores do arcoíris. Numa lâmpada incandescente, a luz é produzida por um filamento muito quente de metal. Em seguida, observámos duas lâmpadas fluorescentes diferentes, ambas emitindo luz branca. A primeira, que é uma lâmpada fluorescente corrente, mostra um nº de linhas finas contra um espectro de fundo contínuo. Estas linhas de emissão (ver texto em baixo) são produzidas por vapor de mercúrio de baixa densidade num tubo. O mercúrio também produz luz ultravioleta, a qual é transformada num espectro Espectro duma lâmpada contínuo de luz visível por uma fina camada fluorescente comum de fósforo no interior do tubo. Imagem cedida por Mark Tiele Westra A segunda lâmpada fluorescente (ver em baixo) mostra um espectro diferente. A razão é que os fabricantes podem variar a cor da luz usando diferentes combinações de fósforo. A lâmpada ilustrada usa um tipo de fósforo que emite um espectro contínuo, mas este tipo usa um chamado fósforo de três cores: isto é uma combinação de três tipos de fósforo, cada qual tem o seu próprio leque de linhas de emissão. O que observamos é o resultado desta mistura como a cor branca. Espectro de uma lâmpda fluorescente que usa fósfor de três cores. Devido á sobre exposição da câmara, algumas das linhas parecem ter uma cor diferente daquela que realmente apresentam. A linha amarelo brilhante na zona vermelha do espectro deveria aparecer como vermelha também Imagem cedida por Mark Tiele Westra Uma pequena secção do monitor de um computador portátil mostrando um documento do Word em branco produz o espectro apresentado em baixo. As três cores dos pixeis que compõe a imagem – vermelho, verde e azul- são perfeitamente distinguíveis. Espectro do monitor de um portátil Imagem cedida por Mark Tiele Westra Como se forma o espectro Alguns dos espectros que podem ser observados com o espectrómetro na cixa de cereais, tem uma radiação de fundo, com as cores a variar suavemente de um vermelho escuro até um azulescuro. Outros consistem em linhas finas num fundo contínuo, linhas finas sem fundo, ou até linhas escuras num fundo contínuo, tal como no espectro solar (ver em baixo). Porquê esta diversidade? Como são formados os espectros? È tudo graças aos átomos. Um átomo individual pode estar em diferentes estados de energia, dependendo se os seus electrões ocupam as orbitais no estado normal ou foram excitados para orbitais de energia mais alta. Um átomo não pode assumir uma energia qualquer: a energia está finamente definida, ditada pelos detalhes da estrutura atómica. Quando um electrão salta duma orbital para outra, a mudança corresponde a uma quantidade precisa de energia a qual é emitida na forma de um único fotão. A energia dos fotões emitidos determina a sua cor. Porque são possíveis muitos saltos diferentes, cada átomo pode emitir uma gama diferente de cores. Se a sua luz é separada por um prisma ou rede de difracção, cada cor é visível como uma linha de emissão no espectro, a qual é designada por linha espectral. Uns grãos de sal de cozinha são submetidos à chama de uma vela Para demonstrar a formação de uma linha de emissão, vamos vero que acontece quando o sal comum das cozinhas (cloreto de sódio NaCl) é colocado numa vela acesa. As imagens de cima mostram o espectro contínuo da chama, idêntico ao de uma lâmpada incandescente. Quando uns grãos de sal são colocados na ponta duma faca e submetidos á chama da vela, aparece uma linha laranja distinta no espectro, a qual corresponde á linha de emissão do sódio (Na a 589 nm). produzindo a linha de emissão do sódio Imagem cedida por Mark Tiele Westra Um átomo não só emite luz, com também absorve fotões da mesma energia com que emite. Se uma luz passar através de uma nuvem de átomos, de baixa densidade e fria, os átomos absorvem frequências específicas causando linhas negras no espectro, as quais são chamadas de linhas de absorção. Os três tipos de espectro e a sua origem. Sólidos, fluidos e gases a lata pressão emitem um espectro contínuo (cimo). Um gás de baixa densidade (meio) emite um espectro em linhas. Finalmente, quando a luz com um espectro contínuo passa através de um gás de baixa densidade a frio, absorvem cores especificas, deixando linhas negras no espectro de absorção. Click to enlarge image Imagem cedida por Mark Tiele Westra Mas se todos os espectros são formados por átomos emitindo cores finamente definidas, como são formados os espectros contínuos? Para um único átomo, não afectado por factores externos, as linhas são de facto finas. Este é o caso de um gás de baixa densidade tal como numa lâmpada fluorescente. Num gás a alta pressaõ, tal como no Sol, e também em fluidos e sólidos, há colisões frequentes e muitos outros mecanismos que fazem com que as linhas percam a sua definição e se tornem difusas, levando a um espectro contínuo. Os três tipos de espectro estão sumariados na ilustração seguinte. Diferentes átomos (e moléculas) têm diferentes espectros de emissão e absorção. Esta diferença pode ser explorada: basta observar a luz que vem de um objecto distante, por exemplo o Sol ou uma estrela, e então podemos dizer que elementos estão presentes. Na Terra esta técnica é usada fazendo passar luz através de uma amostra (muitas vezes um gás) e medir o espectro de absorção, a partir do qual a composição da amostra pode ser concluída. O espectro solar Levando o nosso espectrómetro para o exterior, podemos observar o espectro da luz do sol. O espectro, que se mostra em baixo, parece contínuo à primeira vista. Mas se olharmos melhor, várias linhas escuras podem ser observadas, as quais são causadas pela absorção de frequências especificas de luz por átomos das camadas exteriores do Sol, e na atmosfera terrestre. A imagem em baixo não faz justiça ás reais capacidades do nosso espectrómetro na caixa de cereais: a olho nú as linhas de absorção podem ser vsitas com muito mais detalhe. As linhas de absorção que foram observadas no espectro solar têm um nome: linhas de Fraunhofer. Joseph von Fraunhofer (1787-1826) foi o primeiro a fazer um estudo sistemático e medidas cuidadosas destas linhas negras, apesar dele não ter sido o primeiro a observálas. Ao todo, catalogou mais de 570 linhas, as quais categorizou e nomeou. O espectro do Sol tal como pode ser visto no espectrómetro na caixa de cereais. As linhas correspondem a: (1) hidrogénio a 656 nm, (2) sódio a 589 nm, (3) ferro a 527 nm, (4) magnésio a 518 nm, (5) hidrogénio a 486 nm, e (6) ferro e cálcio a 431 nm. Click to enlarge image Imagem cedida por Mark Tiele Westra Por volta de 1860, Kirchoff e Bunsen descobriram que cada elemento químico está associado a um conjunto de linhas espectrais. Deduziram que as linhas de Fraunhofer no espectro solar eram causadas pela absorção de cores específicas nas camadas exteriores do Sol. Algumas das linhas eram igualmente causadas pela absorção de luz pelos átomos da atmosfera da Terra, tal como o oxigénio. Os estudos destas linhas eventualmente levaram á descoberta do elemento hélio no Sol, o que foi a prova definitiva de que o Sol é alimentado por fusão nuclear. Uma versão de alta resolução do espectro solar, mostrando uma grande multitude de linhas de Fraunhofer. Os comprimentos de onda aumentam da esquerda para a direita, e de baixo para cima. Click to enlarge image Imagem cedida pelo National Optical Astronomy Observatory/Association of Universities for Research in Astronomy/National Science Foundation Agradecimentos Estou em divida com Xiaojin Zhu da University of Wisconsin-Madison, cuja página web, me forneceu toda a informação de que necesitava para construir o meu próprio espectrómetro e para interpretar os resultados. Nesta página estão disponíveis mais espectros. Agradeço também a Bartjan van der Meer, que me pôs no trilho deste fantástico projecto de ciência Opinião Este artigo descreve uma experiência manual muito interessante que pode ser facilmente replicado na aula ou em casa. O espectrómetro é construído a partir de materiais comuns e é usado para mostrar a composição das cores da luz branca e para comparar o espectro de várias fontes. De particular interesse é a resenha histórica da descoberta do espectro da luz do Sol e como este foi usado para identificar a composição dos seus gases. O artigo liga a física á química e deve ser interessante tanto par estudantes do ensino secundário como universitário. Gaetano Bugeja, Malta Fontes Artigo na Wikipedia sobre o espectro do visivel Informação geral sobre espectros Artigo na Wikipedia sobre escpectro electromagnético Artigo na Wikipedia sobre espectrscopia Artigo na Wikipedia sobre as linhas de Fraunhofer Artigo na Wikipedia sobre linhas de emissão Mark Tiele Westra é o Public Information Officer no FOM-Institute for Plasma Physics Rijnhuizen, Holanda. Issue 4 Physics Portuguese Teaching activities Source URL: http://www.scienceinschool.org/2007/issue4/spectrometer/portuguese
Download