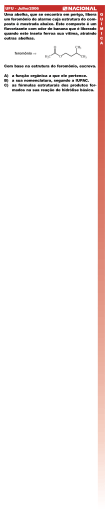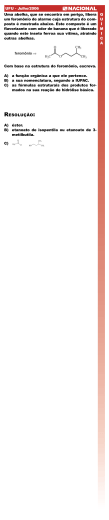PROVA 2 – ÁREA 2
FÍSICA
QUESTÃO 1
A figura mostra a polia A, de raio R A = 10 cm, ligada à polia B, de raio R B = 5 cm, por uma correia que não desliza enquanto gira.
Baseandose nesses direcionamentos, analise as RA
RB
afirmativas:
I. A velocidade tangencial da polia A é exatamente igual à metade da velocidade tangencial da polia B.
II. Se o período da polia A for igual a 1s, o período da polia B será 0,5s.
III. A velocidade angular da polia A (ωA) é igual à velocidade angular da polia B (ωB).
Assinale a alternativa que apresenta a(s) afirmativa(s) correta(s):
a)
b)
c)
d)
e)
I
II
III
I e III
I, II e III
QUESTÃO 2
Ao revisar seus estudos sobre as leis da gravitação de Kepler e de Newton, um estudante encontrou as seguintes anotações:
I. A atração gravitacional entre dois planetas é inversamente proporcional à quarta potência da distância entre eles.
II. A aceleração da gravidade de um astro na proximidade de sua superfície depende de sua massa e do seu raio.
III. A melhor figura que representa as órbitas de um planeta do nosso sistema solar é um círculo.
Assinale a alternativa correta:
a)
b)
c)
d)
e)
I
II
I e II
I e III
II e III
QUESTÃO 3
Um carro parte do repouso em uma trajetória retilínea sofrendo ação de uma força que, em função do deslocamento, tem o seguinte comportamento:
F(N)
100
d(m)
0
100
200
300
Com base nesses dados, podese dizer que o trabalho realizado pela força F no deslocamento de 0 a 300m é de:
a)
b)
c)
d)
e)
5,0x104 J
4,0x104 J
3,5x104 J
3,0x104 J
2,5x104 J
QUESTÃO 4
Analise as seguintes afirmações sobre radiação eletromagnética:
I.
II.
III.
Segundo Maxwell, toda onda eletromagnética se propaga no vácuo com uma velocidade c = 3×108 m/s.
Ondas de rádio e de TV são exemplos de radiação eletromagnética
Raiosx não são classificados como ondas eletromagnéticas
Assinale a alternativa correta:
a)
b)
c)
d)
e)
I II III I e II II e III
QUESTÃO 5
Uma certa quantidade de gás ideal realiza o ciclo termodinâmico descrito abaixo.
P (N/m2)
3
1
0
A
B
C
D
1
Com base nessa figura, afirmase que:
I. O trabalho realizado pelo gás num ciclo é 2J.
II. A variação da energia interna do gás num ciclo é 2J.
2
V (m3)
III. Ao completar cada ciclo, há conversão de calor em trabalho.
Das afirmativas acima, a(s) correta(s) é(são):
a)
b)
c)
d)
e)
I
II
I e II
I e III
II e III
QUESTÃO 6
Certa quantidade de gás ideal, contida num recipiente de volume 2 litros, tem uma temperatura de 270C, sob uma pressão de 1,5 atm. Essa mesma quantidade de gás, se colocada num recipiente de volume 1 litro, sob uma pressão de 2 atm, terá uma temperatura de:
a)
b)
c)
d)
e)
630C
730C
830C
930C
1030C
QUESTÃO 7
Com relação à 2ª Lei da Termodinâmica, podese afirmar que:
I. O calor de um corpo com temperatura T1 passa para outro corpo com temperatura T2 se T2 > T1.
II. Uma máquina térmica operando em ciclos pode retirar calor de uma fonte e convertêlo integralmente em trabalho.
III. Uma máquina térmica operando em ciclos entre duas fontes térmicas, uma quente e outra fria, converte parte do calor retirado da fonte quente em trabalho e o restante envia para a fonte fria.
Assinale a alternativa que apresenta a(s) afirmativa(s) correta(s).
a)
b)
c)
d)
e)
I
II
III
I e II
I e III
QUESTÃO 8
Dois pêndulos de comprimentos l1 e l2 oscilam com pequenas amplitudes de tal modo que as duas bolinhas se encontram (sem colidir) sempre que são decorridos 5 períodos do pêndulo menor e 3 períodos do maior. As relações entre os comprimentos l1/l2 e entre as freqüências f1/f2 valem, respectivamente:
l1
a)
b)
c)
d)
3/5 e 5/3
3/5 e 3/5
5/3 e 9/25
9/25 e 5/3
l2
e) 25/9 e 3/5
QUESTÃO 9
Um bebê e sua mãe estão brincando diante de um espelho plano de 1m de largura. Os dois estão no centro do espelho e distantes 1m deste. Calmamente, a mãe começa a se afastar lateralmente de seu bebê. Qual a máxima distância que a mãe pode se afastar de seu bebê para que a sua imagem refletida pelo espelho possa ainda ser vista pelo bebê?
a)
b)
c)
d)
e)
0,5m
1,0m
1,5m
2,0m
2,5m
QUESTÃO 10
O físico Thomas Young (17731829) ficou conhecido principalmente por seus trabalhos em óptica. Com seus experimentos sobre interferência da luz, ficou demonstrado que a luz é:
a)
b)
c)
d)
e)
um fenômeno ondulatório
um fenômeno corpuscular
um fenômeno mecânico
um fenômeno elétrico
uma onda longitudinal
QUESTÃO 11
Três cargas elétricas fixas estão colocadas em vértices alternados do hexágono de lado L, conforme mostrado na figura. Colocase uma quarta carga positiva q no vértice assinalado na figura.
Assinale a alternativa que identifica o vetor força elétrica resultante R sobre a carga q:
a) A
b) B
c) C
d) D
e) vetor nulo
QUESTÃO 12
Utilizando as informações do gráfico a seguir, a capacitância (em µF) e o trabalho (em Joules) necessário para carregar um capacitor de placas planas paralelas, inicialmente descarregado, são, respectivamente:
U (103 V)
3,0
0
a)
b)
c)
d)
e)
3,6
Q (103 C)
1,0 e 6,0
1,0 e 7,2
1,2 e 5,4
3,6 e 5,4
3,6 e 9,5
QUESTÃO 13
Um fio cilíndrico de resistividade ρ e comprimento l tem área de seção transversal igual a A e resistência R. Se o raio da seção transversal desse fio for dobrada, juntamente com seu comprimento, a nova resistência do fio será:
a)
b)
c)
d)
e)
R/2
R
3R/2
2R
5R/2
QUESTÃO 14
Aponte a alternativa falsa:
a) As Leis da Física Clássica (ou Física Newtoniana) se aplicam ao movimento de corpos mensuráveis (“grandes”) e com pequenas velocidades.
b) A Física Moderna surgiu no final do século XIX e início do século XX, principalmente com os trabalhos de Max Planck e Albert Einstein, que explicavam fenômenos que não podiam ser entendidos com as Leis da Física Clássica.
c) A Teoria da Relatividade descreve com maior precisão o movimento de corpos em altas velocidades, próximos à velocidade da luz.
d) Fazendo uma aproximação para velocidades pequenas na Teoria da Relatividade não é possível retornar às Leis da Física Clássica.
e) Para explicar o efeito fotoelétrico, Albert Einstein utilizou o conceito de quantização da energia luminosa (“quantum de luz”) apresentada por Max Planck.
QUESTÃO 15
Utilizando a idéia de quantização de energia (fótons) proposta por Planck, Bohr propôs que os elétrons de um átomo ocupam certos níveis estáveis de energia. Nesses níveis de energia, os elétrons não emitem radiação e, portanto, não perdem energia. Um elétron só passa de um nível de energia mais baixo (E i) para um nível superior (Ek) se absorver do meio externo uma energia E = E k – Ei. Um átomo de hidrogênio tem níveis de energia dados pela equação: En = 13,6/n2 elétronVolts (eV), em que n é um número inteiro e n ≥ 1.
Leia as afirmativas abaixo:
I. O primeiro nível fundamental (n = 1) do hidrogênio tem energia 13,6eV.
II. O primeiro nível de energia excitado do hidrogênio tem energia 1,5eV.
III. O elétron no nível fundamental (n = 1) é excitado até o terceiro nível excitado (n = 4) se receber uma energia de 12,75eV.
Assinale a alternativa correta:
a)
b)
c)
d)
e)
I
II
I e II
I e III
II e III
MATEMÁTICA
QUESTÃO 16
Cinco torneiras idênticas juntas enchem um tanque em 144 minutos. Quantas dessas torneiras são necessárias para encher o mesmo tanque em uma hora e meia?
a) seis torneiras
b) sete torneiras
c) oito torneiras
d) nove torneiras
e) nove torneiras e meia
QUESTÃO 17
tan α
sec α
Sendo A =
a)
sec α
π
com α ≠ + kπ . Quais os valores de α , sabendo que A = A −1 ?
tan α
2
3kπ
, k ∈Ζ
2 −1
b) Não existem valores de α que satisfaçam A = A
c) Todos os números reais
d) kπ , k ∈ Ζ
e)
kπ
, k ∈Ζ
2
QUESTÃO 18
O traço de uma matriz quadrada é definido como a soma dos elementos da diagonal principal. Sendo 1 z 6
A = 0 x 5 , com traço da matriz A igual a 5 e det A = 3 . Os valores de x e y são:
0 0 y
a)
b)
c)
d)
e)
(2,4) ou (4,2)
(3,5) ou (5,3)
(0,2) ou (2,0)
(0,4) ou (4,0)
(1,3) ou (3,1)
QUESTÃO 19
Qual é o maior número que deve ser somado a 1, 9 e 15 para que se obtenha, nessa ordem, três números em Progressão Geométrica?
a) 0
b) 10
c) 23
d) 33
e) –50
QUESTÃO 20
2
Os valores de x que satisfazem a equação log x 2 ( ax + b) = 2 são 2 e 2 . Nessas condições, os respectivos valores de a e b são:
a) 2 e 2
b) 6 e 8
c) 2 e 2
d) 0 e 1
e) − 2 e 2
QUESTÃO 21
Sendo A, B e C três subconjuntos de um mesmo universo, considere os seguintes diagramas e analise as afirmativas I,II,III e IV:
1)
2)
B
B
A
A
C
C
4)
3)
C
A
B
A
B
C
I) A ⊂ B, A ∩ C ≠ φ e C ⊂ B
II) A ⊂ B, B ⊄ A e A ∩ B ≠ φ
III) A ∩ B ≠ φ , A ∩ C ≠ φ e B ∩ C= φ
IV) C ⊂ (A ∩ B), B ⊂ A, C ≠ A e B ≠ A
Podese afirmar que as associações corretas estão descritas na alternativa:
a)
b)
c)
d)
e)
(2, III) e (1, I)
(4, IV) e (3,III)
(1, II) e (3, III)
(2, III) e (1, III)
(1, II) e (4, IV)
QUESTÃO 22
Assinale a afirmação correta: a)
b)
c)
d)
Uma reta e um plano são paralelos. Toda reta perpendicular à reta dada é perpendicular ao plano.
Se uma reta é perpendicular a duas retas distintas de um plano, então ela é perpendicular ao plano.
Uma reta perpendicular a um plano é perpendicular a todas as retas do plano.
Se uma reta é perpendicular a duas retas paralelas e distintas de um plano, então ela está contida no plano.
e) Para uma reta ser perpendicular a um plano é suficiente que ela seja perpendicular a uma reta do plano que passa por seu traço.
QUESTÃO 23
2
Determine o valor de k , de modo que a reta que passa por P ( −1,−1) e Q ( k , k − 2) tenha inclinação α = 45 relativamente ao eixo x .
a) 0
b) 1
c) 2
d) 3
e) 4
QUESTÃO 24
x +1
−x
Sejam as funções reais f ( x) = 3 − 25 e g ( x) = 18 × 3 . Podese afirmar que f e g se interceptam no ponto de coordenadas:
a)
b)
c)
d)
e)
(1,54)
(0,0)
(1,6)
(2,2)
(3,56)
QUESTÃO 25
A melhor representação gráfica da função f ( x) = | x | + | x − 1 | é:
a)
b)
c)
d)
e)
QUESTÃO 26
3
3
3
3
3
2
Se ( x + p ) = x − 4 x + 16 x − 64 , então, podese afirmar que p vale:
0
1
2
3
3
a)
b)
c)
d)
e)
4
2
2
3
4
QUESTÃO 27
2
2
A circunferência de equação γ : x + y − 6 y + 5 = 0 é tangente à reta de equação r : − kx + y = 0, ( k > 0). O valor de k é:
2
a) 2
3
b) 2
5
c) 2
7
d) 2
11
e) 2
QUESTÃO 28
Seja o triângulo ABC de vértices A (r,0), B(0, 0) e C(r, 2r). Se a área do triângulo ABC é igual a 4cm 2, fazendo a rotação da hipotenusa BC em torno do eixo y, obtémse um cone de volume igual a:
8π
cm 3
3
10π
cm 3
b) 3
16π
cm 3
c) 3
a) d) 8π cm 3
e) 32
π cm 3
3
QUESTÃO 29
Seja o número complexo z =
1+ i
. O número complexo z 100 pode ser expresso por:
1− i
a) z = cos( 50π ) + i sen ( 50π )
b) z = cos( 25π ) + i sen ( 25π )
c) z = cos(100π ) + i sen (100π )
d) z = cos(10π ) + i sen (10π )
e) z = cos( π ) + i sen ( π )
QUESTÃO 30
Seja a matriz A = (a ij ) 4×4 , em que 1 se i ≤ j
a ij =
.
0 se i > j
Então, podese afirmar que det ( 2A ) é igual a:
a) 1
b) 2
c) 8
d) 12
e) 16
QUESTÃO 31
2
Os restos das divisões do polinômio P ( x) = x + bx + c por x − 1 e x − 2 são, respectivamente, 2 e 3. Os valores de b e c são:
a)
b)
c)
d)
e)
b = −2 e c = 3
b = 1 e c = 4
b = −2 e c = 1
b = 0 e c = 5
b = 3 e c = 2
QUESTÃO 32
Uma das raízes da equação x 3 − 10 x 2 + 31x − 30 = 0 é igual a 2. O produto entre as outras duas raízes é:
a)
b)
c)
d)
e)
15
31
43
52
67
QUESTÃO 33
Quanto ao sinal da função f ( x) =
x2 − 2x
x3 − 3x 2 + 2 x
a) f(x) > 0 para todo x real tal que x > 0
, podese afirmar que:
b) f(x) < 0 para todo x real tal que x < 2
c) f(x) > 0 para todo x real tal que x > 1 e x ≠ 2
d) f(x) < 0 para todo x real
e) f(x) > 0 para todo x real
QUESTÃO 34
A probabilidade de que um aluno A tire dez numa prova é de 60% e a probabilidade de que um aluno B tire dez na mesma prova é de 30%. A probabilidade de que nessa prova A tire dez e B não é de:
a) 12%
b) 18%
c) 21%
d) 28%
e) 42%
QUESTÃO 35
O conjunto S que melhor representa a região R do gráfico é:
a) S = { ( x, y ) ∈ IR × IR | 1 ≤ x ≤ 4 e 1 ≤ y ≤ 3 }
b) S = { ( x, y ) ∈ IR × IR | 1 ≤ x < 4 e 1 ≤ y ≤ 3 }
c) S = { ( x, y ) ∈ IR × IR | 1 ≤ x ≤ 4 e 1 ≤ y < 3 }
d) S = { ( x, y ) ∈ IR × IR | 1 < x ≤ 4 e 1 < y ≤ 3 }
e) S = { ( x, y ) ∈ IR × IR | 1 ≤ x < 4 e 1 ≤ y < 3 }
QUÍMICA
QUESTÃO 36
O ácido muriático vendido em casas de materiais de construção é uma solução aquosa de ácido clorídrico 12 mol/Litro. Logo, sua concentração em grama/Litro é:
a)
b)
c)
d)
e)
0,33
0,44
3,3
44
438
QUESTÃO 37
O cloreto de polivinila (PVC) é um plástico muito utilizado em produtos domésticos variados, tubos e conexões hidráulicas. O polímero de PVC é um material instável em relação ao calor e à luz que se degrada às temperaturas relativamente baixas (aproximadamente 130oC) com liberação de ácido clorídrico. A reação química de decomposição térmica é representada pela equação:
[CH2CHCl]n(s) → [CH=CH]n(s) + HCl(g)
A respeito da decomposição térmica e a química do polímero PVC, é incorreto dizer que:
a) o PVC é formado por uma reação de polimerização, a partir do cloreto de vinila H2C=CHCl.
b) se o HCl liberado for coletado e borbulhado em um pequeno volume de água contendo um indicador ácidobase apropriado dissolvido, a substância HCl pode ser identificada pela mudança de cor.
c) o cloreto de vinila H2C=CHCl é o monômero do PVC.
d) o termo vinila referese ao radical monovalente H2C=CH•, derivado do etileno H2C=CH2
e) a reação de decomposição térmica do PVC mostrada é do tipo desidrogenação.
QUESTÃO 38
A respeito do íon Na+ em seu estado energético mais estável, são feitas as seguintes afirmações:
I.
II.
III.
IV.
V.
VI.
VII.
Tem 10 elétrons na eletrosfera.
Tem a mesma configuração eletrônica do ânion fluoreto.
Tem 11 prótons no núcleo.
Apresenta 2 níveis energéticos completamente preenchidos.
Possui 3 subníveis energéticos completamente preenchidos.
O seu raio atômico é menor do que o raio atômico do átomo neutro de sódio
Sua energia de ionização é maior que a energia de ionização do átomo neutro de sódio.
É correto afirmar que:
a)
b)
c)
d)
e)
todas estão incorretas.
todas estão corretas.
apenas V é incorreta.
apenas VI é incorreta.
apenas VII é incorreta.
QUESTÃO 39
A presença do oxigênio dissolvido na água se deve, em parte, à sua dissolução do ar atmosférico para a água, O2(g) O2(aq), cuja constante de equilíbrio apropriada é a constante da Lei de Henry, KH. Para o processo de dissolução do O2, KH, é definida como KH = [O2(aq)]/pO2, em que pO2 é a pressão parcial de oxigênio no ar. A figura a seguir mostra a solubilidade do gás oxigênio em água em função da temperatura, na pressão atmosférica de 1 atm (760mmHg).
São feitas as seguintes afirmações a respeito da solubilidade do gás oxigênio em água:
I.
A concentração molar de oxigênio na água, [O2(aq)], é proporcional à pressão parcial de oxigênio no ar atmosférico.
II.
A solubilidade do oxigênio em água decresce linearmente com o aumento da temperatura.
III.
A solubilidade do oxigênio dissolvido em água a 0oC e ao nível do mar é pouco superior a 14mg/L.
Podese afirmar que:
a)
b)
c)
d)
e)
todas são corretas.
todas são incorretas.
apenas II é incorreta.
II e III são incorretas.
apenas III é incorreta.
QUESTÃO 40
Em presença de metais, carvão, dióxido de manganês, finamente pulverizados, o peróxido de hidrogênio se decompõe com facilidade e com efervescência, segundo um processo:
2H2O2(l) → 2H2O(l) + O2(l) ∆H= 21,7 kcal/mol.
Dado: o volume molar nas CNTP é 22,7L
A respeito do peróxido de hidrogênio e sua decomposição é INCORRETO afirmar que:
a)
b)
c)
d)
e)
o número de oxidação do oxigênio no H2O2 é –1.
a decomposição do H2O2 é um processo endotérmico.
quando são produzidos 227L de O2 nas CNTP, são decompostos 20 mol de H2O2.
quando são produzidos 227L de O2 nas CNTP, são liberadas 217 quilocalorias.
átomos de oxigênio são oxidados e outros reduzidos na decomposição do peróxido de hidrogênio.
QUESTÃO 41
A tabela demonstra as constantes de ionização ácida de substâncias orgânicas em água a 25oC.
Substância
Ka
Ácido acético (CH3COOH)
Etanol (CH3CH2OH)
Fenol (C6H5OH)
2nitrofenol (C6H4(NO2)OH)
1,8x105
1,0x1018
1,3x1010
6,2x108
A partir dos dados da tabela, é incorreto dizer que:
a) o ácido acético é o ácido mais fraco das substâncias listadas na tabela quando estas estão dissolvidas em água.
b) o etanol é o ácido mais fraco das substâncias listadas na tabela quando estas estão dissolvidas em água.
c) fenol é menos ácido que 2nitrofenol em água.
d) o ácido acético é o ácido mais forte das substâncias listadas na tabela quando estas estão dissolvidas no solvente polar.
e) o etanol é o ácido mais fraco das substâncias listadas na tabela quando estas estão dissolvidas no solvente polar.
QUESTÃO 42
A capsaicina é a molécula ativa responsável pelo sabor apimentado da pimenta vermelha, do gênero Capsicum, incluindo pimentas vermelhas e verdes. A estrutura dessa molécula é mostrada abaixo:
Sobre a capsaicina, é incorreto afirmar que:
a) é uma amida.
b)
c)
d)
e)
é um fenol.
é um éter.
é uma amina.
apresenta duplas ligações carbonocarbono.
QUESTÃO 43
Em qual das alternativas está melhor descrito o núcleo de um átomo do alumínio na substância Al2O3?
a)
b)
c)
d)
e)
É um sal, apresentando em seu núcleo treze prótons e, em sua eletrosfera, dez elétrons. É um óxido, apresentando em seu núcleo treze prótons e, em sua eletrosfera, dez elétrons.
É um sal, apresentando em seu núcleo treze prótons e, em sua camada de valência, dez elétrons
É um óxido, apresentando em seu núcleo dez prótons e, em sua camada de valência, treze elétrons.
É uma base, apresentando em seu núcleo dez prótons e, em sua camada de valência, treze elétrons.
QUESTÃO 44
Os ácidos graxos de cadeia longa conhecidos como ômega3 apresentam efeitos benéficos em termos de redução do risco de ataques cardíacos fatais e em termos de determinadas doenças autoimunes, incluindo a artrite reumatóide e psoríase. Esses ácidos, quimicamente, são caracterizados como substâncias que têm uma ligação dupla no terceiro carbono no final da cadeia. O óleo de peixes como o atum e o salmão são boas fontes de ácidos graxos ômega 3, incluindo o ácido docosaexanóico (DHA). (DHA)
COOH
A obtenção de ácido carboxílico saturado, a partir do DHA, é possível através de uma reação de:
a)
b)
c)
d)
e)
oxidação
redução da carbonila
hidrogenação
esterificação
eliminação
QUESTÃO 45
Em sistemas fechados, o dióxido de carbono produzido pela respiração e processos de combustão pode ser removido pela reação com óxido de cálcio, produzindo carbonato de cálcio (CaCO 3). Em um experimento realizado para verificar a eficiência na redução de dióxido de carbono, observouse que foram consumidos 5,3 g de óxido de cálcio. A massa de dióxido de carbono aproximadamente removida foi de:
a)
b)
c)
d)
e)
2,05g
2,42g
2,64g
3,23g
4,15g
QUESTÃO 46
Uma solução de 20 mL de fosfato de sódio (Na3PO4) na concentração de 0,40 mol.L1 apresenta quantos mols de íons Na+?
a) 0,0080
b) 0,024
O
O
CH3(CH2)3CH2C
CH3CH2CCH2(CH2)5CH3
H
c) 0,050
d) 0,10
e) 0,20 QUESTÃO 47
Um antiácido estomacal, tipo bicarbonato de sódio (NaHCO3), neutraliza o excesso de ácido clorídrico do suco gástrico, havendo liberação de gás carbônico, o qual é o responsável pelas indesejáveis flatulências. Com relação a essa reação que ocorre no estômago, assinale a alternativa VERDADEIRA:
a) NaHCO3 comportase como sal ácido.
b) NaHCO3 comportase como sal básico.
c) HCl comportase como base.
d) CO2 comportase como base.
e) CO comportase como base.
QUESTÃO 48
Dada a reação de transformação do alumínio em cloreto de alumínio pela ação do gás cloro:
2 Al (s) + 3 Cl2 (g) AlCl3 (s)
Podese verificar que a semireação que representa o processo de oxidação é:
a)
b)
c)
d)
e)
Al + 3e Al3+
Al Al3+ + 3e
Cl2 + 2e 2 Cl Cl2 + 4e 2 Cl2 + 2e
Al + 3e Al3
QUESTÃO 49
Os feromônios são substâncias químicas usadas na comunicação natural entre indivíduos da mesma espécie. A tabela a seguir mostra a estrutura química de algumas moléculas usadas como feromônios por formigas.
Estrutura
Função Biológica
CH3(CH2)9CH3
Feromônio de trilha das formiguinhas de jardim
CH3(CH2)4CH2OH
Feromônio de alarme (no caso de luta) da formiga longinoda
Feromônio da formiga longinoda ao preparar
se para a luta Feromônio de alarme da formiga longinoda ao pressentir perigo de morte Fonte: Quadros, A. L. Química Nova na Escola. n.7, p.710, 1998.
Em relação às substâncias mostradas na tabela é incorreto afirmar que:
a)
b)
c)
d)
e)
o feromônio de trilha das formiguinhas de jardim é um hidrocarboneto.
o feromônio de alarme (no caso de luta) da formiga longinoda é o 1hexanol.
o feromônio da formiga longinoda ao prepararse para a luta é uma cetona.
o feromônio de alarme da formiga longinoda ao pressentir perigo de morte é o 6hexanal.
uma das substâncias listadas na tabela é o nundecano.
QUESTÃO 50
A reação de formação da hematita a partir de ferro e oxigênio é representada pela equação:
4 Fe (s) + 3 O2 2Fe2O3 (s) + 1640 kJ
Nessa reação, podese afirmar que:
a)
b)
c)
d)
e)
o Fe atua como agente redutor, sendo exotérmica com ∆H = 1640 kJ. o Fe atua como agente oxidante, sendo endotérmica com ∆H = + 1640 kJ. o Fe atua como agente redutor, sendo endotérmica com ∆H = 1640 kJ. o O2 atua como agente oxidante, sendo exotérmica com ∆H = + 1640 kJ. o O2 atua como agente redutor, sendo exotérmica com ∆H = 1640 kJ.
Download