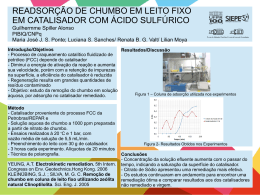
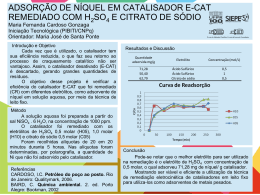
Ciências da Natureza e suas Tecnologias - Química Ensino Médio, 2º Ano Deslocamento de equilíbrio (princípio de Le Chatelier): temperatura e efeito de catalisador Relembrando conceitos Características do equilíbrio • as velocidades da reação direta (v1) e da reação inversa (v2) são iguais: H2 I2 2HI • todo equilíbrio químico é um equilíbrio dinâmico; • externamente, tem-se a impressão de que tudo cessa, mas isso não ocorre. Tanto a reação direta como a reação inversa permanecem ocorrendo com a mesma velocidade. Relembrando conceitos Características do equilíbrio: • assim sendo, a concentração das espécies presentes permanecem constantes; • uma reação reversível tende, naturalmente, ao equilíbrio (estado de menor energia); • o equilíbrio químico só pode ser obtido nas reações que ocorrem em sistemas fechados (ou seja, não ocorre troca de matéria). Aberto Fechado Isolado Vídeo sobre equilíbrio molecular http://www.youtube.com/watch?feature =player_embedded&v=aixS4QiV-tk Deslocando o equilíbrio • ao atingir o estado de equilíbrio, o sistema tende a permanecer nesse estado desde que não ocorra nenhuma perturbação externa; • Henri Louis Le Châtelier estudou os sistemas em equilíbrio e os fatores que os afetavam; • foi ele quem elaborou um princípio (que tem seu nome) para explicar esse comportamento. Imagem: Autor desconhecido/ Domínio Público Deslocando o equilíbrio • Princípio de Le Chatelier “Quando se provoca uma perturbação sobre o sistema em equilíbrio, ele tende a se deslocar no sentido de fuga frente à ação aplicada (tende a anular a ação aplicada), tentando se ajustar a uma nova situação de equilíbrio.” Deslocamento do equilíbrio Efeito da temperatura • consideraremos o mesmo equilíbrio da aula anterior: N2(g) + 3 H2(g) ⇄ 2 NH3(g), H = -92,2 kJ ou N2(g) + 3 H2(g) ⇄ 2 NH3(g) + 92,2 kJ • o sentido direto da reação é exotérmico (libera calor). Logo, o sentido inverso será endotérmico (absorverá calor). • O que aconteceria se adicionássemos calor ao sistema? Deslocamento do equilíbrio Efeito da temperatura N2(g) + 3 H2(g) ⇄ 2 NH3(g) + 92,2 kJ • a reação endotérmica (para a esquerda) consumirá parte do calor adicionado para produzir mais N2 e H2 a partir de NH3; • dessa maneira, a temperatura aumentará menos que o esperado; • em temperaturas mais elevadas, as concentrações no equilíbrio de N2 e H2 são maiores e a de NH3, menor. Deslocamento do equilíbrio Efeito da temperatura: N2(g) + 3 H2(g) ⇄ 2 NH3(g) + 92,2 kJ • a diminuição da temperatura provocará o feito contrário, já que favorecerá a reação exotérmica; • será produzido calor para compensar parcialmente o que foi retirado do sistema. Deslocamento do equilíbrio Efeito da temperatura • obs.: elevar (ou diminuir) a temperatura de um sistema afetará o equilíbrio por alterar o valor da constante de equilíbrio (Kc ou Kp), que depende da temperatura do sistema. Deslocamento do equilíbrio Efeito da temperatura Co(Cl)42- + 6 H2O ⇄ Co(H2O)62+ + 4 Cl-, H < 0 (azul) (róseo) Imagem: Chemicalinterest/ Domínio Público Deslocamento do equilíbrio Efeito da temperatura Resumindo o efeito da temperatura, temos – aumento da temperatura (aquecimento) do sistema • desloca o equilíbrio no sentido da reação endotérmica (absorção de calor); – diminuição da temperatura (resfriamento) do sistema • desloca o equilíbrio no sentido da reação exotérmica (liberação de calor). Deslocamento do equilíbrio Gráfico Cinética quím ica e a influência do catalisador Ea Energia Catalisador • O que é um catalisador? São substâncias que alteram a velocidade das reações. • Como eles atuam? Alteram o caminho da reação, fornecendo um caminho alternativo mais fácil de ser alcançado. Sem Catalisador Ea Com Catalisador Caminho da Reação Deslocamento do equilíbrio Equilíbrio Químico e Influência do Catalisador Reação direta velocidade Efeito de adição de catalisador: • como afeta o estado de equilíbrio? Como o catalisador aumenta igualmente a velocidade das reações direta e inversa, já que produz a mesma diminuição na energia de ativação das duas reações, ele não altera o estado de equilíbrio, só a velocidade com que o equilíbrio é atingido. Da mesma forma, não devemos esperar obter mais produtos em uma reação catalisada. equilíbrio tempo Deslocamento do equilíbrio • Resumindo as regras básicas referentes ao uso de catalisadores: 1) não são criadores de reações; 2) permanecem inalterados ao final da reação; 3) agem em pequenas quantidades em relação ao sistema; 4) não alteram o estado de equilíbrio. Imagem: André Luis Carvalho; Leandro Maranghetti Lourenço/ Domínio Público Resumos visuais Efeito da temperatura • Le Chatelier e a temperatura: Pb(NO3)2(s) 2 PbO(s) + 4 NO2(g) + O2(g) (decomposição do sal) 2NO2(g) ⇄ N2O4(g) (marrom) (incolor) Adição de catalisador • Catalisador para a decomposição da H2O2: 2H2O2(l) 2H2O(l) + O2(g) Exemplo 1. (UNESP 2008) Dada a reação exotérmica 2H2O2(aq) ⇄ 2 H2O(l) + O2(g), a alteração que favorece a formação dos produtos é a elevação da a) temperatura. b) pressão parcial de O2. c) concentração de H2O. d) pressão. Imagem: VistaICO.com/ e) concentração de H2O2. Creative Commons Attribution 3.0 Unported Exemplo 2. Baseando-se na reação abaixo, C(s) + CO2(g) ⇄ 2CO(g) H= + 174kJ/mol de carbono a constante de equilíbrio dessa reação (Kp) é expressa como segue: Kp = (p(CO))2/p(CO2) Qual é o efeito sobre esse equilíbrio quando a) se adiciona carbono sólido? b) se aumenta a temperatura? c) se introduz um catalisador? Exemplos a) Quando se adiciona carbono sólido a adição de C(s) não altera o equilíbrio, pois, sendo um sólido, sua concentração pode ser considerada constante. b) Quando se aumenta a temperatura C(s) + CO2(g) ⇄ 2CO(g), H= + 174kJ/mol de carbono equilíbrio se desloca para a direita, pois o aumento de temperatura favorecerá a reação endotérmica. • Quando se introduz um catalisador a adição de catalisador não desloca equilíbrio. Imagem: VistaICO.com/ Creative Commons Attribution 3.0 Unported Exemplo 3. Imagine um ácido fraco genérico (HA) dissolvido em água. Teremos, portanto, o seguinte equilíbrio: HA(aq) ⇄ H+(aq) + A-(aq) (amarelo) (vermelho) Se borbulharmos amônia (NH3) no sistema em equilíbrio, o que acontecerá com a coloração dele? A amônia (NH3) irá reagir com os íons H+, removendo-os do sistema: H+ + NH3 ⇄ NH4+. Assim, o equilíbrio será deslocado para a direita. Desse modo, a coloração vermelha será acentuada, pois aumenta a concentração dos íons A-. Imagem: VistaICO.com/ Creative Commons Attribution 3.0 Unported Exercícios de fixação 1. (UFES) Considere a reação hipotética: A + B ⇄ C + D Com relação ao equilíbrio químico do sistema, à temperatura constante, pode-se afirmar que a) a adição de reagentes ao sistema desloca o equilíbrio no sentido deformação de produtos, aumentando o valor da constante de equilíbrio. b) a adição de produtos ao sistema desloca o equilíbrio no sentido de formação de reagentes, diminuindo o valor da constante de equilíbrio. c) a adição de reagentes ou de produtos ao sistema não afeta o valor da constante de equilíbrio. d) a adição de reagentes ao sistema desloca o equilíbrio no sentido deformação de reagentes, diminuindo o valor da constante de equilíbrio. e) a adição de produtos ao sistema desloca o equilíbrio do sistema no sentido de formação de produtos, aumentando o valor da constante de equilíbrio. Exercícios de fixação 2. (UERJ) A seguir, está representada a equação química balanceada que mostra a combustão da amônia, etapa fundamental na fabricação do ácido nítrico: a) b) c) d) 4NH3(g) + 5O2(g) ⇄ 4NO2(g) + 6H2O(g), H<0 Essa reação produzirá a quantidade máxima de NO2 (óxido de nitrogênio IV) nas seguintes condições de pressão e temperatura, respectivamente: alta – alta alta – baixa baixa – alta baixa – baixa Exercícios de fixação 3. (PUC) O equilíbrio químico representado pela equação N2(g) + O2(g) ⇄ 2NO(g) H = +21,6 Kcal, apresentará rendimento máximo em NO: a) em temperaturas e pressões elevadas. b) em temperaturas e pressões baixas. c) em temperaturas elevadas e pressões baixas. d) em temperaturas elevadas independentemente da pressão. e) em pressões altas independentemente da temperatura. N=O Exercícios de fixação 4. Nas condições ambientes, é exemplo de sistema em estado de equilíbrio uma: a) xícara de café bem quente. b) garrafa de água mineral gasosa fechada. c) chama uniforme de bico de Bunsen. d) porção de água fervendo em temperatura constante. e) tigela contendo feijão cozido. Fonte: http://www.sempretops.com/estudo/equilibrio-quimico-exercicios/ Exercícios de fixação 5. (UFV/2011) Uma das etapas de fabricação do ácido sulfúrico é a conversão de SO2 a SO3, numa reação exotérmica, que ocorre segundo a equação abaixo: SO2(g) + ½O2(g) ⇄ SO3(g) Em relação ao equilíbrio dessa reação, é CORRETO afirmar que a) o aumento da pressão, mantida à temperatura constante, favorece a formação de SO2. b) o uso de um catalisador aumenta a concentração de SO3 no equilíbrio. c) o aumento da temperatura favorece a formação de SO2. d) o aumento da velocidade de produção de SO3 aumenta sua concentração no equilíbrio. Atividade de fixação • Montar a seguinte tabela no caderno de atividades e completá-la com os efeitos relacionados. Fator (perturbação) Concentração Pressão Temperatura Catalisador Aumento provoca deslocamento do equilíbrio para... Diminuição provoca deslocamento do equilíbrio para... Tabela de Imagens n° do slide direito da imagem como está ao lado da foto 5 Autor desconhecido/ Domínio Público 11 Chemicalinterest/ Domínio Público 15 André Luis Carvalho; Leandro Maranghetti Lourenço/ Domínio Público VistaICO.com/ Creative Commons Attribution 3.0 Unported VistaICO.com/ Creative Commons Attribution 3.0 Unported VistaICO.com/ Creative Commons Attribution 3.0 Unported 17 19 20 link do site onde se conseguiu a informação Data do Acesso http://commons.wikimedia.org/wiki/File:Lechatelier.j pg?uselang=pt-br http://commons.wikimedia.org/wiki/File:Cobalt_chlo ride_equilibrium.JPG?uselang=pt-br http://commons.wikimedia.org/wiki/File:Vidrarias_d e_Laboratorio.jpg?uselang=pt-br http://commons.wikimedia.org/wiki/File:132810191 1_Symbol-Check.png http://commons.wikimedia.org/wiki/File:132810191 1_Symbol-Check.png http://commons.wikimedia.org/wiki/File:132810191 1_Symbol-Check.png 30/08/2012 30/08/2012 30/08/2012 30/08/2012 30/08/2012 30/08/2012
Download