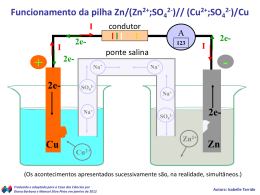
ELETROQUÍMICA * Eletrólise *Pilhas PILHAS Uma pilha (ou reação galvânica) é um processo que gera uma diferença de potencial e uma corrente elétrica. Nesse processo associamos duas reações que apresentam potenciais de oxi-redução diferentes entre sí. Os potenciais de oxi-redução “medem” a capacidade de oxidação ou de redução de um sistema. PILHAS Para os cátions, os metais alcalinos e alcalino-terrosos, por serem muito eletropositivos, apresentam elevado potencial de oxidação enquanto que os metais de transição apresentam, em relação aos primeiros elevado potencial de redução. Para fins comparativos, arbitrase potencial zero para a reação H2 - 2 e- 2 H+ E = 0,0 V PILHAS Exemplos de Potenciais de redução Li+ + 1 e- Li E = - 3,04 V Na+ + 1 e- Na E = - 2,71 V Zn++ + 2 e- Zn E = - 0,76 V 2H+ + 2 e- H2 E= Cu+2 + 2e- Cu E = + 0,34 V Ag+ + 1 e- Ag E = + 0,80 V Au+3 + 3e- Au E = + 1,50 V 0,00 V PILHAS Uma das primeiras pilhas conhecidas é a de DANIELL, que consiste de um eletrodo de cobre e outro de zinco, segundo o esquema: - ÂNODO CÁTODO Solução de Solução de + ZnSO4 CuSO4 Zn(s) - 2e 2+ - Oxidação Zn Cu2+ + 2e - Redução Cu(s) PILHAS se Na pilha de Daniell o Zn tende a oxidar pois apresenta menor potencial de redução ( - 0,76 V) enquanto cobre apresenta maior potencial de redução ( + 0,34 V). Para a reação global ocorre o seguinte: Zn - 2 e- Zn+2 Cu+2 + 2 e- Cu PILHAS Associado reações resulta: as duas Zn + Cu+2 Zn+2 + Cu * Zn sofre oxidação; * Cu+2 sofre redução. PILHAS Representação da pilha de Daniell Zn / Zn+2 // PONTE SALINA (ânodo: -) Cu+2 / Cu (cátodo: +) fluxo de elétrons oxidação redutor redução oxidante Epilha = Eoxidante - Eredutor (sempre usar o potencial de redução) PILHAS Observe que o sinal convencional do cátodo e do ânodo, na pilha, é o contrário do que ocorre na eletrólise. Justifica-se: * eletrólise: reação “forçada” * pilha: reação espontânea. Contudo, tanto nas pilhas quanto nas reações de eletrólise - cátodo chegam elétrons - ânodo saem elétrons PILHAS Potencial na pilha de Daniell Eoxidante(Cu) = + 0,34 Volts Eredutor(Zn) = - 0,76 Volts Epilha = Eoxidante - Eredutor Epilha = + 0,34 - (- 0,76) = 1,10 Volts. * Epilha > 0 : reação espontânea * Epilha < 0 : reação não-espontânea OUTRAS PILHAS Pilha comum (Leclanché) REAÇÕES: cátodo de carbono (grafite) ânodo de zinco pasta úmida de NH4Cl , MnO2 e carbono 1) Ânodo Zn - 2e- Zn+2 2) Cátodo MnO2 + 2e- Mn+2 OUTRAS PILHAS Bateria ou acumulador (automóvel) (+) (-) H2SO4 + H2O placas alternadas de Pb e PbO2 PbO2 (cátodo) Pb (ânodo)
Download