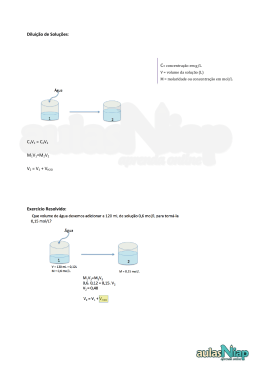
Disciplina Química Geral Prof. Dr. Fábio Erminio Mingatto Exercícios propostos 2 01) Dissolve-se 81 g de glicose (C6H12O6) em suficiente volume de água para se obter 500 mL de solução. Qual é a molaridade da solução assim obtida? (C-12 H-1 O-16) R: 0,9 mol L-1 02) Qual é a massa de HNO3 que devemos dissolver na água para preparar 250 mL de solução 5 mol L-1 desse ácido? (H-1 N-14 O-16) R: 78,75 g 04) Determinar a molaridade de uma solução de NaOH que foi obtida dissolvendo-se 60 g do composto em suficiente volume de água para se obter 350 mL de solução. (O-16 H-1 Na-23) R: 4,28 mol L-1 06) Qual é a massa de H2SO4 necessária para preparar 600 mL de solução 1,4 mol L-1? (H-1 S-32 O-16) R: 82,32 g 07) Um laboratorista tem a sua disposição uma solução estoque de NaOH 2 mol L-1 e deseja preparar 500 mL de solução 1,5 mol L-1. Qual é o volume de solução estoque que deverá utilizar? R: 0,375 litro 08) Em um recipiente há uma solução de NaCl de concentração 300 g L-1. Desse recipiente é retirado 125 mL dessa solução. Qual é a massa de sal contida nessa porção retirada? R: 37,5 g 09) Em uma proveta são colocados 350 mL de uma solução de AgNO3 de concentração 200 g L-1. A seguir são adicionados 150 mL de água destilada. Qual é a nova concentração da solução assim obtida? R: 140 g L-1 10) Quantos mols de soluto existem em 125 mL de uma solução 7 M (molar) de álcool etílico? R: 0,875 mols 11) Num recipiente encontram-se 5 L de H2SO4 de concentração 3,5 mol/L. Ao adicionarmos 2000 mL de H2O qual será sua nova molaridade? R: 2,5 mol/L 12) Adicionou-se 100 mL de H2O a 400 mL de uma solução de salmoura 80 g/L. Qual será a concentração da solução resultante? R: 64 g/L 13) Determinar a concentração em porcentagem de uma solução onde se dissolvem 5 g de soluto por 200 mL de solução. R: 2,5% 14) Qual é o volume de água que devemos adicionar a 600 mL de solução 2 mol L-1 de HCl para se obter uma solução 1,5 mol L-1 desse ácido? R: 200 mL 15) Misturam-se duas soluções de NaOH que são: a) 200 mL de solução 3 mol L-1 b) 0,6 L de solução 1,5 mol L-1 Determinar a molaridade da solução final. R: 1,87 mol L-1 16) Numa solução de volume 400 mL de concentração 3 M, foram adicionados 100 mL de H2O. Qual é a sua nova molaridade? R: 2,4 mol L-1 17) Em um recipiente há uma solução de concentração 200 g L-1. São retirados 100 mL dessa solução. Qual é a massa de soluto contida na porção retirada? R: 20 g 18) Uma substância apresenta MM = 500 g/mol. Se 50 g dessa substância foram dissolvidas para 200 mL de H2O, qual é a molaridade da solução assim preparada? R: 0,5 mol L-1 19) Qual a massa de NaF necessária para preparar 1 L de uma solução aquosa de NaF a 2% (p/v)? R: 20g 20) E uma solução 1% em volume final de 200 mL? R: 2 g 21) Em uma proveta são colocados 10 mL de solução de HCl 0,3 mol L-1. Que volume de água deve-se adicionar para se obter uma solução 0,1 mol L-1? R: 0,02 litro 22) Pesou-se 500 mg de NaF para a preparação de uma solução a 2%. Que volume dessa solução pode se obter com a quantidade de sal pesada? R: 25 mL 23) Quantos gramas de NaCl são necessários para preparar 250 mL de uma solução a 0,9% (p/v)? R: 2.25g 24) Para preparar 1000 mL de solução de NaF 1 mol L-1 foram usados x g de NaF sólido. Calcular o valor de x. Se fosse preferível expressar a concentração em porcentagem (p/v), qual seria o valor para a solução preparada? (Na-23 F-19) R: 42 g, 4,2% 25) Como você expressaria em porcentagem (p/v) uma solução de concentração 40 mg . 2L-1? R: 0,002% 26) Qual é a massa de fluoreto de sódio necessária para preparar 800 mL de uma solução a 2% (p/v)? R: 16 g 27) A partir de uma solução estoque de fluoreto de sódio 200 g L-1, desejo preparar 100 mL de uma solução 2%. Como procederia, ou seja, qual é o volume da solução estoque necessário? R: 10 mL
Download