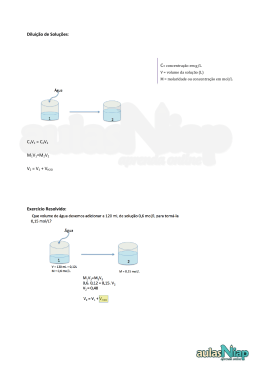
Lista de Exercícios – Teórica 1. Suponha que dissolvemos 10,0 g de açúcar de cana em água até completar 200 ml solução. O açúcar da cana é a sacarose (C12H22O11). Qual é a molaridade das moléculas de sacarose na solução? R. 0,146 mol L-1 2. Suponha que nos pediram para preparar 250 ml de uma solução 0,0380 M CuSO4(aq) e só dispomos de sulfato de cobre (II) penta-hidratado (CuSO4.5H2O). Que massa do sólido precisamos usar? R. 2,37 g 3. Suponha que queremos preparar uma solução 0,760 mmol CH3COOH, ácido acético, um ácido encontrado no vinagre e muito usado no laboratório, e dispomos de uma solução 0,0380 M CH3COOH(aq). Que volume dessa solução teríamos de usar? R. 20,0 ml 4. Precisamos preparar 250 ml de uma solução 1,50x10-3 M de NaOH(aq) a partir de uma solução estoque de concentração 0,038 M. Que volume de solução estoque devemos usar? R. 9,87 ml 5. Um estudante preparou uma solução de carbonato de sódio colocando 2,111 g de sólido no balão volumétrico de 250 ml e adicionando água até a marca. Parte da solução foi transferida para uma bureta. Que volume de solução o estudante deveria transferir a uma segundo balão para obter (a) 2,15 mmol de Na+; (b) 4,98 mmol de CO32-; (c) 50,0 mg de Na2CO3? R. 13,5; 62,5 e 5,9 ml 6. (a) Que volume de uma solução 0,778 M Na2CO3(aq) deveria ser diluído até 150 ml com água para reduzir sua concentração a 0,0234 M Na2CO3(aq)? (b) Um experimento necessita de 60 ml de 0,50 M NaOH(aq). O técnico do laboratório só encontrou uma frasco de reagente 2,5 M NaOH(aq). Como se poderia preparar a solução 0,50 M NaOH(aq)? R. 4,51 e 12 ml 7. Um estudante preparou uma solução colocando 0,376 g de NiSO 4.6H2O e 0,129 g de NiCl2.6H2O em um frasco volumétrico de 250 ml. Uma pequena quantidade de água destilada foi adicionada e o frasco foi agitado com cuidado, de modo a fazer dissolver os compostos. Após a dissolução, a solução foi diluída até a marca. (a) Qual é a concentração molar de íons cloreto na solução final? (b) Qual é a concentração molar de íons níquel na solução final? R. 4,34x10-3 M Cl- e 7,89x10-3 M Ni2+ 8. Que massa (em gramas) do soluto anidro é necessária para preparar cada uma das seguintes soluções? (a) 1,00 l de 0,125 M K2SO4(aq); (b) 375 ml de 0,015 M NaF(aq); (c) 500 ml de 0,35 M C12H22O11(aq). R. 21,775; 0,2363 e 59,85 g 9. O ácido clorídrico concentrado contém 37,50% HCl em massa e tem densidade 1,205 g.cm-3. Que volume (em mililitros) de ácido clorídrico concentrado deve ser usado para preparar 10 litros de 0,7436 M HCl(aq)? R. 600,6 ml 10. Calcule a força iônica das soluções de (a) 0,0087 M KOH e (b) 0,0002 M La(IO3)3. R. 0,0087 e 0,0012 M 11. Determine o coeficiente de atividade de cada íon na força iônica indicada: (a) SO42- ( = 0,01 M); (b) Eu3+ ( = 0,1 M); (c) Sc3+ ( = 0,005 M); (d) (CH3CH2)3NH+ ( = 0,05 M). R. 0,625; 0,035; 0,4736; 0,7691. 12. Calcule a atividade iônica do Zn2+ quando = 0,083 M e concentração molar = 0,0042 M, usando a Equação de Debye-Huckel. R. 1,085x10-3 13. A constante de equilíbrio K = 1,1x10-2 para a reação PCl5(g) PCl3(g) + Cl2(g) em 400K. (a) Sabendo que 1,0 g PCl5 foi colocado em balão de 250 ml, determine as concentrações molares na mistura em equilíbrio. (b) Qual é a porcentagem de PCl5 decomposta em 400K? R.[PCl5] = 9,18x10-3 M; [PCl3] = [Cl2] = 0,01 M e 48% 14. NH4HS sólido e 0,400 mol NH3(g) são colocados dentro de um balão de 2,0 L, em 24 C, e atingem o equilíbrio NH4HS(s) NH3(g) + H2S(g), para o qual K = 1,6x10-4. Quais são as concentrações de NH3 e H2S no equilíbrio? R. [NH3] = 0,200 M e [H2S] = 7,97x10-4 M 15. A constante de equilíbrio K da reação N2(g) + O2(g) 2NO(g), em 1200 C, é 1,00x10-5. Calcule a concentração molar de todas as espécies no equilíbrio em um balão de 1,00 l que inicialmente continha 0,114 mol N 2 e 0,114 mol de O2. R. [N2] = [O2] = 0,114 M e [NO] = 3,60x10-4 M 16. Uma mistura de reação de 0,400 mol H2 e 1,60 mol I2 foi introduzida em um balão de 3,00 l e aquecida. No equilíbrio, 60% do gás hidrogênio reagiu. Qual é a constante de equilíbrio da reação H2(g) + I2(g) 2HI(g) nessa temperatura? R. 1,056 17. Em 500K, a constante de equilíbrio da reação Cl2(g) + Br2(g) 2BrCl(g) é K=0,031. Se a composição de equilíbrio é 0,495 M de Cl2 e 0,145 M de BrCl, qual é a concentração de Br2 no equilíbrio? R. [Br2] = 1,37 M 18. Calcule a molaridade de OH- em soluções com as seguintes concentrações de H3O+: (a) 0,020 M; (b) 1,0x10-5 M; (c) 3,1x10-3 M. R. 5,0x10-13; 1,0x10-9 e 3,2x10-12 M 19. O valor de Kw da água na temperatura do corpo (37 C) é 2,1x10-14. (a) Qual é a molaridade dos íons H3O+ e o pH da água neutra, em 37 C? (b) Qual é a molaridade de OH- na água neutra, em 37 C? R. [H3O+] = 1,45x10-7 M; pH = 6,84 e [OH-] = 1,45x10-7 M. 20. O pH de várias soluções foi medido em um laboratório de pesquisas de uma empresa de alimentos. Converta os seguintes valores de pH para molaridade de íons H3O+: (a) 3,3 (o pH do suco de laranja azedo); (b) 6,7 (o pH de uma amostra de saliva); (c) 4,4 (o pH da cerveja); (d) 5,3 (o pH de uma amostra de café). R. 5,01x10-4; 2,00x10-7; 3,98x10-5; 5,01x10-6 M 21. Calcule o pH e o pOH de cada uma das seguintes soluções de ácido ou base forte em água: (a) 0,0146 M HNO3(aq); (b) 0,11 M HCl(aq); (c) 0,0092 M Ba(OH)2(aq); (d) 2,00 ml de 0,175 M KOH(aq) depois da dissolução até 5,00x102 ml; (e) 13,6 mg de NaOH dissolvido em 0,350 l de solução; (f) 75 ml de 3,5x10-4 M HBr(aq) depois da dissolução até 0,500 l. R. (a) pH = 1,84 e pOH = 12,16; (b) pH = 0,96 e pOH = 13,04; (c) pH = 12,26 e pOH = 1,74; (d) pH = 10,85 e pOH = 3,15; (e) pH = 10,99 e pOH = 3,01; (f) pH = 4,28 e pOH = 9,72 22. Escreva a equação do equilíbrio de transferência de prótons de cada um dos seguintes ácidos fracos e dê a expressão da constante de acidez Ka. Identifique a base conjugada, escreva a equação apropriada para a transferência de prótons e escreva a expressão da constante de basicidade Kb. (a) HClO2; (b) HCN; (c) C6H5OH. 23. Calcule os valores de pH e pOH das seguintes soluções em água: (a) 0,29 M CH3COOH(aq); (b) 0,29M CCl3COOH(aq); (c) 0,29M HCOOH(aq). R. (a) pH = 2,64 e pOH = 11,36; (b) pH = 0,53 e pOH = 13,47; (c) pH = 2,14 e pOH = 11,86 24. (a) O valor medido do pH de 0,10 M HClO2(aq) é 1,2. Quais são os valores de Ka e pKa do ácido cloroso? (b) O pH medido de uma solução 0,10 M propilamina, C3H7NH2, em água é 11,86. Quais são os valores de Kb e pKb da propilamina? R. (a) Ka = 0,1079 e pKa = 0,967; (b) Kb = 5,824x10-4 e pKb = 3,23 25. A porcentagem de desprotonação do ácido benzoico em uma solução 0,110 M é 2,4%. Quais são o pH da solução e o Ka do ácido benzoico? R. pH = 2,6 e Ka = 6,35x10-5 26. O Ka do ácido propanoico, CH3CH2COOH é 1,3x10-5. Uma amostra de 50 ml de 0,250 M CH3CH2COOH(aq) é diluída até 850 ml. Determine a porcentagem de desprotonação do ácido na solução diluída. R. 3% 27. (a) Uma amostra de 5,34 g de acetato de potássio, KCH3CO2, foi dissolvida em 0,250 l de solução. (a) Qual é o pH da solução? (b) Qual é o pH da solução resultante da dissolução de 5,75 g NH4Br em 0,100 l de solução? R. (a) 9,04; (b) 4,74 28. (a) Uma amostra de 150 ml de 0,020 M NaCH3CO2(aq) foi diluída até 0,500 l. Qual é a concentração de ácido acético no equilíbrio? (b) Qual é o pH da solução resultante da dissolução de 2,16 g de brometo de amônia, NH4Br, em 0,400 l de solução? R. (a) 1,80x10-6 M; (b) pH = 5,3 29. Determine o pH e o pOH de (a) uma solução que é 0,50 M NaHSO 4(aq) e 0,25 M Na2SO4(aq); (b) uma solução que é 0,50 M NaHSO4(aq) e 0,10 M Na2SO4(aq); (c) uma solução que é 0,50 M NaHSO4(aq) e 0,50 M Na2SO4(aq)? R. (a) pH = 1,62 e pOH = 12,38; (b) pH = 1,22 e pOH = 12,78; (c) pH = 1,92 e pOH = 12,08 30. Calcule o pH da solução que resulta da mistura de (a) 30 ml de 0,050M HCN(aq) com 70 ml de 0,030 M NaCN(aq); (b) 40 ml de 0,030 M HCN(aq) com 60 ml de 0,050 M NaCN(aq); (c) 25 ml de 0,105 M HCN(aq) com 25 ml de 0,105 M NaCN(aq). R. (a) pH = 9,46; (b) pH = 9,71; (c) pH = 9,31 31. (a) Qual deve ser a razão entre as concentrações dos íons CO32- e HCO3- em uma solução tampão com pH igual a 11? (b) Que massa de K2CO3 deve ser adicionada a 1,00 l de 0,100 M KHCO3(aq) para preparar uma solução tampão com pH igual a 11? (c) Que massa de KHCO3 deve ser adicionada a 1,00 l de 0,100 M K2CO3(aq) para preparar uma solução tampão com pH igual a 11? R. (a) 5,6; (b) 33,6 g; (c) 34,16 g 32. O volume de uma solução tampão, formada por 0,100 M CH3COOH(aq) e 0,100 M NaCH3CO2(aq), é 100 ml. (a) Quais são o pH e a mudança de pH resultantes da adição de 10 ml de 0,950 M NaOH(aq) à solução tampão? (b) Quais são o pH e a mudança de pH resultantes da adição de 20,0 ml de 0,100 M HNO 3(aq) à solução tampão original? R. (a) pH = 6,3, mudança de 1,5; (b) pH = 4,58, mudança de -0,17
Download