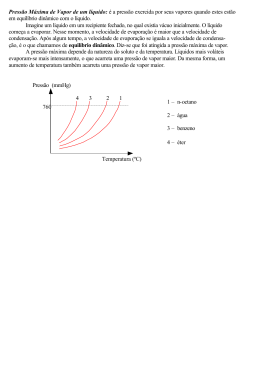
Colégio Geração Aluno(a): ____________________________________ 2ª série _____ Texto complementar para P3 de química. Professora: Deise Maria Por que os líquidos evaporam? Ponha um pouco de água num pires e deixe-a por um dia ou dois. O que você irá observar é que a água, literalmente irá evaporar. Como isso ocorre se não há aquecimento? As moléculas de água da superfície do liquido se movem para um lado e para outro, chocando-se umas com as outras. Algumas das moléculas se movem mais depressa que as outras e podem então vencer a camada superficial da água e escapar para o estado gasoso (A). O líquido então aos poucos evapora, isto é, transforma-se em vapor. Evaporação. (A) Moléculas de água passam pela camada superficial e escapam. (B) No copo fechado as moléculas de vapor se acumulam até que elas se condensem com a mesma rapidez com que se evaporam. O espaço está então saturado. Pressão de vapor Quando a água se evapora de um copo aberto (A), algumas das moléculas do vapor se chocam com moléculas do ar, recuam, e tornam a entrar no líquido. O ar se comporta, portanto, como uma coberta que se opõe à evaporação e a retarda. Se você tampa o copo (B), o vapor se acumulará no espaço acima do líquido. O número de moléculas que voltam para o líquido, isto é, que se condensam, aumentará até que as moléculas se condensem na mesma proporção das que se evaporem. Assim a quantidade de vapor será constante; nós dizemos que o espaço está saturado. A pressão que o vapor do liquido faz sobre as paredes do copo em (B) consiste a pressão de vapor. Existe pressão de vapor em sólidos? As bolas de naftalina colocadas num armário, para matar traças, vão aos poucos diminuindo de tamanho até desaparecer. A naftalina aos poucos vai evaporando, ou melhor, sublimando. O gelo seco também evapora rapidamente. Coloque uma moeda sobre um bloco de gelo seco. O vapor formado desloca a moeda fazendo-a saltitar irregularmente. O iodo, a cânfora e outros poucos sólidos sublimam como a naftalina, esses sólidos que sublimam possuem pressão de vapor e são chamados de sólidos voláteis. Porém, as moléculas da maioria dos sólidos se atraem tão fortemente que não podem escapar facilmente para o estado gasoso, sendo chamados então de sólidos não-voláteis. Por que a pressão de vapor aumenta com a temperatura? Quando a temperatura de um líquido aumenta, suas moléculas se movem mais depressa. Elas então evaporam mais rapidamente. As moléculas do vapor se chocam mais, contra as paredes, em cada segundo; e elas se chocam com mais força. Isto acarreta um aumento da pressão de vapor do sistema. Por exemplo, á 10ºC a pressão de vapor da água é de 2 cmHg. A 80ºC ela é de 35 cmHg e a 100ºC é de 76 cmHg (1atm), isto é, pressão ao nível do mar. Pressão de vapor vs temperatura para três líquidos. Que é ponto de ebulição de um líquido? Quando você põe uma panela com água fria no fogo, o calor que ela recebe faz as moléculas da água se mover mais depressa, de modo que a temperatura da água sobe. Após algum tempo, a água começa a ferver, bolhas se formam nela e vêm para a superfície, e a temperatura permanece constante. A água em ebulição forma bolhas porque a pressão do vapor da água é igual à pressão na superfície do líquido. Se aquela pressão fosse menor, as bolhas não se formariam. Nós definimos o ponto de ebulição de um líquido como a temperatura em que a pressão de vapor é igual à pressão externa sobre o liquido no caso. Líquidos que evaporam rapidamente à temperatura ambiente têm pontos de ebulição baixos. À pressão atmosférica padrão, a água ferve a 100ºC, o álcool etílico a 78,5°C o ar líquido a -190ºC e o hélio a -269ºC, isto é, quase 4 graus acima do zero absoluto (0K). Por que a pressão de vapor diminui com o aumento das forças intermoleculares? A evaporação consiste na fuga de moléculas da fase liquida de uma substância para a fase gasosa. Essas moléculas que escaparam, então, se movem livremente e rapidamente pelo ar, como moléculas de um gás. Quanto mais apolar as moléculas de um liquido, menos elas se atraem umas às outras, ou seja, quanto menor a força intermolecular “menos presa” à sua camada superficial as moléculas do liquido são. Por isso quanto mais apolar o liquido, mais volátil ele é. Por que a pressão de vapor diminui com o aumento da massa molar? O aumento da massa molar faz com que a fuga das moléculas da fase liquida para a fase gasosa seja diminuida, pois ela se torna mais “pesada” , o que dificultara a evaporação, diminuindo portanto a pressão de vapor. Resumindo: PRESSÃO MÁXIMA DE VAPOR A pressão que o vapor exerce no equilíbrio líquido-vapor denomina-se de pressão máxima de vapor. INFLUÊNCIA DA TEMPERATURA A temperatura influencia na pressão máxima de vapor de um líquido. A pressão de vapor de um liquido é maior quando a temperatura do liquido for maior! INFLUÊNCIA DA NATUREZA DO LÍQUIDO A volatilidade de um líquido está ligada diretamente à atração entre suas moléculas. Assim, quanto mais fracas forem as ligações intermoleculares, mais fácil será a evaporação e, portanto, maior será a pressão máxima de vapor do líquido. É importante saber que a pressão máxima de vapor de um líquido não depende da quantidade do líquido. PRESSÃO DE VAPOR TEMPERATURA DE EBULIÇÃO E A A ebulição de um líquido depende da pressão externa, isto é, quanto menor for a pressão externa menor será a sua temperatura de ebulição, pois irá ser necessário menos calor (menor temperatura) para a pressão de vapor do liquido se igualar a pressão externa (ponto de ebulição)
Download