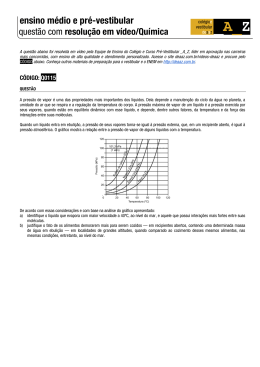
AULA PRÁTICA DE QUÍMICA GERAL “Estudando a água – parte 28” 9º NO DO ENSINO FUNDAMENTAL - 1º ANO DO ENSINO MÉDIO OBJETIVO Diversos experimentos, usando principalmente água e materiais de fácil obtenção, são possíveis e importantes para vivenciar as principais propriedades físicas e químicas da água, bem como de sua interação com outras substâncias. É desnecessário falar da importância de se conhecer as propriedades da água, principalmente em tempos que anunciam a escassez desse recurso. Além disso, o estudo da água permite introduzir a compreensão das propriedades de outras substâncias, ampliando os horizontes do entendimento científico de diversos fenômenos do cotidiano, que por sua vez, são inerentes às questões ambientais, industriais, culinárias, medicinais e muitas outras. INTRODUÇÃO Um dos conceitos científicos que mais confundem os estudantes é o de “pressão de vapor”. Até mesmo o “nome” dessa grandeza não nos ajuda, porque parece que que é uma substância totalmente no estado gasoso ou vapor que está exercendo essa pressão. Mas, quando falamos de pressão de vapor, estamos falando de um líquido em equilíbrio com seu vapor! E, geralmente, o contexto é a facilidade ou a dificuldade desse líquido de passar para o estado gasoso. Por isso é que se diz frequentemente “pressão de vapor de um líquido”. A passagem de um líquido para o estado gasoso será tão mais fácil e mais rápida, quanto maior for a sua pressão de vapor. Medindo a pressão de vapor. A pressão de vapor é medida com a substância líquida dentro uma câmara lacrada, totalmente sem ar, que pode ser acoplada a um tubo em “U” contendo mercúrio ou a um manômetro sensível. Depois de um tempo, com a ausência de pressão atmosférica interna, uma parte significativa do líquido passa para o estado gasoso, que depois entra em equilíbrio com a fase líquida. Esse equilíbrio significa que a quantidade de moléculas evaporando é a mesma que as moléculas que estão condensando. Mas, o mercúrio no tubo em “U” sofre um desnível, porque é empurrado pelas moléculas gasosas, o que pode ser lido como um valor de pressão em mmHg. Nesse momento, mede-se também a temperatura, indicadas em um termômetro. Moléculas de um líquido em equilíbrio com o seu vapor. Há a mesma velocidade de evaporação e de condensação. Se não houver nenhuma outra substância no sistema, um manômetro pode indicar o valor da pressão de vapor da substância na temperatura em que a medição for realizada. Disponível (acesso: 11.06.2015): https://commons.wikimedia.org/wiki/File:Vapor_pressure.svg Temperatura e agitação Uma grandeza que influencia de forma importante nos valores da pressão de vapor de qualquer substância é a temperatura. Essa grandeza está diretamente relacionada à energia cinética média das partículas, ou seja, à sua “agitação”. Quanto mais elevada a temperatura, mais agitadas estão as partículas do líquido. Quanto mais agitadas, mais afastadas umas das outras, e menor a força de atração entre elas, o que favorece a passagem para o estado gasoso. Assim, quanto mais quente o líquido, mais moléculas fazem a passagem para o estado gasoso e maior será a pressão de vapor. Natureza da substância Mas, as forças de atração entre as partículas de um líquido variam também em função da natureza da substância; dependendo de sua geometria molecular, da massa molecular e da intensidade da sua polaridade. Por isso, sob as mesmas condições de temperatura e pressão, a água é sempre menos volátil que o álcool, que por sua vez é sempre menos volátil que a acetona. Isso acontece porque a água possui suas moléculas com maior grau de polaridade que as do álcool e da acetona. Ou seja, as moléculas de água se atraem mais intensamente que as das outras duas substâncias. No caso da água, a força intermolecular predominante são as “ligações de hidrogênio”, bem mais intensas que as da acetona, por exemplo, cuja força predominante são as do tipo “dipolo-dipolo permanentes”. Esquema de um equipamento para medição do valor da pressão de vapor de um líquido. O líquido contido no balão oval é aquecido e a temperatura é monitorada por um sensor. O conjunto está imerso na água, para um aquecimento mais homogêneo. O tubo em “U” contém mercúrio, que sofre um desnível empurrado pelas moléculas gasosas vaporizadas no balão oval. Uma bomba de ar do lado de fora da água empurra novamente o mercúrio para que o nível seja recuperado e a leitura da pressão seja lida externamente no “sensor de pressão” ou manômetro (sensor pressure). Sempre que a leitura de pressão é realizada, a temperatura tem que ser lida. Disponível (acesso: 11.06.2015): https://commons.wikimedia.org/wiki/File:Isoteniscope.jpg Pode-se dizer, então, que a pressão de vapor é uma grandeza que indica a facilidade de evaporação de um líquido, ou seja, é a medida de sua “volatilidade”. Mas, a causa de todos esses fenômenos está nas forças de atração entre as partículas do líquido, cuja intensidade depende de sua geometria, polaridade e tamanho. Moléculas de água atraídas por “ligações de hidrogênio”. A forte polaridade da água é devida à intensa eletronegatividade do oxigênio e à baixa eletronegatividade do hidrogênio; o que faz os elétrons das ligações covalentes (dentro da molécula) ficarem mais deslocados para o oxigênio, polarizando-o negativamente; enquanto deixam o hidrogênio com deficiência de elétrons, polarizando-o positivamente. Por isso, cada molécula de água ter polos muito intensos, que funcionam como pequenos “ímãs elétricos”. Assim, as moléculas de água se atraem por polos contrários nos estados sólido e líquido, com forças mais intensas do que as apresentadas pelas moléculas menos polares. Não se esqueça de que não há ligações intermoleculares significativas no estado gasoso. Disponível (acesso: 11.06.2015): https://commons.wikimedia.org/wiki/File:Moleculah20.jpg Pressão de vapor versus pressão atmosférica. Se a pressão de vapor é a grandeza física que determina a volatilidade dos líquidos, pode-se dizer que a pressão atmosférica é a grandeza física que atrapalha a passagem dos líquidos para o estado gasoso. Isso porque a pressão atmosférica é um obstáculo efetivo, exercido pelo peso do ar sobre a superfície do líquido. A ebulição ou “fervura” só acontece quando a pressão de vapor consegue ser igual ou maior que a pressão atmosférica. EXPERIMENTO – Ebulição da água abaixo do “ponto”, por abaixamento da pressão atmosférica. MATERIAL A) Bico de Bunsen ligado ao sistema de gás. B) Tela de amianto. C) Tripé. Obs.: Os materiais de laboratório acima podem ser substituídos por um fogão simples ou por um ebulidor. D) Béquer de 500mL ou menor. E) Água destilada, de preferência. F) Termômetro de laboratório. G) Seringa plástica comum de 10mL ou maior, sem agulha. PROCEDIMENTO – Preparação 1. Coloque cerca de 400mL de água em um béquer. 2. Coloque o termômetro na água e acompanhe o aquecimento, até cerca de 80ºC. 3. Com o êmbolo da seringa totalmente fechado, insira a ponta da seringa na água. 4. Então, puxe um pouco de água quente para dentro da seringa até cerca de 10% do volume total da seringa. 5. Com a seringa na posição vertical, com a abertura para cima, empurre o êmbolo para retirar todo ar de dentro da seringa. Cuidado para não deixar cair água quente nas mãos. PROCEDIMENTO – Teste a 80ºC. 6. Tampe a saída da seringa com um dos dedos, vedando totalmente. 7. Puxe o êmbolo e observe se houve formação de bolhas. 8. Solte o êmbolo e veja se ele volte exatamente para a posição original, sem gases dentro da seringa. 9. Repita os itens 6, 7 e 8, de forma que possa observar bem a produção de bolhas dentro da seringa e seu desaparecimento quando o êmbolo volta para a posição original. Obs.: O comportamento que se espera é que o êmbolo volte à posição original, sem sinal de gases dentro da seringa. Se o êmbolo não volta para a posição original e deixa gases dentro da seringa, significa que a seringa está com entrada de ar. O recurso é trocar a seringa por outra. 10. Verifique qual é, aproximadamente, o volume mínimo da seringa capaz de produzir bolhas. PROCEDIMENTO – Teste a 50ºC. 11. Acompanhe o resfriamento natural da água contida no béquer, até que a temperatura chegue a cerca de 55ºC. 12. Repita todo o procedimento dos itens 3 até 10. PROCEDIMENTO – Teste à temperatura ambiente. 13. Recolha água na temperatura ambiente para dentro da seringa como orientado nos itens 3, 4 e 5. 14. Repita todo o procedimento dos itens 6 até 10. OBSERVAÇÕES E QUESTÕES 1) Por que não se pode dizer que as bolhas produzidas dentro da seringa no momento em que o êmbolo é puxado são formadas por vácuo? Comente e justifique. _______________________________________________________________________________ _______________________________________________________________________________ _______________________________________________________________________________ _____________________ 2) A produção de bolhas é um sinal de que houve ebulição da água. Mas, sabemos que para acontecer ebulição, a pressão de vapor tem que estar igual ou maior que a pressão atmosférica. Como a pressão de vapor depende da temperatura do líquido e da natureza da substância, pode-se afirmar que a seringa não interfere na pressão de vapor. Se é assim, o movimento do êmbolo interfere na pressão atmosférica dentro da seringa! Mas, como? Será possível que a pressão do ar atmosférico atue, se não há ar algum dentro da seringa e nenhum contato direto da parte interna da seringa com a atmosfera? Então, responda: Como a pressão atmosférica atua dentro da seringa? Dica: Pense no porquê o êmbolo volta à posição original quando o soltamos. _______________________________________________________________________________ _______________________________________________________________________________ _______________________________________________________________________________ _______________________________________________________________________________ ____________________________ 3) Você deve ter percebido que a pressão atmosférica atua, sim, dentro da seringa, mas de forma indireta. E que, como não há ar atmosférico dentro da seringa, seria mais adequado chamar a pressão no seu interior simplesmente de “pressão interna”. Então, responda: O movimento de puxar o êmbolo aumenta ou diminui a “pressão interna” da seringa? _______________________________________________________________________________ _______________________________________________________________________________ _______________________________________________________________________________ _______________________________________________________________________________ _______________________________________________________________________________ ___________________________________ 4) Você percebeu alguma diferença nos volumes mínimos para a produção de bolhas, que você anotou para as três temperaturas testadas? Comente. _______________________________________________________________________________ _______________________________________________________________________________ _______________________________________________________________________________ _______________________________________________________________________________ ____________________________ 5) Em qual das três temperaturas testadas, a água demonstrou mais facilidade de entrar em ebulição? Comente e justifique, usando as expressões abaixo, em ordem lógica de causa e efeito: temperatura agitação força de atração entre partículas pressão de vapor _______________________________________________________________________________ _______________________________________________________________________________ _______________________________________________________________________________ _______________________________________________________________________________ _______________________________________________________________________________ _______________________________________________________________________________ __________________________________________
Download