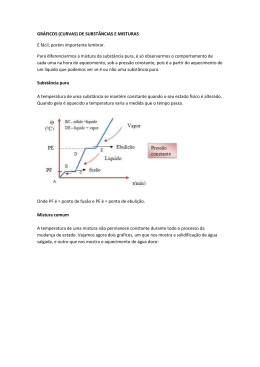
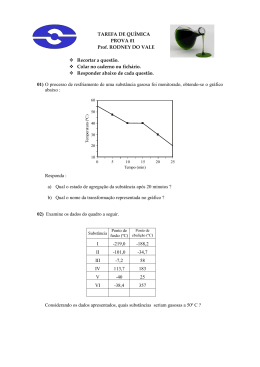
Instituto Federal de Educação, Ciência e Tecnologia de Alagoas – IF/AL Coordenadoria de Química Disciplina: Química ALAGOAS - 1º bimestre Aluno:................................................................. Prof. Luis Carlos F. Oliveira – IFAL- Campus Marechal/AL Elaboração: Prof. Dr. Johnnatan Duarte de Freitas – IFAL – Campus Maceió/AL Prof. MsC. Alan John Duarte de Freitas – IFRN – Campus Maceió/AL Prof. Mikael de Lima Freitas – Secretaria do Estado de Educação de Alagoas Maceió-AL 1 BREVES ASPECTOS HISTÓRICOS DO NASCIMENTO DA QUÍMICA A ciência como um objeto organizado de conhecimentos, apresenta-se dividida em varias disciplinas, entre elas a química, que estuda a natureza da matéria, suas propriedades, suas transformações e a energia envolvida nesses processos. O termo química tem origem no latim, chimica, palavra que deriva da alchimia, modificação da expressão árabe al kêmiya, cujo significado é “grande arte dos filósofos herméticos e sábios da idade media”. Apesar de se ter conhecimento de manifestações químicas muito antes da Idade Média (por exemplo, o preparo da liga metálica bronze e do vidro pelos egípcios em cerca de 3000 a.C.), foram os alquimistas (de 300 a 1400) que contribuíram de forma acentuada para o desenvolvimento do que constituiria a ciência Química. Na busca, sem sucesso, da pedra filosofal (que teria o poder de transformar qualquer metal em ouro) e do elixir da longa vida (que daria a imortalidade), fatos retratados no filme Harry Potter e a Pedra Filosofal, os alquimistas introduziram e aperfeiçoaram técnicas de metalurgia, sintetizaram várias substâncias, isolaram outras, além de terem registrado um grande número de experimentos em suas observações. Um capítulo importante no período alquímico é o surgimento da Latroquímica, ou Química medicinal, cujo desenvolvimento se deve ao alquimista e médico suíço Theophrastus Bombastus von Hohenheim (1493-1541), mais conhecido por Pracelsus, pioneiro na utilização de produtos químicos puros para tratar doenças, em vez de usar misturas com composição indeterminada. A partir do século XVII, a ciência se transforma, tornando-se mais experimental e menos filosófica: multiplicam-se as observações e as experiências; os fenômenos são classificados; procuram-se vínculos entre esses fenômenos; e são elaboradas hipóteses explicativas. Surge então a necessidade de um aprofundamento das relações matemáticas, de novos experimentos com aparelhagens mais precisas, de troca de informações e uma maior organização. Dentre os cientistas com essa nova proposta, destacam-se o inglês Robert Boyle (1627-1691) - com seus estudos sobre o comportamento dos gases, a distinção entre mistura e “combinação” e o francês Antonie Laurent Lavoisier (17431794) – com a publicação, em março de 1789, de seu traité elementaire de Chimie (tratado elementar de Química), ele estabelece um marco no surgimento da química moderna; esse tratado é um resumo de seu trabalho, no qual podemos destacar o principio da conservação da Massa, a descoberta do elemento oxigênio e sua participação nas reações, de combustão, a primeira análise quantitativa da composição da água, estudos sobre fermentação e respiração. Por seu trabalho, Lavoisier é considerado “pai da Química”. Antoine Laurent Lavoisier 2 A partir de então, começou a surgir um grande numero de trabalhos importantes, como no século XIX, a aplicação da Química à Biologia, feita pelo químico e bacteriologista francês Louis Pasteur (1822-1895) e no século XX, as descobertas sobre a estrutura do átomo, envolvendo vários cientistas. A IMPORTÂNCIA DA QUÍMICA É considerado que tudo à nossa volta é química, pois todos os materiais que nos cercam passaram ou passam por algum tipo de transformação. Vejamos alguns exemplos. Na limpeza de casa, usamos diversas substâncias, como detergentes, alvejantes, desinfetantes. Em nossa higiene pessoal, usamos sabonete, xampu, creme dental, além de água, que passa por vários tratamentos químicos antes de chegar as nossas casas. A maioria das roupas que usamos apresenta fios artificiais (náilon, poliéster) misturados a fibras naturais (algodão, lã). Nossos alimentos naturais (frutas, verduras, etc.) precisam de fertilizantes pesticidas, agentes de controle biológico, feromônio para sua produção. A maioria dos meios de transporte tem como combustíveis a gasolina, o gás natural veicular (GNV), o querosene, etc., que são extraídos do petróleo, este é o resultado de uma transformação natural que levou milhões de anos. Além disso, o álcool etílico (Etanol) obtido através da fermentação da cana-deaçúcar, beterraba, milho etc. A expectativa de vida do homem aumentou muito graças ao desenvolvimento da indústria farmacêutica (analgésicos, antibióticos, antiinflamatórios, etc.) e da medicina. São muitos os produtos industrializados cuja obtenção depende de transformações químicas: plásticos, vidros, tintas, cimento, papel, fotografia, etc. O próprio corpo humano é formado por inúmeras substâncias em constante transformação, que possibilitam a movimentação, os sentidos, (visão, audição, olfato, tato, gosto), a digestão, a respiração e o nosso pensamento. Produtos químicos utilizados no dia-a-dia 3 Pelos exemplos acima, percebemos que a Química proporcionou progresso, desenvolvimento e bem estar para a nossa vida, e nos dias atuais persiste como uma das ciências que mais interfere no desenvolvimento do mundo com o objetivo de proporcionar melhores condições de vida. Contudo, é comum ouvirmos comentários que depreciam essa ciência, relacionando-a a desastres ecológicos (derramamento de petróleo nos mares), poluição (fumaça das chaminés) e envenenamento (agrotóxicos). Impacto ambiental ocasionada por produtos químicos Esses fatos, infelizmente, encobrem as importantes conquistas do homem pelo conhecimento químico. Na verdade, o problema não está na química, mas o seu uso – ela, em si, não é boa nem má. Ainda são muitos aqueles que, movidos por interesses pessoais ou de grupos, utilizam-na para conquistar ou manter privilégios. Mudar essa situação não é papel apenas do químico, mas de toda a sociedade, que deve ser critica e participativa, exigindo que o conhecimento promova uma qualidade de vida cada vez melhor e que permita uma coexistência harmoniosa entre o homem e o meio ambiente. “Quando o homem matar o último peixe, poluir o último rio e derrubar a última árvore, irá compreender que não poderá comer o dinheiro que ganhou”. (provérbio indígena) “Salienta-se, este módulo de Química é um material didático elaborado por seus professores para auxiliar na difusão e disseminação do conhecimento. Entretanto, o Livro ainda é um dos principais meios para o enriquecimento do conhecimento”. MATÉRIA A água, o fogo e a madeira são exemplos de matéria, pois possuem massa e ocupam lugar no espaço, ou seja, têm volume. Assim, a matéria é tudo aquilo que ocupa lugar no espaço e possui massa. A matéria se apresenta em porções limitadas, que recebem o nome de corpos. Se essas porções se prestam a certo uso, elas são chamadas de objetos. Corpo é qualquer porção limitada de matéria; Objeto é uma porção limitada de matéria que, por sua forma especial, presta-se a de determinado uso. Existem vários tipos de matéria, na química, cada uma é chamada de substância. A água, o ferro, o açúcar e o gás carbônico são exemplos de substâncias. Observe a figura abaixo, matéria, corpo, objetos e os impactos provocados pelo desenvolvimento artístico, cultural e científico-tecnológico. 4 Matéria, corpo e objetos ENERGIA Durante a queima de uma vela (matéria), esta se desgasta, produzindo fumaça (matéria: fuligem e gases) e liberando energia (luz: energia luminosa; calor: energia calorífica). Na subida de um foguete, o combustível (matéria) se transforma em calor (energia), provocando um empuxo que transforma o estado de repouso em estado de movimento. Desse modo, podemos conceituar energia como tudo aquilo que pode modificar a matéria, provocar ou anular movimentos e ainda, causar sensações. Há uma relação direta entre trabalho e energia. Eletrodomésticos que utilizam energia elétrica Analisando os exemplos dados acima, notamos que matéria e energia não podem ser criadas nem destruídas; podem somente ser transformadas. É o chamado Princípio da conservação da matéria e Energia. UNIDADES DE MEDIDAS Em química, para realizar qualquer experimento, além dos conceitos básicos de matéria e energia, também é necessário conhecer algumas unidades de medidas. A medida de uma grandeza é um número que expressa uma quantidade, comparada com um padrão previamente estabelecido. Massa (m): a quantidade de matéria que existe num corpo. 5 A determinação da massa de um corpo é feita pela comparação da massa desconhecida desse corpo com outra massa conhecida, um padrão. Para essa determinação usa-se um aparelho chamado balança. Balanças de pratos Balanças analíticas digitais No sistema Internacional (SI), massa é o quilograma (Kg). quilograma (Kg) grama (g) miligrama (mg) a unidade-padrão de 1 000 g ou 103 g 1 g ou 100 g 0,001 g ou 10-3 g Volume (V): corresponde a extensão de espaço ocupado por um corpo. No sistema Internacional (SI), a unidade-padrão de volume é o metro cúbico (m3). m3 1 000 dm3 ou 1 000 L 3 dm ou L 1 dm3 ou 1 L 0,001 dm3 ou 0,001 L cm3 ou mL 10-3 dm3 ou 10-3 L Num laboratório, os volumes dos líquidos podem ser obtidos de várias maneiras, usando-se diferentes aparelhos, em função do volume de líquido a ser determinado. 6 Béquer Proveta Erlenmayer Balões volumétricos Pipeta Buretas Temperatura (T): relaciona-se com o estado de agitação das partículas que formam um corpo e com a capacidade de transmitir ou receber calor. Os valores de temperatura são determinados por um aparelho chamado termômetro. Os mais comuns são os que consistem de um fino tubo graduado e parcialmente cheio de mercúrio ou álcool colorido, que à medida que a temperatura aumenta, o líquido se expande e se move ao longo do tubo. Existem também termômetros digitais, que dão uma medida mais precisa da temperatura. Termômetro de bulbo Termômetro digital Termômetro com IV 7 A graduação do tubo indica a variação de temperatura do líquido. Essa graduação é a escala termométrica do aparelho. A escala de graduação mais comumente usada em trabalhos científicos é a escala Celsius (ºC). Ela possui dois pontos de referência: o congelamento e a ebulição da água ao nível do mar, que correspondem respectivamente, a 0 ºC e 100 ºC. Existem outras escalas centígradas, como a Kelvin, recomendada pelo SI e conhecida como escala absoluta. As escalas Kelvin e Celsius se relacionam matemáticamente da seguinte maneira: TK = TC + 273 Pressão (P): relação da força exercida sobre uma dada superfície, e a área dessa superfície. P = F (N) A (m2) A terra está envolvida por uma camada de ar que tem espessura de aproximadamente 800 km. Essa camada de ar exerce pressão sobre os corpos ao nível do mar, e é denominada de pressão atmosférica. Os primeiros estudos na determinação da pressão atmosférica estão baseados nos trabalhos do físico Evangelista Torriceli. Influência da altitude na pressão Pelo Sistema Internacional (SI), a unidade-padão é o pascal (Pa), que se relaciona com a unidade atmosfera na seguinte proporção: 1 atm = 101 325 Pa ou, aproximadamente, 1 atm = 100 kPa Outras relações para unidade de pressão. atm 1 Unidades de pressão cm Hg mm Hg torr 76 760 760 kPa 100 8 Densidade (d): relação (razão) entre a massa de um material e o volume por ele ocupado. d = m (kg) V (m3) Para sólidos e líquidos, a densidade geralmente é expressa em gramas/centímetros cúbicos (g/cm3); para gases, costuma ser expressa em gramas/litro (g/L). Sejam duas bolinhas, uma de ferro e outra de cortiça, ambas de mesmo volume (1 cm3, por exemplo). A massa correspondente à bolinha de ferro é de 7,86 g e a massa correspondente a bolinha de cortiça é de 0,32 g. Espécie de matéria Cortiça Água Ferro Densidade (g/cm3) 0,32 1,00 7,86 Ao ser colocada num copo com água, a bolinha de ferro afunda, enquanto a bolinha de cortiça fica na superfície da água, isto é, flutua. Ser mais denso significa ter mais massa por unidade de volume, ou, comparando-se volumes iguais, o mais denso é o de maior massa. Exercício 1) Qual foi a contribuição dos alquimistas para o que se conhece hoje como química? 2) Seria exagero considerar tudo como química? Explique. 3) Nos dias atuais, identifique aplicações da Química e expresse com suas palavras o que ela estuda. 4) Transforme as massas em gramas (g): a) 0,20 kg b) 200mg 5) Transforme os volumes em litros (L): a) 1 dm3 b) 100 mL c) 200 cm3 d) 3 m3 6) Transforme as temperaturas: a) 27 ºC em Kelvin (K) b) 500 K em ºC (Celsius) 9 7) Transforme as pressões a) 1 520 mm Hg em atm b) 0,5 atm em mm Hg 8) (Unicamp-SP) Três frascos de vidro transparente, fechados, de formas e dimensões iguais, contêm cada um a mesma massa de líquidos diferentes. Um contém água (H2O), o outro, clorofórmio (CHCl3) e o terceiro etanol (C2H5OH). Os três líquidos são incolores e não preenchem totalmente os frascos, os quais não têm nenhuma identificação. Sem abrir os frascos, como você faria para identificar as substâncias. 9) (ENEM) Pelas normas vigentes, o litro do álcool hidratado que abastece os veículos deve ser constituído de 96 % de álcool puro e 4 % de água (em volume). As densidades desses componentes são dadas na tabela. Substância Densidade (g/L) água 1 000 álcool 800 Um órgão de defesa do consumidor inspecionou cinco postos suspeitos de venderem álcool hidratado fora das normas. Colheu uma amostra do produto em cada posto, mediu a densidade de cada uma, obtendo: Posto I II III IV VI Densidade de combustível (g/L) 822 820 815 808 805 A partir desses dados, o técnico pode concluir que estavam com o combustível adequado somente os postos: a) I e II. b) I e III c) II e IV d) III e V e) IV e V 10) Observe a tabela: Substância Densidade água 1,0 g/cm3 benzeno 0,90 g/cm3 clorofórmio 1,53 g/cm3 Esses três materiais foram colocados numa proveta, originando um sistema com aspecto como mostrado. Relacione as substâncias A, B, C com aquelas mencionadas na tabela. Justifique. 10 SUBSTÂNCIAS PURAS E MISTURAS Neste estudo, veremos como se identificam as substâncias e como se diferencia substancia pura de mistura. Por meio das observações teóricas, você aprenderá que as substâncias podem ser identificadas por algumas de suas propriedades, como, por exemplo, ponto de fusão, ponto de ebulição e densidade. A água contida neste copo que você esta observando, é uma substância pura ou mistura? Por quê? Substância pura Tipo de matéria formada por unidades químicas iguais, sejam átomos ou moléculas, e por esse motivo apresentam propriedades químicas e físicas próprias. As substâncias puras podem ser classificadas como simples ou composta. Substância Simples: formada por um ou mais átomos de um mesmo elemento químico. Por exemplo, gás hélio (He), gás oxigênio (O2), gás ozônio (O3) e fósforo (P4). Substância Composta: formadas por átomos de dois ou mais elementos químicos. Por exemplo, água (H2O), gás cianídrico (HCN) e amônia (NH3). Estados Físicos da Matéria A matéria pode ser encontrada em três estados físicos: sólido, líquido e vapor (gasoso). 11 Ponto de fusão e ponto de ebulição A temperatura constante na qual um sólido se transforma em liquido é denominada ponto de fusão (PF). O ponto de fusão pode ser determinado experimentalmente através do aquecimento gradativo da substância utilizando um tudo de Thiele ou com aparelhos digitais, denominados aparelhos de ponto de fusão. Tudo de Thiele Montagem com o Tudo de Thiele para determição do PF Aparelho de ponto de fusão digital A temperatura constante na qual um líquido se transforma em vapor recebe o nome de ponto de ebulição (PE). Observe o seguinte gráfico: o T ( C) Durante a ebulição a temperatura permnece constante 100 Durante a fusão a temperatura permnece constante 0 O D LI Ó S Sólido a o 0 C Sólido + Líquido a o 0 C O D UI Líquido a Q LÍ o 100 C Líquido + Vapor a o 100 C R PO VA Vapor a o 100 C t(min) Líquido a 0 oC Uma leitura atenta do gráfico permite considerar que: No intervalo de tempo em que ocorre a fusão da substância (água), coexistem a fase sólida e a fase líquida, e a temperatura permanente constante; Ao atingir a temperatura de 100 °C (a 1 atm), a água líquida começa a ferver (líquido-vapor) e, durante todo o tempo em que ocorre essa mudança de estado, a temperatura permanece constante até que todo o líquido se transforme em vapor (nesse intervalo de tempo, coexistem a fase líquida e a fase vapor); Conhecidos os pontos de fusão e de ebulição de uma substância é possível prever seu estado físico em qualquer temperatura. Se a temperatura dessa substancia estiver abaixo do seu ponto de fusão, ela se encontrará no estado sólido; se estiver acima de seu ponto de ebulição, estará no estado gasoso; se estiver compreendida entre o ponto de fusão e o ponto de ebulição, estará no estado líquido. 12 Faça uma pesquisa e responda qual a diferença entre o estado gasoso e vapor. Substância Pura e Mistura Uma espécie ou um conjunto de espécies de matéria isoladas para um estudo constitui um sistema. Todo sistema cuja fusão e ebulição ocorrem a uma temperatura constante (ou seja, desde que se inicia a mudança de estado até o seu final não se observa variação de temperatura) é chamado de substância pura, ou simplesmente substância. O gráfico anteriormente mostrado é característico de substância pura. Esse conceito se aplica a qualquer amostra do sistema analisado, independentemente do seu tamanho. Todo sistema cuja temperatura sofre variação durante a fusão e/ou ebulição é chamado de mistura. As misturas caracterizam-se por apresentar uma faixa de temperatura em que ocorre a fusão ou a ebulição. Observe os seguintes gráficos: o T ( C) Durante a ebulição a temperatura permnece constante R PO VA 100 Durante a fusão a temperatura permnece constante 0 O D LI SÓ Sólido a o 0 C Sólido + Líquido a o 0 C O D UI Líquido a Q LÍ o 100 C Líquido + Vapor a o 100 C Vapor a o 100 C t(min) Líquido a 0 oC substância pura o T ( C) Ebulição ocorrenuma faixa detemperatura Final da ebulição Início daebulição Final da fusão R O AP V Vapor Fusão ocorre numa faixa detemperatura Início dafusão O ID L SÓ Sólido O ID U Q Líquido LÍ Líquido + Vapor Líquido Sólido + Líquido t(min) mistura As substâncias puras possuem pontos de fusão e de ebulição constantes, enquanto as misturas não apresentam pontos de fusão e de ebulição definidos. Constituem exceção algumas misturas de sólidos, denominadas eutéticas (que fundem à temperatura constante) e algumas misturas de líquidos, denominadas azeotrópicas (que fervem a temperatura constante). 13 Observe os seguintes gráficos: t(min) R O P VA Ebulição ocorre numa faixa de temperatura Final da ebulição Início da ebulição Fusão a temperatura constante Vapor O D UI Líquido LÍQ Fusão ocorre a temperatura constante DO LI Ó S Sólido Sólido + Líquido Líquido + Vapor Líquido t(min) Mistura eutética: solda (estanho + chumbo) o T ( C) Ebulição ocorre a temperatura constante Ebulição a temperatura constante Fusão ocorre numa faixa detemperatura Final da fusão Início dafusão O ID L SÓ Sólido O ID QU Líquido LÍ Líquido + Vapor R PO A V Vapor Líquido Sólido + Líquido t(min) Mistura azeotrópica: álcool comum (96 % de de etanol e 4% de água) O ponto de fusão, o ponto de ebulição e a densidade servem para identificar as diferentes substâncias puras e diferenciar as substancias puras das misturas. São denominadas propriedades específicas da matéria. Generalizando, temos: Material (sistema) Temperatura durante a Temperatura durante a Fusão ebulição Substância pura Constante Constante Mistura comum Varia Varia Mistura eutética Constante Varia Mistura azeotrópica Varia Constante 14 SISTEMA HOMOGÊNEO E SISTEMA HETEROGÊNEO Consideremos os seguintes sistemas: Um sistema que apresenta um aspecto visual uniforme em todos os seus pontos é denominado homogêneo, quando não apresenta é denominado de Heterogêneo. Então temos: Sistema 1, homogêneo (um único componente); Sistemas 2 e 3, heterogêneos (dois ou mais componentes). Fase: é cada porção visualmente uniforme de um sistema. O sistema 1, é visualmente uniforme em toda sua extensão, ou seja, possui apenas uma fase. São sistemas heterogêneos os que apresentarem duas ou mais fases, sistemas 2 e 3, como se observa, apresentam superfície de separação. Ampliando os estudos, temos que: O número de componentes de um sistema não é obrigatoriamente igual ao número de fases. Exemplos: água + gelo (1 componente e 2 fases); água + sal (2 componentes e 1 fase); Uma fase não é necessariamente contínua, pois pode estar separada. Exemplos: água como uma pedra de gelo ou água com 2 pedras de gelo; Toda mistura gasosa é homogênea (vários componentes e uma única fase), observe nossa atmosfera você consegue identificar os gases presentes?; Sempre que dois ou mais sólidos forem misturados, os sistemas serão constituídos de tantas fases quantos forem os sólidos (cada sólido corresponderá a uma fase). Exemplos: sal + areia (2 componentes e 2 fases); sal + açúcar + areia (3 componentes e 3 fases). MÉTODOS DE SEPARAÇÃO Análise imediata As amostras de matéria que retiraremos da natureza geralmente são misturas e é importante conhecer os componentes que as formam. Desse modo, quando um químico retira uma amostra e constata que se trata de uma mistura, seu primeiro trabalho é separar esses componentes, aplicando o que chama de análise imediata, 15 ou seja, um conjunto de processos que se baseiam nas propriedades físicas da matéria e visam separar os componentes de uma mistura, sem alterá-los. A separação das substâncias ocorre graças às diferenças em suas propriedades físicas. Vejamos algumas. Tamanho da partícula Para separar substâncias em função do tamanho de suas partículas utiliza-se a técnica de filtração. O filtro retém as partículas maiores e deixa passar as menores (o filtrado). Vejamos dois exemplos: Café sendo coado mistura heterogênea (sólido + liquido). Aspirador retirando impurezas mistura heterogêneo (sólido + gás). No laboratório, para acelerar a filtração, acostuma-se usar um dispositivo chamado trompa de vácuo, cujo objetivo é tornar o ar baixo do filtro mais rarefeito e, com isso, forçar a passagem mais rápida do líquido. Ponto de ebulição A separação das substâncias que ocorre pela diferença nos pontos de ebulição se dá através do usado da destilação. No caso de uma mistura homogênea composta por sólido e líquido, usamos a destilação simples: aquecendo a mistura num balão apropriado, ao qual se adapta um condensador, o liquido entra em ebulição, passando para o estado gasoso. Assim, os vapores de líquido, ao entrarem no condensador, sofrem condensação e são recolhidos num béquer. Com isso, temos o sólido no balão e o líquido no béquer. 16 Para uma mistura homogênea composta por líquido e líquido, utiliza-se a destilação fracionada: aquece-se a mistura (na qual estão cacos de cerâmica ou bolinha de vidro, constituindo um obstáculo à passagem dos vapores; os vapores do líquido com menor PE conseguem vencer esses obstáculos e passar para o condensador) colocada num balão com a mesma aparelhagem da destilação simples, mas adapta-se uma coluna de fracionamento ao balão. Densidade Para separa substancias por diferença de densidade, utiliza-se a decantação: após certo tempo, a substância mais densa se deposita no fundo do recipiente. Observe as figuras a seguir em que temos uma mistura heterogênea de água e barro: acima, água barrenta; abaixo, água mais o barro depositado no fundo do recipiente. Após a deposição, inclina-se o recipiente para se escoar o líquido. No caso de uma mistura heterogênea composta por liquido mais liquido, usase um funil de decantação (ou funil de bromo). Após a decantação, abre-se cuidadosamente a torneira, deixando passar o liquido mais denso. 17 Solubilidade Para separar substâncias por diferença de solubilidade, utiliza-se a técnica chamada dissolução fracionada, sendo usada no caso de misturas de sólidos em que só um deles se dissolve em determinado líquido. Considere uma mistura de areia e sal (cloreto de sódio). Para separar a areia e sal, usamos a dissolução fracionada, tendo como líquido a água. Adicionada água à mistura, o sal se dissolve. Usando a filtração, retemos a areia no filtro e, aquecendo o filtrado (sal dissolvido na água), recuperamos o sal pela evaporação da água. Além desses métodos citados temos: Catação: usando para separar os componentes sólidos mais sólido de uma mistura heterogênea. É bastante rudimentar, sendo empregado somente quando as partículas são bem distintas e podem ser separadas com as mãos ou com pinças. É o que ocorre quando uma pessoa escolhe feijão; Separação magnética: usando para separar metais que podem ser atraídos por um ímã ou eletroímã (metais ferrosos, níquel e cobalto) de metais nãoferrosos ou de componentes que não são atraídos pelo ímã ou eletroímã (portanto, misturas heterogêneas de sólido mais sólido); 18 Ventilação: também usado para separar os componentes sólidos de uma mistura heterogênea, por diferença de densidade; uma corrente de ar arrasta o componente menos denso. É o que ocorre, por exemplo, no beneficiamento de cereais, para separar, as cascas; Levigação: também empregado quando os componentes sólidos de uma mistura heterogênea têm densidades diferentes, só que usando uma corrente de água, que arrasta o componente menos denso. Usado, por exemplo, nos garimpos para lavar o cascalho; Sublimação: usado quando um dos componentes sólidos de uma mistura heterogênea sublima. É o caso da mistura heterogênea sublima. É o caso da mistura de areia e iodo: aquecendo-a, o iodo sublima e a areia fica depositada no fundo. Veja: 19 Exercício 11) (Mackenzie) No gráfico adiante, de mudança de fase de agregação de uma substância, provocada pelo aumento de temperatura, o nome correto das transformações ocorridas nos intervalos X e Y são: a) solidificação e condensação. b) fusão e ebulição. c) liquefação e vaporização. d) sublimação e sublimação. e) fusão e liquefação. 12) (Fuvest) Ácido acético e bromo, sob pressão de 1atm, estão em recipientes imersos em banhos, como mostrado na figura adiante. Nessas condições, qual é o estado físico preponderante de cada uma dessas substâncias? Dados: o ácido acético apresenta temperatura de fusão igual a 17°C e temperatura de ebulição a 1 atm igual a 118°C. O bromo apresenta temperatura de fusão igual a - 7°C e temperatura de ebulição a 1 atm igual a 59°C. a) ácido acético sólido e bromo líquido. b) ácido acético líquido e bromo gasoso. c) ácido acético gasoso e bromo sólido. d) ácido acético sólido e bromo gasoso. e) ácido acético gasoso e bromo líquido. 13) (UFsm) Observe o gráfico: Assinale a verdadeira (V) ou falsa (F) em cada afirmativa a seguir. ( ( ( ( ) O gráfico representa a curva de aquecimento de uma mistura eutética. ) A temperatura de fusão do sistema é variável. ) O sistema tem mais de uma fase no instante t3. ) A temperatura de ebulição do sistema é constante. 20 A seqüência correta é a) F - V - V - V. b) F - V - F - F. c) V - F - F - V. d) V - F - V - V. e) V- F - V - F. 14) (Mackenzie) Constitui um sistema heterogêneo a mistura formada de: a) cubos de gelo e solução aquosa de açúcar (glicose). b) gases N‚ e CO‚. c) água e acetona. d) água e xarope de groselha. e) querosene e óleo diesel. 15) O tratamento da água que a CASAL distribui, consiste basicamente na adição de sulfato de alumínio, ácido sulfúrico, cloro, flúor e outros produtos químicos. A água, após o tratamento, classifica-se como: a) mistura homogênea b) mistura heterogênea c) mistura azeotrópica d) substância simples 16) (Ufpe) Qual dos seguintes processos pode ser usado para extrair sal de cozinha da água do mar? a) Filtração b) Decantação c) Destilação d) Diluição e) Eletroforese 17) (Ufpe) Associe as atividades diárias contidas na primeira coluna com as operações básicas de laboratório e fenômenos contidos na segunda coluna. (1) preparar um refresco de cajá a partir do suco concentrado (2) adoçar o leite (3) preparar chá de canela (4) usar naftalina na gaveta (5) coar a nata do leite ( ( ( ( ( ) sublimação ) diluição ) filtração ) extração ) dissolução Os números da segunda coluna, lidos de cima para baixo, são: a) 3, 2, 5, 4, 1 b) 1, 3, 4, 5, 2 c) 4, 3, 2, 1, 5 d) 3, 2, 4, 5, 1 e) 4, 1, 5, 3, 2 21 18) Na preparação do café a água quente entra em contato com o pó e é separada no coador. As operações envolvidas nessa separação são, respectivamente: a) destilação e decantação. b) filtração e destilação. c) destilação e coação. d) extração e filtração. e) extração e decantação. 19) Um químico recebe uma amostra de uma mistura homogênea de água e açúcar e é incumbido de separar os componentes dessa mistura. Como você acha ele irá proceder? 20) Temos uma mistura homogênea de água (líquido) e acetona (líquido). Qual é o processo de fracionamento mais indicado para separar os componentes dessa mistura? (Os pontos de ebulição da água e da acetona não são próximos). 21) Você e seus amigos foram a um piquenique. Depois do lanche, resolveram tomar café. Havia quase tudo o que era necessário: pó de café, açúcar, panela e fogareiro, mas esqueceram o coador e não havia nada para substituí-lo. Como se poderia contornar a situação? 22) Indique qual a técnica mais utilizada para separar as misturas abaixo. Justifique. a) água e açúcar b) limalha de ferro e serragem c) éter (PE = 34 °C) e pentano (PE = 36 °C) d) água e clorofórmio (líquidos imiscíveis) e) sal e carvão em pó f) sal e naftalina em pó FENÔMENO E REAÇÃO QUÍMICA Fenômeno Para a ciência, fenômeno é qualquer acontecimento da natureza. Quando ocorre um fenômeno, uma transformação, pode haver ou não alteração no sistema que se está estudando, ou seja, a matéria dos estados inicial e final pode ser a mesma ou não. Consideramos como sistema um conjunto de materiais isolados para fins de estado (tomado para estudo). Os fenômenos são classificados em: Físicos: quaisquer transformações sofridas por um material sem que haja alteração de sua constituição íntima (suas propriedades). 22 Eletricidade Movimento de um cilcista Madeira sendo cortada Químicos: quaisquer transformações sofridas por um material de modo que haja alteração de sua constituição íntima (suas propriedades). Escurecimento de uma maçã após cortada Madeira queimando Reações que ocorrem no corpo humano 23 Reação química Todo fenômeno químico, ou transformação química, constitui uma reação química, cuja representação gráfica recebe o nome de equação química. Representação de uma reação química: A+B C+D Regagentes Produtos GásHidrogênio H2 (G) + GásOxigênio Água + 1/2 O2 (G) H2O(L) Sinais que evidenciam a ocorrência de uma reação química Pode-se reconhecer, por meio de alguns experimentos bastante simples, sinais que evidenciam a ocorrência de uma reação química. Experimento 1 Coloque um comprimido de sonrisal em um copo com água. Imediatamente nota-se o aparecimento de bolhas gasosas (efervescência) na superfície do comprimido. A efervescência ocorre até o comprimido ser totalmente dissolvido. Ao se misturarem reagentes, o aparecimento de bolhas gasosas normalmente evidencia que está ocorrendo uma reação química. Experimento 2 A uma solução aquosa de hipoclorito de sódio, NaClO, (água sanitária), coloque um tecido de algodão. Após alguns instantes, o tecido irá perdendo a coloração original, processo conhecido pelas donas de casa por desbotamento. Ao se misturarem reagentes, a mudança de cor normalmente evidencia que está ocorrendo uma reação química. Experimento 3 Num frasco adequado, misture uma solução de ácido muriático (usado para limpeza de pisos), incolor, com uma solução de soda cáustica (usada para desentupimento de pias, ralos etc.), também incolor, a solução resultante continuará incolor, e, se você tocar no frasco, sentira que ele está quente. Ao se misturarem reagentes, a mudança de temperatura normalmente evidencia que está ocorrendo uma reação química. Experimento 4 Misture sulfato de alumínio de cal (essas duas substâncias são utilizadas para a purificação da água nas estações de tratamento, ou então nas piscinas). O sulfato 24 de alumínio misturado com a cal resulta numa substância gelatinosa em forma de flocos (vistos a olho nu). Ao se misturarem reagentes em solução, o aparecimento de substâncias gelatinosas ou de sólidos normalmente evidencia que está ocorrendo uma reação química. LEIS PONDERAIS DAS REAÇÕES QUÍMICAS Leis ponderais são aquelas que relacionam as massas das substanciais que participam de uma reação química. Elas foram estabelecidas no final do século XVIII e início do XIX e fizeram a química ingressar em uma nova era do conhecimento, pois as teorias eram fundamentadas em experiências. Assim, temos a lei da conservação da massa (ou Lei de Lavoisier, de 1774) e a lei das promoções constantes (ou Lei de Proust, de 1799). Lei da Conservação da Massa – Lei de Lavoisier Lavoisier chegou a essa lei determinando a massa total de um sistema fechado (isolado do meio) antes e depois de ocorrer uma reação química. Observe os esquemas: Por eles, podemos verificar que a massa do sistema antes da reação é a mesma depois da reação. Assim, depois de realizar inúmeras experiências, Lavoisier enunciou a Lei da conservação da massa: “Numa reação química, em sistema fechado, a massa total é constante”. Ou, ainda, de forma poética, como ela é bastante conhecida: “Na natureza, nada se perde, nada se cria, tudo se transforma”. Leis das Proporções Constantes – Lei de Proust No quadro a seguir estão relacionadas as massas de mercúrio e de oxigênio utilizadas em três experimentos para formar óxido de mercúrio. 25 Experimento I II III Mercúrio + Oxigênio → Óxido de mercúrio 200 g 16 g 216g 75 g 6g 81g 125 g 10 g 135g Determinando a relação entre a massa de mercúrio e a de oxigênio, temos: I. 200 16 = 25 2 II. 75 6 = 25 2 = 25 2 III. 125 10 Ou seja, no óxido de mercúrio, a razão entre as massas de mercúrio e oxigênio é sempre 25/2. Em 1799, o químico francês Joseph Louis Proust (1754-1826) fez observações dessa natureza, levando-o a enunciar a lei das proporções constantes: “Uma substância, independentemente do método de obtenção apresenta os seus constituintes combinados em uma proporção, em massa, constante e definida”. Mais tarde, os químicos perceberam que a lei de Proust podia ser generalizada para qualquer reação química. Assim, “numa reação química, as massas das substâncias que reagem e das substâncias que se formam estabelecem sempre uma proporção. Então: A + B C mA mB mC mD m'A m'B m'C m'D mA m'A = mB m'B = mC m'C + = D mD m'D No exemplo a seguir veja a aplicação das Leis Ponderais. 1º) Considere que 20 g de hidrogênio reagem completamente (ou seja, não sobra hidrogênio como reagente) com 160 g de oxigênio, produzindo água. Determine: a) a massa de oxigênio necessária para se obterem 18 g de água; b) o reagente em excesso e a sua massa se colocarmos 10 g de hidrogênio em contato com 32 g de oxigênio. Resposta Pela lei de Lavoisier, podemos escrever: 26 hidrogênio + 20 g oxigênio água 160 g 180 g Aplicando a Lei de Proust, temos: a) oxigênio b) água 160 g x = 180 g 18 g x = 16 g 20 g 10 g = 160 g x x = 80 g Isso significa que 10 g de hidrogênio necessitam de 80 g de oxigênio. Como só existem 32 g de oxigênio, há excesso de hidrogênio. Aplicando novamente a lei de Proust, vem : 20 g y = 160 g 32 g y = 4g Logo: massa de hidrogênio presente = 10 g - massa de hidrogênio de que reagiu = 4 g . massa de hidrogênio em excesso = 6 g 2º) Considere que 6 g de carbono reagem totalmente com 2 g de hidrogênio, produzindo metano. Determinar a composição centesimal do metano. A composição centesimal indica as quantidades, em massa, dos elementos presentes em cem unidades de massa do referido composto. Exercício de aprendizagem 23) Indique na relação abaixo os fenômenos físicos e químicos. a) queima da gasolina nos motores dos carros b) digestão dos alimentos ingeridos c) ascender uma lâmpada d) formação de ferrugem e) quebra de um objeto f) enfiar um prego na madeira g) derretimento de um iceberg h) crescimento de uma planta 24) Aquecer uma barra de ferro até o ponto de fusão, recolher o líquido em uma fôrma esférica, transformando a barra em uma bola de ferro, é exemplo de fenômeno: a) químico, pois altera a forma da barra de ferro. 27 b) físico, pois a substância continua sendo ferro. c) físico-químico, pois há a alteração na forma da substância. d) não é exemplo de fenômeno. 25) Aquecendo uma fita de magnésio até a combustão, notamos o desprendimento de fumaça, restando um pó branco. Isso é exemplo de fenômeno: a) físico, pois alterou a estrutura do magnésio. b) químico, pois houve a formação de novas substâncias. c) físico, pois podemos juntar o pó branco e a fumaça, recuperando o magnésio. d) não é exemplo de fenômeno. 26) Alotropia é um fenômeno em que diferentes substância são formadas por um único elemento químico. Por exemplo, o ozônio (O3) é uma forma alotrópica do oxigênio (O2). Com base nesse enunciado e de recentes descobertas que comprovaram que os fulerenos são formas alotrópicas do elemento químico carbono. Assinale a afirmativa que indica as outras formas alotrópicas do carbono. a) isótopos de carbono-13. b) calcáreo e mármore. c) silício e germânico. d) monóxido e dióxido de carbono. e) diamante e grafite. 27) Qual a massa de metano que na combustão se combina totalmente com 12,8 g de oxigênio, produzindo 8,8 g de gás carbônico e 7,2 g de água? 28) Num recipiente fechado estão 3,2 g de gás hidrogênio e 25,6 g de gás oxigênio. Passando uma faísca elétrica pelo sistema, ocorre uma pequena explosão e tudo se transforma em água. Qual a massa de água formada? 29) Num recipiente foram misturados 5 g de hidrogênio com 42 g de oxigênio. Após a reação pudemos observar, ao lado do oxigênio, a formação de 45 g de água. Qual a massa do oxigênio em excesso? 30) Determine a massa de água que se forma no processo: metano + oxigênio → (x + 3) g (6x + 2) g gás carbônico (6x - 8) g + água (3x + 3) g BIBLIOGRAFIA PERUZZO, T. M.; CANTO, E. L., Química - volume único, 1ª ed., Ed. Moderna, 1999. SARDELLA, A., Curso Completo de Química - volume único, 2ª ed., Ed. Ática, 1999. USBERCO, J.; SALVADOR, E., Química – volume único, 5ª ed., Ed. Saraiva, 2002. RUSSELL, J. B., Química Geral, 2ª ed., Vol. 1, Ed. Makron Books, 1994. SANTOS, P. L.W.; MÓL, G. S., et al. Química e Sociedade - volume único., Ed. Nova Geração, 2005. 28
Download