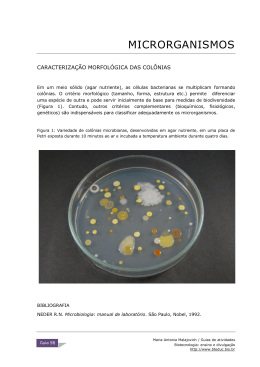
Manual de Monitorização Microbiológica Ambiental Curso de Especialização Tecnológica em Qualidade Ambiental 2012 Manuela Abelho Manuela Abelho Manual de Monitorização Microbiológica Ambiental Curso de Especialização Tecnológica em Qualidade Ambiental Índice Parte 1. Noções básicas de microbiologia prática Conceitos .................................................................................................................................... 6 O que é uma célula?................................................................................................................ 6 Microbiologia e microrganismos............................................................................................ 7 Esterilização e assepsia .......................................................................................................... 7 Meios de cultura ..................................................................................................................... 8 Observação de células microbianas ....................................................................................... 9 Cultura e isolamento de microrganismos ............................................................................ 10 Método das estrias ou de riscado em placa ......................................................................................... 10 Método das diluições decimais sucessivas .......................................................................................... 10 Avaliação quantitativa de populações .................................................................................. 10 Atividade dos microrganismos ............................................................................................................ 10 Massa celular ......................................................................................................................................... 11 Número de células ................................................................................................................................. 11 Unidades formadoras de colónia (UFC) .............................................................................................. 11 Protocolos básicos.....................................................................................................................12 Protocolo 1.1 - Preparação e distribuição de um meio de cultura .........................................12 Material ................................................................................................................................................. 12 Procedimento........................................................................................................................................ 12 Protocolo 1.2 - Elaboração de um esfregaço fresco ...............................................................13 Material necessário .............................................................................................................................. 13 Procedimento........................................................................................................................................ 13 Protocolo 1.3 - Coloração de Gram........................................................................................13 Material ................................................................................................................................................. 13 Procedimento........................................................................................................................................ 13 Protocolo 1.4 - Diluições decimais sucessivas .......................................................................14 Material ................................................................................................................................................. 14 Procedimento........................................................................................................................................ 14 Protocolo 1.5 - Sementeira por incorporação ........................................................................ 15 Material ................................................................................................................................................. 15 Procedimento........................................................................................................................................ 15 Protocolo 1.6 - Sementeira por espalhamento em placa .......................................................16 Material ................................................................................................................................................. 16 Procedimento........................................................................................................................................ 16 Protocolo 1.7 - Isolamento por riscado em placa ..................................................................16 Material ................................................................................................................................................. 16 2 Manuela Abelho Procedimento........................................................................................................................................ 16 Protocolo 1.8 - Contagem de células viáveis (UFC) em placas .............................................. 17 Material ................................................................................................................................................. 17 Procedimento........................................................................................................................................ 17 Parte 2. Qualidade microbiológica do ar e de superfícies Ar ambiente.............................................................................................................................. 18 Legislação sobre qualidade do ar ambiente ......................................................................... 18 Ar interior ................................................................................................................................ 20 Microrganismos no ar interior ............................................................................................. 20 Legislação sobre qualidade do ar interior ............................................................................ 20 Definição dos parâmetros microbiológicos a considerar na avaliação da qualidade do ar interior...................................................................................................................................21 Bactérias................................................................................................................................................ 21 Fungos ................................................................................................................................................... 21 Legionella ............................................................................................................................................. 22 Procedimentos gerais ........................................................................................................... 22 Superfícies ................................................................................................................................ 23 Procedimentos gerais ........................................................................................................... 24 Avaliação da qualidade do ar interior e de superfícies .......................................................... 24 Protocolo 2.1 - Amostragem do ar por sedimentação .......................................................... 24 Material ................................................................................................................................................. 25 Procedimento........................................................................................................................................ 25 Protocolo 2.2 - Amostragem do ar por filtração .................................................................. 25 Material ................................................................................................................................................. 26 Procedimento........................................................................................................................................ 26 Protocolo 2.3 - Amostragem de superfícies pelo método da zaragatoa ............................... 26 Material ................................................................................................................................................. 26 Procedimento........................................................................................................................................ 26 Parte 3. Qualidade microbiológica da água O conceito de qualidade da água ............................................................................................ 28 Os conceitos de poluição e contaminação da água................................................................. 29 Microrganismos e qualidade da água .................................................................................... 30 Os microrganismos como poluentes .................................................................................... 30 Microrganismos como indicadores de poluição....................................................................31 Água destinada ao consumo humano .................................................................................. 33 Legislação aplicável .............................................................................................................................. 33 Métodos analíticos de referência (Decreto-Lei 306/2007) ............................................................... 35 Águas para produção de água para consumo humano, para suporte de vida aquícola e águas de rega ........................................................................................................................ 36 3 Manuela Abelho Legislação aplicável .............................................................................................................................. 36 Águas doces superficiais e subterrâneas destinadas à produção de água para consumo humano .. 37 Águas para suporte de vida aquícola ...................................................................................................38 Águas de rega ........................................................................................................................................38 Métodos analíticos de referência (Decreto-Lei 236/98) ....................................................................38 Águas balneares.................................................................................................................... 39 Legislação aplicável .............................................................................................................................. 39 Ponto de amostragem, recolha e conservação das amostras .............................................................40 Métodos analíticos de referência (Decreto-Lei 135/2009) ................................................................ 41 Avaliação da qualidade das águas ..........................................................................................41 Protocolo 3.1 - Recolha de amostras de água ........................................................................41 Norma: EN 25667-2 | ISO 5667-2:1991 .............................................................................................. 41 Material para uma amostra ................................................................................................................. 41 Recolha de amostras de água de uma torneira ................................................................................... 41 Recolha de amostras de água de um curso de água, de um reservatório ou de uma praia .............. 42 Protocolo 3.2 .......... Enumeração de microrganismos cultiváveis: contagem de colónias por sementeira em meio extrato de levedura agar ..................................................................... 43 Norma: EN ISO 6222 | ISO 6222:1999 ............................................................................................... 43 Material para uma amostra ................................................................................................................. 43 Primeiro tempo: elaboração do meio de cultura ‘agar extracto de levedura’.................................... 43 Segundo tempo: recolha, diluição, sementeira e incubação das amostras ....................................... 43 Terceiro tempo: contagem das colónias .............................................................................................. 44 Protocolo 3.3 - Deteção e enumeração de Escherichia coli e de bactérias coliformes pelo método da filtração por membrana ..................................................................................... 44 Norma: EN ISO 9308-1 | ISO 9308-1:2000 ....................................................................................... 44 Material para uma amostra ................................................................................................................. 45 Primeiro tempo: elaboração dos meios de cultura ‘agar de lactose TTT com heptadecilsulfato de sódio’, ‘caldo de triptofano’ e ‘agar triptonado de soja (TSA) ............................................................ 45 Segundo tempo: recolha, filtração e incubação das amostras ........................................................... 46 Terceiro tempo: exame e repicagem ................................................................................................... 46 Quarto tempo: diferenciação e contagem ........................................................................................... 47 Protocolo 3.4 - Deteção e enumeração de coliformes totais, coliformes fecais e Escherichia coli pelo método do Número Mais Provável (NMP) ............................................................ 47 Material para uma amostra .................................................................................................................48 Primeiro tempo: elaboração dos meios de cultura ‘caldo bílis verde brilhante’ e ‘caldo peptonado’ ...............................................................................................................................................................48 Segundo tempo: recolha das amostras e teste presuntivo ................................................................. 49 Terceiro tempo: verificação da existência de coliformes e teste final ............................................... 50 Quarto tempo: verificação da existência de coliformes fecais e de E. coli ........................................ 50 Protocolo 3.5 ..... Deteção e enumeração de enterococos intestinais pelo método da filtração por membrana ....................................................................................................................... 51 Norma: EN ISO 7899-2 | ISO 7899-2:2000 ....................................................................................... 51 Material para uma amostra ................................................................................................................. 51 Primeiro tempo: elaboração dos meios de cultura ‘Slanetz e Bartley’, ‘solução TTT’ e ‘agar bílisesculina-azida’ ...................................................................................................................................... 52 Segundo tempo: recolha, filtração e incubação das amostras ........................................................... 52 4 Manuela Abelho Terceiro tempo: confirmação e contagem ........................................................................................... 53 Protocolo 3.6 - Detecção e enumeração de estreptococos fecais pelo método do Número Mais Provável (NMP) ........................................................................................................... 53 Material para uma amostra ................................................................................................................. 53 Primeiro tempo: elaboração do meio de cultura ‘caldo bagg’ ............................................................ 53 Segundo tempo: recolha das amostras e incubação ........................................................................... 54 Terceiro tempo: verificação da existência de estreptococos fecais .................................................... 54 Protocolo 3.7 - Deteção e enumeração de Clostridium perfringens (incluindo esporos) pelo método da filtração por membrana ..................................................................................... 54 Material para uma amostra ................................................................................................................. 54 Primeiro tempo: elaboração do meio de cultura ‘agar m-CP’ ............................................................ 54 Segundo tempo: recolha das amostras e incubação ........................................................................... 55 Terceiro tempo: diferenciação ............................................................................................................. 55 Protocolo 3.8 - Deteção e enumeração de Clostridium perfringens (incluindo esporos) pelo método do Número Mais Provável (NMP)........................................................................... 56 Norma: EN 26461-1:1993 | ISO 6461-1:1986 ..................................................................................... 56 Método da inoculação de tubos múltiplos e contagem segundo o NMP ........................................... 56 Material para uma amostra ................................................................................................................. 56 Primeiro tempo: elaboração do meio de cultura ‘agar reinforced clostridial’ e das soluções ‘sulfito de sódio’ e ‘ferro amoniacal’ ................................................................................................................ 57 Segundo tempo: recolha das amostras, inoculação e incubação ....................................................... 57 Terceiro tempo: leitura de resultados ................................................................................................. 58 Bibliografia citada ................................................................................................................... 58 5 Manuela Abelho Parte 1.Noções básicas de microbiologia Conceitos O que é uma célula? A célula é a unidade estrutural, funcional e biológica de todos os seres vivos. É uma unidade autónoma, auto replicável que pode existir como uma unidade funcional independente (como no caso dos organismos unicelulares) ou como uma subunidade de um organismo pluricelular (como nas plantas e nos animais) especializada numa dada função. Existem dois tipos distintos de células (Figura 1): as células procariotas e as células eucariotas. As células procariotas não têm organelos intracelulares individualizados por membrana (incluindo núcleo) e são unicelulares. As células eucariotas têm organelos individualizados por membrana (incluindo núcleo) e podem ser uni ou pluricelulares. Nos dois tipos de célula a informação genética está armazenada nos genes que se agrupam em cromossomas, mas enquanto as células eucariotas têm o material genético no núcleo, as células procariotas têm o material genético disperso pelo citoplasma. Célula procariota Célula eucariota Figura 1. Esquema de uma célula procariota (esquerda) e de uma célula eucariota (direita). [modificado de http://www.phschool.com/science/biology_place/biocoach/images/cells/allcell.jpg]. A unidade de medida micrómetro (m1) demonstra o tamanho microscópico das células e dos microrganismos. 1 1 m=0.001 mm ou seja, são necessários 1000 m para perfazer 1 mm. 6 Manuela Abelho Microbiologia e microrganismos A microbiologia é a ciência que estuda os microrganismos, isto é, todas as formas de vida microscópicas. Os microrganismos incluem seres procariotas (bactérias e árqueas) e seres eucariotas (fungos, leveduras, microalgas e protozoários). Esterilização e assepsia Para a cultura de microrganismos em laboratório deve utilizar-se material e meios de cultura estéreis. Para efetuar a esterilização2 existem vários métodos, que devem ser utilizados de acordo com o tipo de material a esterilizar. Para a esterilização de materiais resistentes a altas temperaturas, como o vidro, utiliza-se o calor seco, recorrendo a estufas que atingem temperaturas de 160-180ºC. Outro tipo de calor seco consiste na incineração ou queima direta pelo fogo e utiliza-se por exemplo para esterilizar ansas no bico de Bunsen, assim como para a eliminação de lixos sólidos dos hospitais (Alcântara et al., 1996). Os materiais como os meios de cultura, ricos em humidade, não podem ser esterilizados pelo calor seco. Para esterilizar meios de cultura e outros líquidos resistentes ao calor utiliza-se o calor húmido recorrendo a um aparelho denominado autoclave. O calor húmido destrói rapidamente os microrganismos por coagulação das suas proteínas. O tempo de morte térmica, i.e., o intervalo de tempo necessário para destruir células vegetativas ou esporos até ao nível pretendido é inversamente proporcional à temperatura. A conjugação dos fatores tempo-temperatura depende das características do produto a esterilizar e da sua estabilidade térmica. Nos autoclaves desenvolve-se uma atmosfera de vapor que permite a subida da temperatura a valores superiores a 100ºC e portanto a rápida esterilização de materiais. O calor húmido evita a evaporação excessiva quando se trata de meios líquidos e soluções, pelo que é o método de mais adequado para a esterilização destes materiais. O tempo de tratamento térmico está relacionado com a temperatura mas também com o volume a esterilizar, i.e., com o tempo de penetração do calor no interior do material. Para a mesma temperatura os tempos de tratamento térmico aumentam com o aumento do volume a esterilizar (Alcântara et al., 1996). 2 Esterilização é a destruição ou remoção de todos os microrganismos, patogénicos ou não, de um dado material. Não confundir com desinfecção, que consiste na remoção ou na inactivação de parte ou de todos os microrganismos patogénicos presentes num dado material (Ferreira et al., 2010). 7 Manuela Abelho Existem outros métodos de esterilização que não utilizam calor e que devem ser utilizados quando o material a esterilizar não resiste ao calor ou é alterado por temperaturas elevadas: filtração, radiações e compostos químicos. A filtração é utilizada principalmente para a esterilização de antibióticos e vitaminas e também para a esterilização do ar. Neste processo, os microrganismos são removidos por passagem do líquido ou do ar através de uma membrana filtrante de poro inferior ao tamanho mais vulgar dos microrganismos mais pequenos, i.e., 0.2 m 3. As radiações, como os raios gama, os raios x e a radiação ultravioleta, são utilizadas para a esterilização de materiais sensíveis ao calor. Os principais compostos químicos (e.g., sabões, sais biliares, fenóis, álcoois, cloro, …) normalmente utilizados na esterilização eliminam as células vegetativas mas não são eficazes sobre as formas esporuladas (formas de resistência) dos microrganismos. Mesmo utilizando materiais estéreis, é necessário manter o local de trabalho isento de contaminações. A assepsia é um conjunto de medidas que permitem manter um ser vivo ou um material inerte isento de contaminações por microrganismos. As condições mínimas de assepsia incluem a limpeza e desinfeção da bancada, uso de bata limpa (por vezes estéril), lavagem e desinfeção das mãos, cabelos presos (por vezes cobertos) e máscara quando necessário. Durante a manipulação de material microbiológico, as condições de assepsia podem ser mantidas utilizando uma bancada com fluxo e/ou uma chama de um bico de Bunsen. Para as condições de assepsia contribuem também a rapidez da execução sob a zona de influência da chama, evitar correntes de ar e contaminações pelo operador (Alcântara et al., 1996). Meios de cultura Para cultivar microrganismos em laboratório é necessário fornecer-lhes as condições mais adequadas para o seu crescimento. Existem diversos tipos de meios de cultura, que contêm diferentes quantidades e tipos de nutrientes e que, sólidos ou líquidos, tornam possível a multiplicação de diferentes tipos de microrganismos em laboratório. 3 O micrómetro (m) é a milionésima parte do milímetro (mm), i.e., 1 mm=1000 m e 1 m=0.001 mm. 8 Manuela Abelho Observação de células microbianas Para a observação de microrganismos pode recorrer-se a preparações a fresco quando há interesse em fazer a observação em condições de vida, por exemplo para observar a mobilidade e tipo de locomoção, para detetar mudanças citológicas durante a divisão celular, para a diferenciação de esporos, etc. Há, porém, objetivos que tornam conveniente a coloração das preparações, como por exemplo: Aumento do contraste entre as células e o meio (o índice de refracção do protoplasma bacteriano é muito semelhante ao do meio circundante, tornando difícil a observação dos microrganismos em preparações não coradas, a não ser que se usem métodos especiais de iluminação como por exemplo a microscopia de contraste de fase); Diferenciação de organismos que reagem de modo diferente ao mesmo corante (colorações diferenciais); Observação de estruturas particulares (e.g., parede celular, material nucleico, esporos, cápsula, etc.). A coloração de Gram é uma coloração diferencial específica para bactérias. Baseia-se no facto de que quando as bactérias são coradas com certos corantes básicos (Figura 2), Gram-negativas podem ser facilmente descoradas com solventes orgânicos (e.g., etanol, acetona), enquanto as Gram-positivas resistem a esta descoloração. A capacidade das células reterem ou perderem o corante reflete diferenças na estrutura fundamental da parede celular, pelo que a resposta à coloração de Gram é uma característica taxonómica importante, usada numa fase inicial da identificação das bactérias. Figura 2. A coloração de Gram. Nas bactérias Gram-negativas, o álcool remove os lípidos da membrana externa da parede celular, aumentando a sua permeabilidade; o complexo violeta de cristal-iodo pode assim ser extraído, descorando as bactérias. Nas bactérias Gram-positivas, o tratamento com álcool resulta na sua desidratação, com redução da permeabilidade da parede e consequente retenção do complexo violeta de cristal-iodo. Fonte: Microbiologia Online (2011). 9 Manuela Abelho Cultura e isolamento de microrganismos Os microrganismos estão presentes na natureza em comunidades mais ou menos complexas. No entanto, o estudo das propriedades e características dos microrganismos tornou necessário o desenvolvimento de técnicas que permitissem a obtenção de organismos separados (ou isolados) dessas comunidades, em culturas puras. A cultura e o isolamento de microrganismos são duas operações básicas em Microbiologia. O crescimento de populações microbianas em meios de cultura no laboratório permite a obtenção de culturas puras – culturas que contêm apenas um tipo de microrganismo – ou de culturas mistas – culturas com mais que um tipo de microrganismo. O isolamento promove a separação de um microrganismo a partir de populações mistas. As culturas puras podem ser obtidas através de vários métodos, nos quais se visa o desenvolvimento de uma população a partir de uma única célula inicial e é importante fazer subculturas a partir de uma colónia isolada, para certificação da pureza das culturas. Método das estrias ou de riscado em placa É um método de isolamento bastante rápido que consiste no espalhamento de uma pequena porção de inóculo, colhida com uma ansa, através de um riscado na superfície de um meio de cultura sólido. A execução do riscado pode ser feita por vários processos. Método das diluições decimais sucessivas Consiste na realização de diluições decimais sucessivas da amostra e posterior sementeira de quantidades conhecidas em caixas de Petri. A sementeira (operação que consiste em distribuir uniformemente o inóculo em meio de cultura apropriado) pode ser feita à superfície (pelo método do espalhamento em placa), em camada dupla e por incorporação. Após a obtenção de uma cultura pura, a sua manutenção em laboratório deve garantir que os microrganismos permaneçam viáveis, geneticamente homogéneos e protegidos de posteriores contaminações. As culturas podem ser mantidas por refrigeração (4ºC), congelação (-20ºC, -70ºC ou em azoto líquido: -180ºC) ou liofilizadas. Para conservação a longo prazo deverá usar-se substâncias crio protetoras (e.g., glicerol). Avaliação quantitativa de populações A avaliação quantitativa do crescimento microbiano pode ser feita de diversas formas, dependendo das características do material e da informação pretendida. Atividade dos microrganismos A avaliação quantitativa de populações pode ser efetuada através da medição da atividade microbiana, como por exemplo, a atividade de redução de corantes (medida 10 Manuela Abelho pelo grau de redução em determinado tempo ou pelo tempo necessário à redução), a libertação de CO2 (pelo volume ou pela massa perdida), o consumo de O2 (por exemplo, através da “Carência Bioquímica de Oxigénio”, CBO). Massa celular A avaliação da massa celular é também uma forma de avaliação quantitativa de populações. Para isso é necessário, nas condições de observação, conhecer a função que relaciona a massa celular com o número de microrganismos presentes. Número de células A avaliação quantitativa de populações através da contagem do número de células pode ser efetuada por vários métodos, de contagem direta ou total (ex. câmaras de contagem e método de Breed) e de contagem indireta ou de células viáveis (exemplo, contagem em placas e método do Número Mais Provável - NMP). Unidades formadoras de colónia (UFC) O crescimento dos microrganismos em meio sólido dá origem à formação de colónias (crescimento macroscopicamente visível resultante da multiplicação celular). Se as células microbianas estiverem completamente dispersas, cada colónia corresponde a uma bactéria inicial em estado viável e cultivável. Se os microrganismos estiverem agregados ou aderentes a pequenas partículas não há correspondência entre o número de colónias obtido e o número inicial de microrganismos. Desta forma, relativamente à origem de uma colónia, ou ao teor de microrganismos determinado por contagem de colónias, fala-se em Unidades Formadoras de Colónias (UFC). O número de células viáveis (células com capacidade para se multiplicar) presentes numa população microbiana pode ser estimado usando técnicas de contagem em placas. Neste método um volume conhecido de uma suspensão de microrganismos, convenientemente diluída, é espalhado na superfície de um meio de cultura solidificado (sementeira por espalhamento em placa) ou incorporado nesse meio (sementeira por incorporação). As colónias que se desenvolvem, após incubação adequada, são contadas. Assume-se que cada colónia é originada a partir de uma única célula, o que nem sempre é verdade, pelo que os resultados são normalmente expressos em termos de unidades formadoras de colónias (UFC). Para que os resultados sejam significativos as placas contáveis deverão ter entre 30 a 300 colónias. O número total de microrganismos obtém-se multiplicando o número de colónias pelo fator de diluição. 11 Manuela Abelho Protocolos básicos Protocolo 1.1 - Preparação e distribuição de um meio de cultura Material Preparados comerciais de meios de cultura; água destilada; provetas; balões Erlenmeyer com tampas de algodão e papel craft/papel de alumínio ou frascos de vidro com tampa resistentes ao calor; balança; caixas para pesar; colher ou espátula; magnetes; placa magnética de aquecimento; autoclave; caixas de Petri estéreis; tubos de ensaio com tampa. Procedimento 1. Seguindo as instruções da embalagem, pesar a quantidade de pó necessária para preparar o volume indicado pelo docente; 2. Medir o volume necessário de água destilada numa proveta e transferir para um Erlenmeyer (ou para um frasco próprio com tampa de enroscar) o pó pesado e a água destilada; 3. Colocar um magnete dentro do Erlenmeyer/frasco e agitar numa placa de aquecimento até obter uma solução límpida; 4. Ajustar o pH de acordo com as instruções da embalagem, adicionando gota a gota as soluções ácida ou alcalina; 5. Tapar o Erlenmeyer com a rolha de algodão e papel de alumínio (ou enroscar parcialmente a tampa do frasco); 6. Se for um meio de cultura líquido, em vez de executar o ponto 5, distribuir por tubos de ensaio (10 mL/tubo) e colocar a tampa; 7. Colocar o Erlenmeyer/frasco ou os tubos de ensaio com o meio de cultura a esterilizar no autoclave (121ºC durante 15- 20 minutos); 8. Esperar que a temperatura e a pressão dentro do autoclave diminuam, retirar o Erlenmeyer/frasco ou os tubos de ensaio da autoclave; 9. Se for um meio de cultura líquido, deixar arrefecer e utilizar ou guardar a 4ºC até à sua utilização; 10. Se for um meio sólido, deixar arrefecer até atingir uma temperatura que permita o seu manuseamento, mas superior a 42ºC (a esta temperatura o agar solidifica); 11. Desembrulhar as caixas de Petri esterilizadas e identificar com o nome do meio de cultura e a data da sua elaboração; 12. Verter o meio de cultura nas caixas de Petri em condições de assepsia, fazendo uma camada de aproximadamente 5 mm; 13. Deixar solidificar e utilizar ou inverter e guardar a 4ºC até à sua utilização. 12 Manuela Abelho Protocolo 1.2 - Elaboração de um esfregaço fresco Material necessário Bico de Bunsen, ansa; lâminas de vidro, lamelas; microscópio. Procedimento 1. Retirar com a pinça uma lâmina de vidro do recipiente e inflamar à chama; 2. Colocar uma gota de água destilada esterilizada na lâmina; 3. Esterilizar uma ansa à chama e deixar arrefecer; 4. Tocar na colónia com a ansa e suspender o material na gota de água; 5. Espalhar o líquido numa área de aproximadamente 1 cm2, esfregando bem de forma a separar a massa de células; 6. Colocar uma lamela, pressionar ligeiramente e observar ao microscópio Protocolo 1.3 - Coloração de Gram Material Bico de Bunsen, ansa; lâminas de vidro, lamelas; pinças, corante cristal de violeta; corante safranina; soluto de lugol; álcool iodado; água corrente; microscópio. Procedimento 1. Depositar a amostra sobre uma lâmina de vidro, fazer um esfregaço e fixar pelo calor da seguinte forma: 2. Retirar com a pinça uma lâmina de vidro do recipiente e inflamar à chama; 3. Colocar uma gota de água destilada esterilizada na lâmina; 4. Esterilizar uma ansa à chama e deixar arrefecer; 5. Tocar na colónia com a ansa e suspender o material na gota de água; 6. Espalhar o líquido numa área de aproximadamente 1 cm2, esfregando bem de forma a separar a massa de células; 7. Segurar a lâmina com uma pinça e passar rapidamente sobre a chama até toda a água evaporar para fixar o material; 8. Realizar uma coloração de Gram das diferentes colónias (Figura 2), da seguinte forma: 9. Inundar o esfregaço fixado com cristal de violeta (corante primário) agitando suavemente durante 60 segundos; 10. Lavar com água corrente, começando na extremidade da lâmina e deixando escorrer por cima do material fixado; 11. Inundar o esfregaço com solução de Lugol, deixando atuar durante 60 segundos (vai formar um complexo com o cristal de violeta); 13 Manuela Abelho 12. Lavar com água corrente e secar com papel de filtro, pressionando suavemente o papel contra a preparação; 13. Inundar o esfregaço com álcool iodado (agente descolorante), agitando suavemente durante 60 segundos; 14. Inundar com corante vermelho safranina durante 30 segundos, lavar e secar com papel de filtro; 15. Observar ao microscópio, verificando se as células são Gram-positivas ou Gramnegativas e registando a sua forma e a sua dimensão. Protocolo 1.4 - Diluições decimais sucessivas Material Bico de Bunsen, 1 suspensão de microrganismos; pipetas estéreis de 1 mL; tubos de ensaio com 9 mL de soluto de Ringer estéril; vórtex; caixas de Petri estéreis e meio se cultura liquefeito (para sementeira por incorporação, ver Protocolo 1.5) ou caixas de Petri com meio de cultura sólido e espalhador (para sementeira por espalhamento, ver Protocolo 1.6). Procedimento 1. Identificar os tubos de ensaio, com as referências 10-1, 10-2, 10-3, 10-4, …; 2. Com uma pipeta esterilizada retirar em assepsia 1 ml da amostra da população fornecida; 3. Introduzir a alíquota de 1 ml no primeiro tubo de diluição (tubo com soro fisiológico); 4. Homogeneizar a suspensão por agitação (vórtex), segurando a rolha para que não salte; 5. Com outra pipeta esterilizada retirar 1 ml da diluição do primeiro tubo (diluição 10-1) e introduzir num segundo tubo de diluição, para obtenção da diluição 10-2; 6. Proceder de igual modo até à última diluição, seguindo o esquema da Figura 3; 7. Semear imediatamente, de acordo com os métodos indicados nos pontos seguintes, seguindo a ordem decrescente das diluições e utilizando uma só pipeta para todas as sementeiras da mesma amostra. 14 Manuela Abelho Figura 3. O método das diluições decimais sucessivas. Fonte: Madigan et al. (2006). Protocolo 1.5 - Sementeira por incorporação Material Meio de cultura sólido mantido a 45ºC; caixas de Petri estéreis; suspensão de microrganismos; pipetas estéreis de 1 mL; bico de Bunsen. Procedimento 1. Manter um meio de cultura (sólido) liquefeito num banho a 45ºC (o agar começa a solidificar a 42ºC); 2. Identificar 5 caixas de Petri esterilizadas com a data, turma e nº de aluno e diluição respetiva e marcar uma caixa de Petri extra com a letra C (controlo); 3. Seguindo a ordem decrescente das diluições, retirar 1 ml de cada uma das diluições com uma pipeta esterilizada, depois de a ter enchido e esvaziado pelo menos 6 vezes na suspensão de microrganismos; 15 Manuela Abelho 4. Entreabrindo apenas o suficiente a tampa da caixa de Petri, colocar o conteúdo da pipeta no fundo da caixa; 5. Tirar a rolha do tubo de meio sólido liquefeito, passar a boca do tubo pela chama e verter, de uma só vez, o seu conteúdo na caixa de Petri; 6. Incorporar o inóculo no meio de cultura: mantendo a caixa assente sobre o tampo na bancada, agite-a (descrever cinco círculos no sentido dos ponteiros do relógio, cinco outros em sentido contrário e movimentos retilíneos segundo duas direções cruzadas, cinco vezes cada também) evitando que o agar toque a tampa da placa e deixe repousar até solidificar; 7. Na caixa controlo não se deposita inóculo: verter o conteúdo de um tubo de meio da mesma maneira que anteriormente; 8. Após solidificação do meio, identificar as caixas com a data de inoculação, diluição e microrganismo inoculados, inverter e incubar a 25ºC durante dois dias. Protocolo 1.6 - Sementeira por espalhamento em placa Material Caixas de Petri estéreis com meio de cultura sólido; espalhador; copo de vidro; álcool etílico a 96%; suspensão de microrganismos; pipetas estéreis de 1 mL; bico de Bunsen. Procedimento 1. Identificar convenientemente o material a inocular; 2. A partir de cada uma das diluições pipetar 0.1 ml para a superfície do meio de cultura solidificado; 3. Com um espalhador de vidro estéril espalhar o inóculo por toda a superfície da caixa semeada, rodando-a simultaneamente; 4. Identificar as caixas, colocar em posição invertida e incubar a 25ºC durante dois dias. Protocolo 1.7 - Isolamento por riscado em placa Material Caixas de Petri estéreis com meio de cultura sólido; ansa; bico de Bunsen. Procedimento 1. Com uma ansa esterilizada e arrefecida tocar numa colónia isolada; 2. Riscar com a ansa a superfície do agar, de acordo com um esquema que vise esgotar completamente o material contido na ansa (Figura 4); 3. Identificar e colocar a caixa de Petri em posição invertida a incubar a 25ºC durante uma semana. 16 Manuela Abelho Figura 4. Exemplo de um riscado em placa, mostrando as quatro direções do riscado. O objetivo do riscado é o esgotamento do inóculo e a obtenção de colónias isoladas, derivadas de uma única célula inicial. Para maior eficácia no processo de esgotamento do inóculo, pode esterilizar-se a ansa entre os riscados 1, 2, 3 e 4, esperando que arrefeça em assepsia antes de iniciar o riscado seguinte. Fonte: Microbiology Virtual Lab (2011). Protocolo 1.8 - Contagem de células viáveis (UFC) em placas Material Caixas de Petri inoculadas pelo método do espalhamento ou da incorporação. Procedimento 1. Observar as caixas de Petri inoculadas, selecionar apenas as que permitam contar entre 30 a 300 colónias e contar as colónias nas placas selecionadas; 2. Calcular o número médio das diversas repetições; 3. Calcular o número de células viáveis presentes na suspensão original (UFC/ml), i.e., a abundância de microrganismos cultiváveis. 17 Manuela Abelho Parte 2.Qualidade microbiológica do ar e de superfícies Ar ambiente A qualidade do ar é o termo que se usa, normalmente, para traduzir o grau de poluição no ar que respiramos. A poluição do ar é provocada por uma mistura de substâncias químicas, lançadas no ar ou resultantes de reações químicas, que alteram o que seria a constituição natural da atmosfera. Estas substâncias poluentes podem ter maior ou menor impacte na qualidade do ar, consoante a sua composição química, concentração na massa de ar em causa e condições meteorológicas. Assim, por exemplo, a existência de ventos fortes ou chuvas poderão dispersar os poluentes, ao passo que a presença de luz solar poderá acentuar os seus efeitos negativos (APA, 2011). Na legislação não está contemplado o uso de parâmetros microbiológicos na avaliação da qualidade do ar ambiente; apenas na avaliação da qualidade do ar interior. Legislação sobre qualidade do ar ambiente Lei 11/87, de 7 de Abril | Lei de Bases do Ambiente http://dre.pt/pdf1sdip/1987/04/08100/13861397.pdf Define a orientação de partida da proteção do ar que, como componente ambiental natural, tem necessariamente que conhecer um nível de proteção coerente e compatível com as demais componentes ambientais naturais e humanas, previstas neste diploma basilar da definição da política ambiental em Portugal. Decreto-Lei 276/99, de 23 de Julho | http://dre.pt/pdf1sdip/1999/07/170A00/45994604.pdf Define as linhas de orientação da política de gestão da qualidade do ar e transpõe para a ordem jurídica interna a Directiva 96/62/CE, do Conselho, de 27 de Setembro, relativa à avaliação e gestão da qualidade do ar ambiente. 18 Manuela Abelho Decreto-Lei 279/2007 | http://dre.pt/pdf1sdip/2007/08/15000/0504005042.pdf Primeira alteração ao Decreto-Lei 276/99, de 23 de Julho, que define as linhas de orientação da política de gestão da qualidade do ar e transpõe para a ordem jurídica interna a Directiva 96/62/CE, do Conselho, de 27 de Setembro, relativa à avaliação e gestão da qualidade do ar ambiente. Decreto-Lei 111/2002, de 16 de Abril | http://dre.pt/pdf1sdip/2002/04/089A00/37113722.pdf Estabelece os valores limite das concentrações no ar ambiente do dióxido de enxofre, dióxido de azoto e óxidos de azoto, partículas de suspensão, chumbo, benzeno e monóxido de carbono, bem como as regras de gestão da qualidade do ar aplicáveis a esses poluentes, em execução do disposto nos artigos 4º e 5º do Decreto-Lei 276/99 de 23 de Julho, transpondo para a ordem interna as Directivas Comunitárias 1999/30/CE, do Conselho, de 22 de Abril, e 2000/69/CE, do Parlamento Europeu e do Conselho, de 16 de Novembro. Decreto-Lei 320/2003, de 20 de Dezembro | http://dre.pt/pdf1sdip/2003/12/293A00/85128521.pdf Estabelece objetivos a longo prazo, valores alvo, um limiar de alerta e um limiar de informação ao público para as concentrações do ozono no ar ambiente, bem como as regras de gestão da qualidade do ar aplicáveis a esse poluente, em execução do disposto nos artigos 4º e 5º do Decreto-Lei 276/99 de 23 de Julho, transpondo para a ordem jurídica nacional a Directiva 2002/3/CE, do Parlamento Europeu e do Conselho, de 12 de Fevereiro, relativa ao ozono no ar ambiente. Decreto-Lei 351/2007, de 23 de Outubro | http://dre.pt/pdf1sdip/2007/10/20400/0770607712.pdf Transpõe para a ordem jurídica interna a Directiva 2004/107/CE, do Parlamento Europeu e do Conselho, de 15 de Dezembro, estabelecendo valores alvo para as concentrações de arsénio, cádmio, mercúrio, níquel e hidrocarbonetos aromáticos policíclicos no ar ambiente. 19 Manuela Abelho Ar interior A qualidade do ar no interior dos edifícios é um dos fatores básicos no conforto dos utilizadores e também influencia a sua saúde, bem como o rendimento e duração do equipamento e maquinaria existentes na área de tratamento do ar. A qualidade do ar interior deve, assim, ser avaliada periódica e sistematicamente, com o objetivo de garantir níveis mínimos de qualidade (SGS, 2011). Microrganismos no ar interior Além das partículas poluentes não biológicas, o ar contém bio aerossóis, que correspondem a material biológico transmitido pelo ar. Os contaminantes biológicos incluem microrganismos (bactérias, fungos, vírus), ácaros, pólen, traças, pelo e fezes de animais. As bactérias (e.g., Staphylococcus spp. e Micrococcus spp.) e fungos (e.g., Penicillium spp., Aspergillus spp. e Cladosporium spp.) são os mais frequentemente associados com biocontaminantes e com queixas quanto à qualidade de ar de interiores. Entre as principais fontes de contaminação fúngica estão os sistemas de ventilação mecânica, em função do seu funcionamento deficiente e de misturar ar filtrado externo com ar reciclado (Filho et al., 2000). A quantidade e o tipo de microrganismos existentes dentro de um espaço fechado estão diretamente relacionados com a existência de suspensões orgânicas e minerais no ar, a temperatura e a humidade relativa, as condições de manutenção dos sistemas de climatização existentes, a higiene das instalações, o número e o nível de higiene dos seus ocupantes. Legislação sobre qualidade do ar interior Em 2006 foi instituído o Sistema Nacional de Certificação Energética e da Qualidade do Ar Interior nos Edifícios – SCE, composto por um extenso pacote legislativo (Decretos-Lei 78, 79 e 80 de 4 de Abril de 2006), que prevê a obrigatoriedade de auditorias à qualidade do ar interior. Essas auditorias incluem a avaliação microbiológica da qualidade do ar. Decreto-Lei 79/2006, de 4 de Abril | http://www.dre.pt/pdf1sdip/2006/04/067A00/24162468.PDF Aprova o Regulamento dos Sistemas Energéticos de Climatização em Edifícios, publicado em anexo. Transpõe parcialmente para a ordem jurídica nacional a Directiva 2002/91/CE, do Parlamento Europeu e do Conselho de 16 de Dezembro, relativa ao desempenho energético dos edifícios. Define os parâmetros microbiológicos a avaliar e os valores máximos admissíveis para cada parâmetro (Tabela 1). 20 Manuela Abelho Tabela 1. Parâmetros microbiológicos e valores máximos admissíveis a considerar na determinação da qualidade do ar interior (Decreto-Lei 79/2006). Bactérias Fungos Legionella4 NºUFC/m3 500 500 100 Definição dos parâmetros microbiológicos a considerar na avaliação da qualidade do ar interior Bactérias Grupo muito grande de microrganismos (organismos microscópicos) composto por seres procariotas (i.e., sem núcleo individualizado e sem organelos intracelulares) unicelulares. Podem ter a forma de esferas (i.e., cocos) ou de bastonetes (i.e., bacilos), ou outras formas menos frequentes. O grupo é muito diversificado em termos de metabolismo, mas a quantificação do total de bactérias transportadas pelo ar dirigese apenas às bactérias heterotróficas, isto é, aquelas cuja fonte de carbono, de energia e de eletrões é a matéria orgânica. Fungos Grupo muito grande de organismos heterotróficos que inclui as leveduras, os bolores, os cogumelos, etc. As suas células são eucariotas (i.e., têm núcleo individualizado e organelos intracelulares). Os bolores são fungos pluricelulares filamentosos (Figura 5) e as leveduras são fungos unicelulares. Nos fungos pluricelulares, as células formam longos filamentos chamados hifas (Figura 5, direita) que crescem formando um emaranhado chamado micélio (Figura 5, esquerda). 4 Em edifícios com sistemas de climatização em que haja produção de aerossóis (e.g., torres de arrefecimento ou humidificadores por água líquida), ou com sistemas de água quente para chuveiros onde a temperatura de armazenamento seja inferior a 60ºC. Pesquisa em amostras de água recolhidas nos locais de maior risco (e.g., tanques das torres de arrefecimento, depósitos de água quente e tabuleiros de condensação). 21 Manuela Abelho Figura 5. Exemplos de fungos filamentosos ou bolores. Esquerda: micélio do fungo filamentoso Fusarium oxysporum observado a olho nu (Fonte: Scientia, 2011). Direita: hifas do fungo Aspergillus níger – o vulgar bolor do pão - observadas ao microscópio (Fonte: Instituto Ciência Hoje, 2010). Legionella É uma bactéria Gram-negativa, móvel, com forma de bastonete (Figura 6). Pode causar pneumonia (doença dos legionários) ou uma doença semelhante à gripe (doença de Pontiac). Ao contrário de outras bactérias, pode sobreviver com baixos níveis de oxigénio dissolvido e é parcialmente resistente à desinfeção com cloro. Existem pelo menos 48 espécies de Legionella, das quais 18 podem causar doenças. Pensa-se que a maioria das infeções é devida à espécie Legionella pneumophila. Figura 6. Fotografia de Legionella pneumophila, mostrando a forma de bastonete e o flagelo que lhe permite mobilidade. Fonte: MicrobLog (2006). Procedimentos gerais Para a amostragem dos microrganismos do ar pode utilizar-se a monitorização passiva e a monitorização ou amostragem ativa. A monitorização passiva é levada a cabo por sedimentação do ar em caixas de Petri standarde com meio de cultura generalista, abertas e expostas ao ar durante um período de tempo conhecido. Este método pode ser limitante porque não permite, pelo menos diretamente, a 22 Manuela Abelho contabilização do número de unidades formadoras de colónia por unidade de volume de ar. Para além disso, as caixas de Petri podem ser contaminadas por microrganismos provenientes de outras fontes de contaminação que não o ar. Por outro lado, é um método fácil de usar e com baixos custos. A monitorização ativa necessita de um amostrador de ar, que filtra volumes conhecidos através de um filtro que depois é incubado num meio apropriado. Embora ambos os métodos sejam válidos e possam ser utilizados, na legislação portuguesa está indicado o método da filtração para a quantificação das bactérias e dos fungos do ar. Para a distinção de fungos e leveduras pode recorrer-se a diferentes meios de cultura, à observação macroscópica das colónias e à observação microscópica das suas células. A determinação de Legionella é efetuada nas águas. Superfícies A amostragem e a análise dos microrganismos presentes em superfícies permitem determinar se os métodos de limpeza e desinfeção utilizados são eficazes. Este tipo de análise está normalmente relacionado com a produção de alimentos e o controlo microbiológico é um dos passos exigidos no sistema HACCP (Hazard Analysis and Critical Control Point, que se traduz por Análise de Perigos e Controlo de Pontos Críticos), um sistema de controlo da segurança alimentar. Na legislação não estão previstos valores-limite, mas no controlo da segurança alimentar utilizam-se os valores indicados na Tabela 2 para bactérias aeróbias5 mesófilas6 totais (Downes & Ito, 2001). 5 Classificação quanto às necessidades de oxigénio. Os microrganismos podem ser aeróbios ou anaeróbios. Dentro dos aeróbios existem os aeróbios obrigatórios ou estritos (só conseguem sobreviver na presença de oxigénio na concentração atmosférica – cerca de 20%) e os microaerófilos (necessitam de oxigénio mas não toleram a concentração atmosférica; necessitam de 2-10%). Dentro dos anaeróbios existem os anaeróbios obrigatórios ou estritos (morrem na presença de oxigénio), os anaeróbios facultativos (não necessitam de oxigénio para sobreviver mas crescem melhor na sua presença) e os aerotolerantes (crescem igualmente bem na presença ou na ausência de oxigénio; não usam oxigénio, ignoram-no). 6 Classificação quanto às necessidades de temperatura. Os microrganismos mesofilos vivem numa gama de temperaturas amenas (a nossa temperatura ambiente); a temperatura máxima que toleram é menor que 50ºC, a temperatura mínima deve ser maior que 15ºC e 23 Manuela Abelho Tabela 2. Valores limite para bactérias aeróbias mesófilas totais em superfícies na indústria alimentar (Downes & Ito, 2001). NºUFC/cm2 Satisfatório Aceitável Não satisfatório <1 2-10 >10 Procedimentos gerais Para a determinação de bactérias aeróbias mesófilas totais utiliza-se o método da zaragatoa (objeto semelhante a um cotonete gigante) seguido por inoculação por incorporação. Avaliação da qualidade do ar interior e de superfícies Protocolo 2.1 - Amostragem do ar por sedimentação Os microrganismos presentes no ar sedimentam a taxas variadas dependendo do tipo/tamanho das partículas em suspensão e do movimento do ar da sala. A amostragem por sedimentação não determina diretamente o número de microrganismos presentes num dado volume de ar, mas é possível transformar os resultados deste método (nº de UFC/unidade de área) em nº de UFC/unidade de volume. Para isso, é necessário conhecer a área da caixa de Petri exposta ao ar e a razão entre o número de células na superfície e número de células no ar (SAR). A SAR para ambientes com sedimentação espontânea, i.e., sem aparelhos que forcem o ar, é 23:1 (Morais et al., 2010). O número de UFC em cada metro cúbico de ar calcula-se de acordo com a a temperatura óptima é 35ºC. Os microrganismos psicrófilos (que vivem a baixas temperaturas) têm temperatura máxima menor que 20ºC, a temperatura mínima pode ser menor que 0ºC e a temperatura óptima é 5-10ºC. Os microrganismos termófilos vivem a temperaturas elevadas; temperatura mínima de 45ºC, temperatura máxima pode ultrapassar 80ºC e a temperatura óptima é 55-65ºC. 24 Manuela Abelho ⁄ Equação 1 Equação 1. Cálculo do número de UFC/m3 de ar pelo método da amostragem por sedimentação. (Friberg et al., 1999a; Friberg et al., 1999b): ⁄ Equação 1. Cálculo do número de UFC/m3 de ar pelo método da amostragem por sedimentação. Para calcular a área (A) de uma caixa de Petri, mede-se o seu diâmetro (cm), divide-se por 2 para obter o raio (r) e aplica-se a Equação 2. Para transformar o resultado obtido (cm2) em m2, divide-se por 10 000 (1 m2 tem 10 000 cm2). Existem caixas de Petri de vários tamanhos. As mais comuns têm diâmetro de 8 cm, pelo que a sua área é aproximadamente 50 cm2 ou seja, 0.0050 m2. Equação 2. Cálculo da área de um círculo. Material Caixas de Petri com meio de cultura PDA (Potato Dextrose Agar); caixas de Petri com meio de cultura PCA (Plate Count Agar). Procedimento 1. Identificar as caixas com o nome do meio de cultura e a data de elaboração; 2. Deitar o meio nas caixas de Petri, deixar arrefecer e solidificar; 3. Abrir as caixas ao ar no local desejado, tendo o cuidado de utilizar pelo menos duas repetições para cada um dos tipos de microrganismo; 4. Deixar em exposição durante 30 minutos; 5. Fechar as caixas, inverter, identificar e colocar na estufa (30ºC para as bactérias e 25ºC para os fungos); 6. Deixar incubar durante 24-48 horas e contabilizar o número de UFC em cada caixa; 7. Calcular o número de UFC de fungos e de bactérias por m3 do ar da sala ( Equação 1) ⁄ Equação 1. Cálculo do número de UFC/m3 de ar pelo método da amostragem por sedimentação. ; 8. Comparar o resultado obtido com a legislação e concluir. 25 Manuela Abelho Protocolo 2.2 - Amostragem do ar por filtração A forma correta de aplicação deste método consiste na utilização de um amostrador que permite determinar com exatidão o volume de ar filtrado. O método aqui descrito pretende ultrapassar a limitação imposta pela não existência de um amostrador, utilizando um aparelho de filtração normalmente existente nos laboratórios não especializados. Material Caixas de Petri com meio de cultura PDA (Potato Dextrose Agar); caixas de Petri com meio de cultura PCA (Plate Count Agar); filtros estéreis de 0.45 m; aparelho de filtração; bico de Bunsen; pinças. Procedimento 1. Ligar a bomba de vácuo ao aparelho de filtração, colocar uma membrana e cronometrar o tempo que o aparelho demora a filtrar um volume conhecido de água. Utilizar este resultado para fazer uma estimativa do ar filtrado pelo aparelho durante um dado período de tempo; 2. Com uma pinça estéril, colocar uma membrana estéril no aparelho de filtração, ligar a bomba de vácuo e cronometrar o tempo necessário para filtrar o volume de ar pretendido; 3. Desligar a bomba de vácuo e, em condições de assepsia, retirar o filtro com uma pinça estéril, colocar sobre o meio de cultura; 4. Em condições de assepsia e utilizando a pinça estéril, colocar o filtro sobre o meio de cultura na caixa de Petri; 5. Fazer pelo menos duas repetições para cada um dos tipos de microrganismo; 6. Fechar as caixas, inverter, identificar e colocar na estufa (30ºC para as bactérias e 25ºC para os fungos); 7. Deixar incubar durante 24-48 horas e contabilizar o número de UFC em cada caixa; 8. Calcular o número de UFC de fungos e de bactérias por m3 do ar da sala; 9. Comparar o resultado obtido com a legislação e concluir. Protocolo 2.3 - Amostragem de superfícies pelo método da zaragatoa Material Caixas de Petri estéreis; meio de cultura PCA mantido a 45ºC; zaragatoas estéreis; tubos de ensaio com 10 mL de soluto de Ringer estéril; pipetas estéreis de 1 mL; bico de Bunsen. Procedimento 1. Humedecer uma zaragatoa estéril com água destilada; 26 Manuela Abelho 2. Percorrer com a zaragatoa uma área de tamanho conhecido, no mínimo 100 cm2 (por exemplo um quadrado de 10 cm × 10 cm); 3. Em condições de assepsia, imergir a zaragatoa num tubo com 10 mL de soluto de Ringer, espremendo várias vexes contra a parede interior do tubo; 4. Homogeneizar o conteúdo do tubo de ensaio e, em condições de assepsia, retirar 1 mL para uma caixa de Petri estéril; 5. Deitar na caixa de Petri cerca de 15 mL de meio de cultura e homogeneizar (ver ConceitosProtocolo 1.5 - Sementeira por incorporação, página 15); 6. Esperar que solidifique, identificar a caixa de Petri, inverter e incubar a 30ºC durante 24-48 h; 7. Contar o número de UFC; 8. Comparar o resultado obtido com a legislação e concluir. 27 Manuela Abelho Parte 3.Qualidade microbiológica da água A água é um recurso essencial à vida, indispensável para a humanidade mas também para os outros organismos e para a manutenção das funções e da integridade dos ecossistemas (Mendes, 2010). A água é um elemento fundamental para o desenvolvimento sustentável dos países, pelo que a falta de água ou a falta de água com qualidade diminuem a qualidade de vida das populações. Devido ao aumento da população humana as necessidades de água têm vindo a aumentar; no entanto, as atividades humanas direta ou indiretamente podem diminuir a qualidade da água, tornando-a imprópria para determinados fins, ou seja, podem diminuir a quantidade de água com qualidade para ser utilizada nalgumas atividades. Na União Europeia, a legislação regula a gestão das águas superficiais, designadamente as águas interiores, de transição e costeiras, e das águas subterrâneas, de forma a: a) evitar a continuação da degradação e proteger e melhorar o estado dos ecossistemas aquáticos e também dos ecossistemas terrestres e zonas húmidas diretamente dependentes dos ecossistemas aquáticos, no que respeita às suas necessidades de água; b) promover uma utilização sustentável de água, baseada numa proteção a longo prazo dos recursos hídricos disponíveis; c) obter uma protecção reforçada e um melhoramento do ambiente aquático, nomeadamente através de medidas específicas para a redução gradual e a cessação ou eliminação por fases das descargas, das emissões e perdas de substâncias prioritárias; d) assegurar a redução gradual da poluição das águas subterrâneas e evitar o agravamento da sua poluição; e) mitigar os efeitos das inundações e das secas; f) assegurar o fornecimento em quantidade suficiente de água de origem superficial e subterrânea de boa qualidade, conforme necessário para uma utilização sustentável, equilibrada e equitativa da água; g) proteger as águas marinhas, incluindo as territoriais; h) assegurar o cumprimento dos objetivos dos acordos internacionais pertinentes, incluindo os que se destinam à prevenção e eliminação da poluição no ambiente marinho (Lei nº58/2005). O conceito de qualidade da água O conceito de qualidade da água é relativo, já que depende do uso a que se destina ou do objetivo do seu utilizador. Assim, a qualidade da água pode ser definida, para fins específicos, como o conjunto de características físicas, químicas e biológicas 28 Manuela Abelho adequadas à sua utilização para determinado uso. Para cada uso da água é pois necessário estabelecer as exigências relativas à sua qualidade, isto é, definir parâmetros de qualidade e estabelecer os seus valores-limite (Mendes, 2010). O Decreto-Lei 236/98, de 1 de Agosto define quatro tipos principais de utilização da água: águas para consumo humano, águas para suporte de vida aquícola, águas balneares e águas de rega. As águas para consumo humano são águas doces que podem ter origem em águas superficiais, em águas subterrâneas ou em águas de abastecimento. As águas para suporte de vida aquícola são águas superficiais, doces ou salobras, continentais ou litorais, destinadas à produção de peixe (águas piscícolas) ou de bivalves (águas conquícolas). As águas balneares são águas doces lóticas e lênticas, comummente designadas de correntes e paradas, assim como a água do mar e as águas estuarinas, que se encontrem classificadas como águas balneares ou, não estando classificadas, onde o banho não esteja interdito e seja habitualmente praticado por um número considerável de banhistas (aproximadamente 100/dia, durante a época balnear). A água de rega é água superficial ou subterrânea ou água residual, que vise satisfazer ou complementar as necessidades hídricas das culturas agrícolas ou florestais (artigo 3º do Decreto-Lei 236/98). Os limites paramétricos estabelecidos na legislação são principalmente desenvolvidos para a prevenção da ocorrência de surtos sanitários, fornecendo uma informação limitada sobre a proteção do ambiente e da saúde. Os limites paramétricos podem definir-se como (i) a concentração de uma substância ou organismo que não representa um perigo significativo para a saúde de um número significativo de utilizadores; (ii) as condições nas quais a exposição a essa substância ou organismo não são prováveis, ou (iii) uma combinação de ambos (Mendes, 2010). Assim, são normalmente impostos na legislação dois limites paramétricos, o valor máximo recomendável (VMR) e o valor máximo admissível (VMA). O VMR é o valor de norma de qualidade que não deverá ser ultrapassado (Decreto-Lei 236/98) e garante a manutenção da saúde do consumidor e a cobertura das suas necessidades alimentares. O VMA é o valor da norma de qualidade que, de preferência, deve ser respeitado ou não excedido (Decreto-Lei 236/98); ou seja, como nem sempre os valores obtidos são ≤ VMR, toma-se em conta o VMA, na perspetiva de que nesse intervalo de valores (VMR-VMA) não se verificarão riscos significativos para a saúde dos consumidores. Os conceitos de poluição e contaminação da água A poluição da água pode ser definida como: (i) a inadequação da sua aplicabilidade para algum objetivo considerado, (ii) qualquer modificação natural ou artificial que direta ou indiretamente modifique, altere ou destrua o equilíbrio dos ecossistemas e 29 Manuela Abelho dos recursos naturais de tal modo que traga perigo para a saúde pública, diminua a sua adequabilidade ou eficiência e o bem-estar do Homem e das suas comunidades, ou (iii) a alteração da composição ou do estado da água de tal forma que se torne menos adequada para todas ou algumas das funções e fins a que pode ser adequada no seu estado natural. O conceito de contaminação é definido como a introdução ou descarga na água de organismos patogénicos ou de substâncias tóxicas que a tornem imprópria para consumo público e/ou usos domésticos, ou seja, a contaminação pode ser considerada um aspecto específico da poluição. Microrganismos e qualidade da água Os microrganismos como poluentes Os poluentes podem ser inorgânicos, organismos e biológicos, incluindo-se os microrganismos neste último grupo. Os perigos mais significativos da poluição biológica por microrganismos devem-se à contaminação das águas por resíduos fecais ou urinários, provenientes do metabolismo dos animais homeotérmicos7. Embora muitos microrganismos associados a este tipo de resíduos sejam inofensivos para pessoas saudáveis, alguns são agentes patogénicos8. Quando existe contaminação da água por fezes, as bactérias de origem fecal (associadas às fezes) são uma causa potencial de várias doenças que podem ocorrer sob a forma epidémica – doença que afeta simultaneamente muitos indivíduos, por contágio – ou sob a forma endémica – doença que se verifica permanentemente numa dada região. Para além das bactérias fecais, outros microrganismos presentes na água – vírus, helmintas, protozoários, … – podem representar perigos para as 7 Animais homeotérmicos (também chamados animais de sangue quente) são aqueles que mantêm a sua temperatura corporal constante, independentemente da temperatura ambiente (e.g., mamíferos e aves). Pelo contrário, os animais poiquilotérmicos (também designados por animais de sangue frio) não conseguem manter a temperatura corporal constante e aquecem ou arrefecem com as alterações da temperatura ambiente (e.g., répteis e anfíbios). 8 Agentes patogénicos são organismos capazes de causar doenças infecciosas nos seus hospedeiros. 30 Manuela Abelho populações humanas, mas não fazem em geral parte da análise sistemática incluída nas normas legais da maioria dos países não tropicais. Microrganismos como indicadores de poluição O número de microrganismos presentes nos materiais fecais é muito elevado, cerca de 109 (i.e., 10 000 000 000) de cada um dos grupos pesquisados por cada grama de material fecal, dos quais apenas alguns são patogénicos (Mendes, 2010). Ou seja, juntamente com os microrganismos patogénicos são libertados microrganismos não patogénicos ou de patogenia limitada, pelo que a presença ou ausência desses microrganismos numa amostra indica se a água em questão foi ou não contaminada por fezes, isto é, se apresenta o perigo de conter microrganismos fecais patogénicos. Os microrganismos não patogénicos ou de patogenia limitada são indicadores de contaminação fecal e são utilizados para monitorizar as águas para a contaminação por fezes (Mendes, 2010). A escolha dos indicadores de qualidade microbiológica da água obedece a vários critérios (Mendes, 2010): 1. A concentração do microrganismo indicador na água contaminada deve ter uma relação direta com o grau de contaminação; 2. O microrganismo indicador deve ser suficientemente conhecido, de forma a permitir a atribuição de valores-limite; 3. A análise do microrganismo indicador deve ter uma metodologia padronizada e específica para o microrganismo em causa (i.e., a presença de outros microrganismos não deve gerar resultados positivos) e suficientemente sensível para detetar níveis baixos do indicador; 4. A análise do microrganismo indicador deve ser rápida, inequívoca e de baixo custo; 5. O microrganismo indicador deve estar presente sempre que microrganismos fecais patogénicos estejam também presentes, e em quantidade superior aos patogénicos; 6. O microrganismo indicador deve ser mais resistente aos agentes desinfetantes que os microrganismos patogénicos (i.e., deve sobreviver mais tempo); 7. O microrganismo indicador não deve reproduzir-se na água (para não causar sobre estimativas da poluição) 8. O microrganismo indicador deve distribuir-se de forma aleatória na massa de água; 9. O microrganismo indicador deve ser propício para a análise de todos os tipos de água: torneira, rios, subterrânea, barragens, estuários, oceanos, águas residuais… (i.e., deve ser capaz de sobreviver nos vários tipos de água); 10. O microrganismo indicador deve ser inofensivo para o ser humano. 31 Manuela Abelho Os indicadores clássicos de contaminação fecal são (i) o grupo dos coliformes fecais e não fecais, (ii) o grupo dos enterococos fecais, (iii) Clostridium perfringens; e (iv) o número de UFC a 22ºC e a 37ºC. O grupo dos coliformes é constituído por bactérias da família Enterobacteriaceae, habitantes do aparelho intestinal do homem e de outros animais homeotérmicos. São bactérias Gram-negativas, em forma de bacilo e anaeróbias facultativas. Algumas são oxidase-positivas e crescem em condições aeróbias em meio de cultura seletivo contendo sais biliares; outras são capazes de fermentar lactose a 37ºC com libertação de gás e de ácido e outras são capazes de fazer a fermentação a 44.5ºC. A fermentação da lactose a 44.5ºC permite distinguir os coliformes não fecais (37ºC) dos coliformes fecais (44.5ºC). Nos coliformes fecais inclui-se, por exemplo, a bactéria Escherichia coli (Mendes, 2010). Os enterococos fecais são caracterizados pela capacidade de crescerem entre 10 e 45ºC, a pH 9.6, em meio de cultura contendo 6.5% de cloreto de sódio (NaCl), na presença de 40% de sais biliares e em concentrações de azida inibidoras do crescimento dos coliformes. São bactérias Gram-positivas que reduzem azul-demetileno em 0.1% de leite e conseguem sobreviver a 60ºC durante 30 minutos. Nos enterococos fecais inclui-se, por exemplo, Enterococcus faecalis (Mendes, 2010). Clostridium perfringens é uma bactéria anaeróbia, esporulada, redutora de sulfito, Gram-positiva, em forma de bacilo, habitante do intestino do homem e de outros animais homeotérmicos. Esta bactéria tem interesse como indicador de poluição fecal antiga, devido ao seu longo tempo de permanência na água e à grande capacidade de sobrevivência dos seus esporos (Mendes, 2010). O número de UFC a 22ºC e a 37ºC não é um indicador específico de poluição fecal mas sim de enriquecimento por matéria orgânica facilmente degradável. As contagens de colónias são úteis para a avaliação do estado da água e dos processos de tratamento utilizados, por exemplo, nas estações de tratamento de águas residuais (ETAR). O principal interesse da contagem de colónias reside na possibilidade de detetar as alterações em relação ao histórico, baseando-se num controlo frequente e a longo prazo. A ocorrência de um aumento repentino do número de UFC pode significar que existe um foco de poluição. Devido ao aprofundamento dos estudos microbiológicos, atualmente utilizamse, em substituição ou em adição aos indicadores clássicos, outros microrganismos, chamados novos indicadores. A bactéria Escherichia coli substituiu, na legislação atual, os coliformes fecais como indicadores de contaminação fecal. Esta bactéria apresenta uma grande diversidade de adaptações ao meio, podendo causar várias doenças que originam diarreias (Mendes, 2010). 32 Manuela Abelho A bactéria Pseudomonas aeruginosa é outro dos chamados novos indicadores. Não é um habitante específico do intestino mas aparece em 12% da população. É uma bactéria oportunista, aeróbia, Gram-negativa, patogénica e com elevada resistência a antibióticos (Mendes, 2010). Existem outros microrganismos presentes na água que podem representar perigo para as populações humanas, como os vermes helmintas, alguns protozoários (e.g., Giardia, Cryptosporidium, Entamoeba, Acanthamoeba,…) e vírus, mas a legislação atual não prevê a sua análise de rotina (Mendes, 2010). Água destinada ao consumo humano Legislação aplicável Decreto-Lei 306/2007, de 27 de Agosto | http://dre.pt/pdf1sdip/2007/08/16400/0574705765.pdf Estabelece o regime da qualidade da água destinada ao consumo humano, procedendo à revisão do Decreto-Lei 243/2001, de 5 de Setembro, que transpôs para o ordenamento jurídico interno a Directiva 98/83/CE, do Conselho, de 3 de Novembro, tendo por objetivo proteger a saúde humana dos efeitos nocivos resultantes da eventual contaminação dessa água e assegurar a disponibilização tendencialmente universal de água salubre, limpa e desejavelmente equilibrada na sua composição. Define como água destinada ao consumo humano: (i) Toda a água no seu estado original, ou após tratamento, destinada a ser bebida, a cozinhar, à preparação de alimentos, à higiene pessoal ou a outros fins domésticos, independentemente da sua origem e de ser fornecida a partir de uma rede de distribuição, de um camião ou naviocisterna, em garrafas ou outros recipientes, com ou sem fins comerciais; (ii) Toda a água utilizada numa empresa da indústria alimentar para fabrico, transformação, conservação ou comercialização de produtos ou substâncias destinados ao consumo humano, assim como a utilizada na limpeza de superfícies, objetos e materiais que podem estar em contacto com os alimentos, exceto quando a utilização dessa água não afeta a salubridade do género alimentício na sua forma acabada. Define os métodos de controlo da qualidade da água, estabelecendo a localização dos pontos de amostragem, as frequências mínimas de amostragem (variáveis consoante o volume de água fornecida; Anexo II do Decreto-Lei 306/2007), estabelecendo um controlo de rotina e um controlo de inspeção da qualidade da água. 33 Manuela Abelho Localização dos pontos de amostragem A localização dos pontos de amostragem depende da proveniência da água (artigo 10º, número 2): No caso da água fornecida a partir de uma rede de distribuição, no ponto em que, no interior de uma instalação ou estabelecimento, sai das torneiras normalmente utilizadas para consumo humano; No caso da água fornecida a partir de fontanários não ligados à rede de distribuição, no ponto de utilização; No caso da água fornecida por entidades gestoras em alta, nos pontos de amostragem dos pontos de entrega aos respetivos utilizadores; No caso da água fornecida a partir de camiões, navios--cisterna e reservatórios não ligados à rede de distribuição, no ponto de utilização; No caso da água destinada à venda em garrafas e outros recipientes, com ou sem fins comerciais, no fim da linha de enchimento; No caso da água utilizada numa empresa da indústria alimentar, no ponto de utilização. Qualidade microbiológica: valores paramétricos Os valores paramétricos e os parâmetros microbiológicos que a água destinada ao consumo humano deve respeitar são divididos em duas partes, uma relativa à água fornecida por redes de distribuição, fontanários, camiões ou navios-cisterna, reservatórios e utilizada na indústria alimentar (Tabela 3) e outra relativa à água colocada à venda em garrafas ou noutros recipientes (Tabela 4). Tabela 3. Parâmetros microbiológicos e valores paramétricos para a água fornecida por redes de distribuição, fontanários, camiões ou navios-cisterna, reservatórios e água utilizada na indústria alimentar (Decreto-Lei 306/2007, anexo I, parte I). Parâmetro Escherichia coli (E. coli) Enterococos Valor paramétrico 0 0 Unidade Número/100 mL Número/100 mL Tabela 4. Parâmetros microbiológicos e valores paramétricos para a água colocada à venda em garrafas ou outros recipientes (Decreto-Lei 306/2007, anexo I, parte I). Parâmetro Escherichia coli (E. coli) Enterococos Pseudomonas aeruginosa Nº UFC a 22ºC Nº UFC a 37ºC Valor paramétrico 0 0 0 100 20 Unidade Número/250 mL Número/250 mL Número/250 mL Número/mL Número/mL 34 Manuela Abelho Controlo da qualidade Os parâmetros microbiológicos a analisar nos controlos de rotina são os constantes da Tabela 5. No controlo de inspecção devem ser analisados os parâmetros constantes da Tabela 3 ou Tabela 4, consoante a proveniência da água. Tabela 5. Parâmetros microbiológicos a analisar nos controlos de rotina (Decreto-Lei 306/2007, anexo II). Controlo de rotina 1 Bactérias coliformes Escherichia coli (E. coli) Controlo de rotina 2 Clostridium perfringens, incluindo esporos Número de colónias a 22°C Número de colónias a 37°C Pseudomonas aeruginosa Métodos analíticos de referência (Decreto-Lei 306/2007) Bactérias coliformes e Escherichia coli (E. coli): norma ISO 9308-1 Filtração por membrana, em duplicado, seguida de incubação em meio TTC Chapman agar durante 213 horas a 362ºC (coliformes) e 444ºC (E. coli). As colónias que crescem a 36ºC são consideradas coliformes fecais e as colónias que crescem a 44ºC são consideradas E. coli. Após a incubação, as colónias de várias espécies diferentes apresentam diferentes características: E. coli e Citrobacter spp. apresentam colónias amarelas com centro laranja; Enterobacter spp. forma colónias vermelhas ou amarelo-escuro com o centro laranja e o meio de cultura amarelo; Klebsiella spp. forma colónias vermelhas ou amarelas, sem coloração diferenciada no centro e o meio de cultura amarelo; As bactérias que não fermentam lactose formam colónias púrpuras e alteram a cor do meio de cultura para azul. Enterococos: norma ISO 7899-2 Filtração por membrana, em duplicado, seguida de incubação em meio de bílis azida agar durante 213 horas a 352ºC. As colónias de enterococos aparecem rodeadas de uma cor castanha. Transferência dos filtros com as colónias, sem inverter, para uma caixa de Petri com meio agar de bílis azida pré-aquecido a 44ºC e incubação a 440.5ºC durante 2 horas para confirmação imediata. As colónias que apresentem meio com coloração castanha-negra em seu redor são confirmadas como enterococos. Pseudomonas aeruginosa: norma EN ISO 12780 Filtração por membrana, em duplicado, seguida de incubação em meio CN agar durante 24-48 horas. Contagem de todas as colónias que apresentem cor azulesverdeada como sendo Pseudomonas aeruginosa. Exame das membranas sob radiação ultravioleta e contagem de todas as colónias que não sejam azul-esverdeadas 35 Manuela Abelho mas que emitam fluorescência como possíveis P. aeruginosa. Contagem de todas as colónias avermelhadas que não emitam fluorescência como possíveis P. aeruginosa. Para confirmação, repicagem das colónias que necessitam de confirmação para meio agar nutritivo durante 222 horas a 362ºC. Teste da oxidase a todas as colónias que eram inicialmente avermelhadas. Repicagem das colónias com reação oxidasepositiva para meio B King agar durante 213 horas (mas o período de incubação pode prolongar-se por um máximo de 5 dias) a 362ºC. O crescimento das colónias é observado diariamente sob radiação ultravioleta (UV). A presença de colónias de Pseudomonas aeruginosa revela-se, sob a radiação UV, pela emissão de fluorescência. Enumeração de microrganismos viáveis — número de UFC a 22°C e a 37ºC: norma EN ISO 6222 Diluições decimais seguidas de inoculação por incorporação, de caixas de Petri, em quadruplicado, com meio de extrato de levedura agar. Incubação de duas caixas a 2022ºC durante 3 dias e das outras duas a 37ºC durante 44 horas. Contagem de UFC. Clostridium perfringens (incluindo esporos) Filtração em membrana, em duplicado, seguida de incubação anaeróbia da membrana em m-CP agar a 44°C ± 1°C durante 21 ± 3 horas. Contagem das colónias amarelas opacas que passam a rosa ou vermelho após exposição, durante vinte a trinta segundos, a vapores de hidróxido de amónio. Águas para produção de água para consumo humano, para suporte de vida aquícola e águas de rega Legislação aplicável Decreto-Lei 236/98, de 1 de Agosto | http://dre.pt/pdf1sdip/1998/08/176A00/36763722.pdf Estabelece normas, critérios e objetivos de qualidade com a finalidade de proteger o meio aquático e melhorar a qualidade das águas em função dos seus principais usos: utilização da água para consumo humano, para suporte de vida aquícola, para efeitos balneares (que passou a ser regulamentada pelo Decreto-Lei 135/2009, de 3 de Junho) e para rega. No que respeita à utilização da água para consumo humano, consideram-se três tipos: (i) águas doces superficiais destinadas à produção de água para consumo humano; (ii) águas subterrâneas destinadas à produção de água para consumo 36 Manuela Abelho humano e (iii) águas de abastecimento para consumo humano (que passaram a ser regulamentadas pelo Decreto-Lei 306/2007). Águas doces superficiais e subterrâneas destinadas à produção de água para consumo humano As águas superficiais destinadas à produção de água para consumo humano são classificadas nas categorias A1, A2 e A3, de acordo com as normas de qualidade fixadas no anexo I do Decreto-Lei 236/98 (Tabela 6), a que correspondem esquemas de tratamento tipo distintos, definidos no anexo II do mesmo Decreto-Lei, para as tornar aptas para consumo humano: classe A1 - tratamento físico e desinfeção, classe A2 - tratamento físico e químico e desinfeção, classe A3 - tratamento físico, químico de afinação e desinfeção. Tabela 6. Parâmetros microbiológicos e valores máximos recomendáveis para as águas doces superficiais destinadas à produção de água para consumo humano (Decreto-Lei 236/98, anexo I). Parâmetro9 Coliformes totais Coliformes fecais Estreptococos fecais Salmonelas Unidade Número/100 mL Número/100 mL Número/100 mL Valor máximo recomendável A1* A2 50 5000 20 2000 20 1000 0 / 5000 mL 0 / 1000 mL A3 50000 20000 10000 - * Categoria também aplicável à qualidade das águas subterrâneas utilizáveis para produção de água para consumo humano. Consideram-se aptas para poderem ser utilizadas como origem de água para a produção de água para consumo humano as águas subterrâneas que apresentem qualidade superior ou igual à da categoria A1 (Tabela 6) das águas doces superficiais destinadas à produção de água para consumo humano, correspondendo-lhes o esquema de tratamento indicado no anexo II do Decreto-Lei 236/98 para aquela categoria de águas, com as devidas adaptações. 9 Na legislação mais recente relativa à qualidade microbiológica de outros tipos de águas, os estreptococos fecais foram substituídos pelos enterococos – um subgrupo mais resistente às condições do meio, nomeadamente a salinidade, os coliformes fecais foram substituídos por Escherichia coli e os coliformes totais deixaram de ser considerados indicadores específicos de poluição fecal e apenas são considerados indicadores de poluição. No entanto, a avaliação da qualidade microbiológica deste tipo de águas continua a ser ainda regulada pelo Decreto-Lei 236/98. 37 Manuela Abelho Águas para suporte de vida aquícola Do conjunto de águas para suporte de vida aquícola (águas doces superficiais lóticas e lênticas - piscícolas; águas do litoral e salobras - conquícolas e piscícolas), apenas estão definidas normas de qualidade microbiológica para as águas do litoral e salobras com fins conquícolas (Tabela 7), controlo a exercer de no mínimo de três em três meses, não na água mas no corpo do molusco. As normas de qualidade das águas do litoral e salobras para fins aquícolas — águas conquícolas têm por finalidade proteger e melhorar a qualidade dessas águas a fim de permitir a vida e o crescimento de moluscos (bivalves e gastrópodes), equinodermes, tunicados e crustáceos, contribuindo para a boa qualidade dos produtos conquícolas passíveis de consumo pelo homem. Tabela 7. Parâmetros microbiológicos e valores máximos recomendáveis para o corpo dos moluscos e para o líquido intervalar (Decreto-Lei 236/98, anexo II). Parâmetro Coliformes fecais Unidade Número/100 mL VMR 300 Águas de rega Os critérios e normas de qualidade das águas de rega visam proteger a saúde pública, a qualidade das águas superficiais e subterrâneas, as culturas que podem ser afetadas pela má qualidade das águas de rega e os solos cuja aptidão para a agricultura pode ser degradada pelo uso sistemático de águas de rega de má qualidade. Nas águas de rega, os parâmetros microbiológicos a considerar são os indicados na Tabela 8. Tabela 8. Parâmetros microbiológicos e valores máximos recomendáveis para a água de rega (Decreto-Lei 236/98, anexo XVI). Parâmetro Coliformes fecais Ovos de parasitas intestinais Unidade Número/100 mL Número/L VMR 100 - VMA 1 Métodos analíticos de referência (Decreto-Lei 236/98) Coliformes totais, coliformes fecais e estreptococos fecais Podem usar-se dois métodos analíticos: filtração por membrana ou inoculação de tubos múltiplos. A temperatura de incubação é 37ºC 1ºC para os coliformes totais e para os estreptococos fecais e 44.5ºC 0.5ºC para os coliformes fecais. Na filtração por membrana, a inoculação é feita em meio sólido específico adequado para o efeito e contagem das colónias (UFC). As amostras devem ser diluídas ou, quando apropriado, concentradas a fim de que o número de colónias fique compreendido entre 10 e 100. 38 Manuela Abelho Na inoculação de tubos múltiplos, para os coliformes totais e fecais utiliza-se o método de diluição com fermentação em substratos líquidos em pelo menos três tubos em 3 diluições, com subcultura dos tubos positivos em meios de confirmação e contagem em número mais provável (NMP). Para os estreptococos fecais, utiliza-se o método de diluição em caldo de azoteto de sódio em pelo menos três tubos para cada uma das três diluições e contagem em NMP. Salmonelas O método geral consiste na concentração por filtração (através de membrana ou filtro apropriado) seguida de sementeira em meio de pré-enriquecimento, enriquecimento, subcultura em meio de isolamento e identificação. Ovos de parasitas intestinais Observação e contagem ao microscópio. Águas balneares Legislação aplicável Decreto-Lei 135/2009, de 3 de Junho | http://dre.pt/pdf1sdip/2009/06/10700/0346003468.pdf Estabelece o regime jurídico de identificação, gestão, monitorização e classificação da qualidade das águas balneares e de prestação de informação ao público sobre as mesmas, transpondo para a ordem jurídica interna a Directiva n.º 2006/7/CE, do Parlamento Europeu e do Conselho, de 15 de Fevereiro, relativa à gestão da qualidade das águas balneares, e complementando a Lei da Água, aprovada pela Lei 58/2005, de 29 de Dezembro. Define como águas balneares as águas superficiais, quer sejam interiores, costeiras ou de transição, tal como definidas na Lei da Água, aprovada pela Lei n.º 58/2005, de 29 de Dezembro, em que se preveja que um grande número de pessoas se banhe e onde a prática balnear não tenha sido interdita ou desaconselhada de modo permanente. A monitorização das águas balneares deve ser efetuada no prazo máximo de quatro dias a contar da data indicada no calendário de amostragem, o qual é estabelecido pelo INAG para cada época balnear, antes do seu início. O ponto de amostragem é estabelecido no local onde: (i) se preveja maior afluência de banhistas; ou (ii) de acordo com o perfil das águas balneares, onde exista maior risco de poluição, entendida como a presença de contaminação microbiológica ou outros organismos ou resíduos que afetem a qualidade das águas balneares e constituam um 39 Manuela Abelho risco para a saúde dos banhistas. A monitorização deve ser efetuada com a frequência especificada no anexo II do Decreto-Lei 135/2009, sendo os resultados dessa monitorização utilizados na constituição dos conjuntos de dados sobre a qualidade das águas balneares. Os parâmetros microbiológicos a avaliar na avaliação da qualidade das águas balneares são os mesmos para as águas interiores (Tabela 9.) e para as águas costeiras e de transição (Tabela 10), mas os valores diferem entre os dois tipos de água. Tabela 9. Valores paramétricos microbiológicos a observar na avaliação da qualidade das águas balneares interiores (Decreto-Lei 135/2009, anexo I). Parâmetro Enterococos intestinais Escherichia coli Unidade Número/100 mL Número/100 mL Qualidade Excelente Boa Aceitável 200 330 400 500 900 1000 NOTA: No Decreto-Lei 135/2009, os valores da coluna “Qualidade Boa” e “Qualidade aceitável” estão trocados Tabela 10. Valores paramétricos microbiológicos a observar na avaliação da qualidade das águas balneares costeiras e de transição (Decreto-Lei 135/2009, anexo I). Parâmetro Enterococos intestinais Escherichia coli Unidade Número/100 mL Número/100 mL Qualidade Excelente Boa Aceitável 100 185 200 250 500 500 NOTA: No Decreto-Lei 135/2009, os valores da coluna “Qualidade Boa” e “Qualidade aceitável” estão trocados Ponto de amostragem, recolha e conservação das amostras As amostras deverão ser recolhidas 30 cm abaixo da superfície das águas e onde a sua profundidade seja no mínimo de 1 m. Os frascos a utilizar devem ser de material transparente e incolor (vidro, polietileno ou polipropileno), com capacidade mínima de 250 mL e devem encontrar-se estéreis. As amostras devem ser claramente identificadas com tinta indelével na amostra e no formulário relativo à amostra. As amostras de água devem, em todas as fases do transporte, ser protegidas da exposição à luz, em especial à luz directa do sol e conservadas a uma temperatura de cerca de 4ºC até à sua análise. Se for provável que o transporte para o laboratório demore mais de quatro horas, é obrigatório o transporte em frigorífico. O período de tempo decorrido entre a recolha da amostra e a realização da análise deve ser o mais curto possível, sempre que possível no mesmo dia e no prazo máximo de vinte e quatro horas. 40 Manuela Abelho Métodos analíticos de referência (Decreto-Lei 135/2009) Enterococos intestinais: normas ISO 7899-1 ou ISO 7899-2 Consultar a secção relativa à análise das águas destinadas ao consumo humano, para as quais é referido o mesmo método. Escherichia coli: normas ISO 9308-3 ou ISO 9308-1 Consultar a secção relativa à análise das águas destinadas ao consumo humano, para as quais é referido o mesmo método. Avaliação da qualidade das águas Protocolo 3.1 - Recolha de amostras de água Norma: EN 25667-2 | ISO 5667-2:1991 As mãos e a roupa dos intervenientes na colheita devem estar limpas. Os recipientes para colheita das amostras de água devem ser de material transparente e incolor (vidro, polietileno ou polipropileno) e estar esterilizados mediante: esterilização em autoclave (mínimo de quinze minutos a 121ºC), esterilização a seco (mínimo uma hora a 160ºC - 170ºC) ou ser constituídos por recipientes irradiados recebidos diretamente do fabricante. As amostras devem ser claramente identificadas com tinta indelével no recipiente e no formulário relativo à amostra. A amostra de água deve ser colhida obedecendo aos cuidados de assepsia, deve ser representativa das características microbiológicas do material a analisar e deve ter volume suficiente para permitir, se necessário, a repetição dos testes. O recipiente para a colheita da amostra deve permanecer fechado até ao momento da colheita; nessa altura enche-se sem enxaguar com a água a analisar e fecha-se imediatamente, tendo cuidado para não contaminar durante estas operações as superfícies interiores da rolha ou tampa. O frasco não deve ficar completamente cheio, pois algum espaço vazio no seu interior facilitará a agitação e mistura da amostra antes de se efectuarem as análises. Após a colheita, as amostras de água devem, em todas as fases do transporte, ser protegidas da exposição à luz, em especial à luz direta do sol e devem ser mantidas a uma temperatura de cerca de 4ºC até ao seu processamento. Material para uma amostra Frasco estéril com tampa, com capacidade suficiente para recolher a água necessária à análise de todos os parâmetros a analisar. Recolha de amostras de água de uma torneira 1. Lavar e desinfetar as mãos (ou usar luvas estéreis); 41 Manuela Abelho 2. Retirar qualquer filtro e deixar correr o tempo necessário (1-2 minutos) para esgotar a água que tenha estado parada na canalização; 3. Fechar a torneira e desinfetar o interior e o exterior com álcool; 4. Abrir a torneira com cuidado e deixar a água correr um pouco; 5. Abrir o frasco esterilizado só neste momento e colher a água mantendo-o inclinado para evitar a sua contaminação pelo ar. Manter a rolha na mão esquerda virada para baixo e nunca tocar no interior da rolha ou no gargalo do frasco; 6. Recolher a amostra de água mantendo o frasco inclinado para evitar a sua contaminação pelo ar e sem encher completamente o frasco; 7. Fechar imediatamente o frasco; 8. Identificar a amostra; 9. Transportar as amostras em caixa isotérmica com placas acumuladoras térmicas congeladas (4ºC) e realizar a análise nas 4 horas seguintes à colheita. Recolha de amostras de água de um curso de água, de um reservatório ou de uma praia 1. Lavar e desinfetar as mãos (ou usar luvas estéreis); 2. Segurar o frasco numa zona perto da sua base e mergulhá-lo na massa de água com a boca virada para baixo. Deve mergulhar-se até cerca de metade da altura da coluna líquida ou pelo menos até cerca de 20 cm abaixo da superfície da água; 3. Virar o frasco até que o gargalo aponte ligeiramente para a superfície e a boca esteja voltada contra a corrente. Se não existir qualquer corrente (por exemplo, no caso de um reservatório) empurrar o frasco horizontalmente; 4. Recolher a amostra e fechar imediatamente o frasco; 5. Seguir os passos 8-9 indicados para a água recolhida de uma torneira. 42 Manuela Abelho Protocolo 3.2 Enumeração de microrganismos cultiváveis: contagem de colónias por sementeira em meio extrato de levedura agar Norma: EN ISO 6222 | ISO 6222:1999 Consiste na enumeração de microrganismos cultiváveis10, por contagem de UFC em meio extrato de levedura agar após incubação aeróbia a 22 e a 36ºC, em águas destinadas ao consumo humano. Faz-se a inoculação de um volume conhecido de amostra ou suas diluições, por homogeneização com um meio de cultura específico em caixas de Petri, com incubação de um conjunto a 36ºC durante 44 horas e de outro conjunto a 22ºC durante 68 horas. No final contam-se as colónias das caixas contáveis e faz-se o cálculo do número de UFC por mililitro da amostra. Material para uma amostra Meio ‘agar extrato de levedura’ • material indicado no Protocolo 1.1 (página 12) e no Protocolo 3.1 (página 41) • 4 caixas de Petri estéreis • pipetas estéreis de 1 mL • estufa a 22ºC • estufa a 37ºC. Primeiro tempo: elaboração do meio de cultura ‘agar extracto de levedura’ Composição do meio ‘agar extracto de levedura’: Triptona 6.0 g/L • Extracto de levedura 3.0 g/L • Agar 15.0 g/L • Água destilada • pH 7.20.2 a 25ºC 1. Adicionar todos os ingredientes e ajustar o pH ou seguir as instruções do preparado em pó (Protocolo 1.1, página 12); 2. Esterilizar em autoclave em tubos de 15-20 mL (volume para uma caixa de Petri); 3. Conservar no frigorífico até à utilização. Segundo tempo: recolha, diluição, sementeira e incubação das amostras 1. Recolher, manipular e preservar as amostras de acordo com o Protocolo 3.1 (página 41); 2. Fundir o meio de cultura no autoclave ou no micro-ondas, deixar arrefecer e manter a 451ºC num banho de água; 10 Todas as bactérias aeróbias, leveduras e bolores capazes de formar colónias no meio especificado e nas condições de ensaio. 43 Manuela Abelho 3. Se necessário (isto é, se o tipo de água fizer prever um grande conteúdo microbiano que provoque a coalescência das colónias), fazer diluições decimais sucessivas da amostra (Protocolo 1.4, página 14); 4. Incorporar um inóculo de 1 mL (da amostra ou das suas diluições) em 15-20 mL do meio de cultura fundido (Protocolo 1.5, página 15); 5. Inocular no mínimo duas caixas de Petri por cada temperatura de incubação; 6. Deixar solidificar, inverter e incubar um conjunto a 372ºC durante 444 h e o outro conjunto a 222ºC durante 684 h. Terceiro tempo: contagem das colónias 1. Observar as caixas assim que terminar o tempo de incubação ou armazená-las a 53ºC e fazer a observação num período de 48h; 2. Contar as colónias observadas em cada caixa (com um número contável de colónias) e calcular o número de UFC presentes num mililitro da amostra para cada temperatura de incubação (Protocolo 1.8, página 17); 3. Se não existirem colónias nas caixas inoculadas com a amostra não diluída, exprimir os resultados como não detetados num mL; 4. Se existirem mais de 300 colónias nas caixas inoculadas com a diluição maia alta utilizada, exprimir os resultados como> 300. 5. O relatório deve incluir a referência à norma de referência, todos os detalhes necessários para a completa identificação da amostra, a técnica e o meio de cultura utilizados, o tempo e a temperatura de incubação, os resultados do ensaio e qualquer ocorrência observado no decurso da análise e a classificação da qualidade da água em função da sua utilização e de acordo com a legislação. Protocolo 3.3 - Deteção e enumeração de Escherichia coli e de bactérias coliformes pelo método da filtração por membrana Norma: EN ISO 9308-1 | ISO 9308-1:2000 Consiste na deteção e na enumeração de Escherichia coli, que normalmente habita o intestino do homem e de outros animais homeotérmicos, indicando a contaminação fecal da água, e de outros coliformes. A presença de coliformes, embora não prove de forma conclusiva a contaminação fecal da água – visto que algumas destas bactérias não de origem intestinal, vivendo no solo e em águas superficiais – pode indicar falhas no tratamento e na distribuição da água destinada ao consumo humano. O método está dividido em duas partes, um ensaio standard de referência (que permite enumerar separadamente E. coli e outras bactérias coliformes) e um ensaio rápido opcional (que permite enumerar E. coli), que podem ser efetuados em paralelo. Neste protocolo apenas abordaremos o ensaio standard de referência. 44 Manuela Abelho Material para uma amostra Material indicado no Protocolo 1.1 (página 12) e no Protocolo 3.1 (página 41) • aparelho de filtração e bomba de vácuo • 2 filtros de 45 m • meio ‘agar de lactose TTT com heptadecilsulfato de sódio’ (2 caixas de Petri) • meio ‘caldo de triptofano’ (10 tubos de ensaio) • meio ‘agar triptonado de soja’ (10 caixas de Petri) • ansa • solução de tetrametil-p-fenilendiamina • papel de filtro • reagente de Kovacs • estufa a 37ºC • estufa a 44ºC. Primeiro tempo: elaboração dos meios de cultura ‘agar de lactose TTT com heptadecilsulfato de sódio’, ‘caldo de triptofano’ e ‘agar triptonado de soja (TSA) Composição do meio de base ‘agar de lactose ‘: Lactose: 20 g/L • Peptona: 10 g/L • Extracto de levedura: 6 g/L • Extracto de carne: 5 g/L •, Azul de bromotimol: 0.05 g/L • Agar: 15-25 g/L • Água destilada • pH 7.20.2 a 25ºC 1. Adicionar todos os ingredientes e ajustar o pH a pH 7.20.2 a 25ºC ou seguir as instruções do preparado em pó (Protocolo 1.1, página 12); Composição da ‘solução TTT’: cloreto de 2,3,5-trifeniltetrazolio (TTT) 0.05 g/100 mL • Água destilada 2. Dissolver 0.05 g de cloreto de 2,3,5-trifeniltetrazolio (TTT) num pequeno volume de água, perfazer até 100 mL, esterilizar por filtração (0.2 m); Composição da ‘solução heptadecilsulfato de sódio’: heptadecilsulfato de sódio (Tergitol 7) 0.2 g/100 mL • Água destilada 3. Dissolver 0.2 g de heptadecilsulfato de sódio (Tergitol 7) num pequeno volume de água, perfazer até 100 mL, esterilizar em autoclave; ─•─ 4. Fundir o meio de base e esperar que arrefeça até 50ºC; 5. Adicionar a 100 mL de meio de base, 5 mL da solução TTT e 5 mL da solução de heptadecilsulfato de sódio; 6. Misturar completamente evitando que se formem bolhas; 7. Repartir por caixas de Petri (camada de cerca de 5 mm, cerca de 15 mL/caixa); 8. Guardar no frio e no escuro e utilizar no prazo máximo de 10 dias. Composição do ‘caldo de triptofano’: Digestato tríptico de caseína 10 g/L • L-triptofano 1 g/L • Cloreto de sódio 5 g/L • Água destilada • pH 7.50.1 a 25ºC 45 Manuela Abelho 9. Repartir em tubos de vidro (cerca de 10 mL em cada tubo) e esterilizar em autoclave; 10. Guardar no frio e no escuro e utilizar no prazo máximo de 10 dias. Composição do meio ‘agar triptonado de soja’: Digestato tríptico de caseína 15 g/L • Peptona de soja 5 g/L • Cloreto de sódio 5 g/L • Agar 15-25 g/L • Água destilada • pH 7.20.1 a 25ºC; 11. Dissolver, ajustar o pH e esterilizar; 12. Repartir por caixas de Petri (camada de cerca de 5 mm=cerca de 15 mL/caixa); 13. Guardar no frio e no escuro e utilizar no prazo máximo de 10 dias. Segundo tempo: recolha, filtração e incubação das amostras 1. Recolher, manipular e preservar as amostras de acordo com o Protocolo 3.1 (página 41); 2. Filtrar 100 mL de água (ou 250 mL no caso de águas engarrafadas) através do filtro de membrana (pelo menos dois filtros/amostra); 3. Colocar o filtro sobre a caixa de Petri com meio agar de lactose TTT com heptadecilsulfato de sódio; 4. Incubar a 362ºC durante 213 h. Terceiro tempo: exame e repicagem 1. Examinar a membrana e contar as colónias que apresentem uma cor amarela no meio por baixo da colónia (colónias lactose-positivas11); 2. Repicar todas essas colónias (ou no mínimo 10) para caixas com meio TSA e para tubos com caldo de triptofano; 3. Incubar o meio TSA a 362ºC durante 21 h2 h; 4. Incubar os tubos com caldo de triptofano a 440.5ºC durante 21 h3 h 11 Bactérias capazes de formar colónias em aerobiose a 362ºC num meio selectivo e diferencial com lactose, com produção de ácido. 46 Manuela Abelho Quarto tempo: diferenciação e contagem 1. Preparar o reagente do teste da oxidase, adicionando 0.1 mg de tetrametil-pfenilendiamina a 10 mL de água destilada; 2. Efetuar o teste da oxidase nas colónias incubadas mo meio TSA: Colocar sobre um papel de filtro duas ou três gotas do reagente da oxidase; Utilizando uma vareta de vidro ou de plástico, retirar uma parte da colónia e depositá-la sobre o papel de filtro molhado; Considerar que ocorreu uma reação positiva quando se desenvolve uma cor azul/violeta escuro em 30 segundos. 3. Efetuar o teste da produção da formação de indol nos tubos com caldo de triptofano: 3.1 Adicionar ao tubo 0.2 a 0.3 mL do reagente de Kovacs; 3.2 Considerar que ocorreu a formação do indol quando se desenvolve uma cor roxa-avermelhada na superfície do meio. 4. Considerar todas as colónias com reação negativa ao teste da oxidase como bactérias coliformes; 5. Considerar todas as colónias com reacção negativa ao teste da oxidase e com produção de indol como E. coli. 6. O relatório deve incluir a referência à norma, todos os detalhes necessários para a completa identificação da amostra, a técnica e o meio de cultura utilizados, o tempo e a temperatura de incubação, os resultados do ensaio e qualquer ocorrência observado no decurso da análise e a classificação da qualidade da água em função da sua utilização e de acordo com a legislação. Protocolo 3.4 - Deteção e enumeração de coliformes totais, coliformes fecais e Escherichia coli pelo método do Número Mais Provável (NMP) O teste completo permite enumerar os coliformes totais e os coliformes fecais (mas não especificamente E. coli) para o que são necessárias três fases: teste presuntivo, teste confirmativo e teste final. s No teste presuntivo (verificação da produção de gás) inoculam-se volumes apropriados da amostra em séries de tubos contendo meio de cultura apropriado, e a incubam-se a 370,5º C, durante 242 horas. Se findo esse período não tiver havido formação de gás em nenhum tubo, prolonga-se a incubação até às 483 horas. O meio de cultura inibe o crescimento dos microrganismos Gram-positivos e encoraja o crescimento dos microrganismos coliformes. Os coliformes usam o oxigénio presente no meio e através da fermentação produzem ácido e gás sob condições anaeróbias. Se não existir produção de gás o resultado do teste é negativo, estabelecendo-se que não existem coliformes na amostra. A formação de gás (resultado positivo) determina a 47 Manuela Abelho presença de coliformes na amostra. O número de tubos positivos em cada diluição é utilizado para calcular o NMP de microrganismos coliformes na amostra de água. No teste confirmativo (confirmação dos resultados) todos os tubos positivos às 24 horas são repicados para um apropriado, incubados a 37ºC e lidos nas condições anteriormente descritas. A formação de gás confirma a presença de coliformes na amostra. Este teste confirma os resultados uma vez que a formação de gás no teste presuntivo pode ter sido devida à atividade de microrganismos não coliformes, como por exemplo Clostridium perfringens, uma bactéria Gram-positiva. No teste final (verificação da presença de coliformes fecais), repete-se o procedimento utilizado no teste confirmativo mas a incubação é feita a 44.5ºC durante 24 a 48 horas. A formação de gás determina a presença de coliformes fecais na amostra. Se não existir formação de gás a 44.5ºC mas existir a 37ºC determina-se que existem coliformes mas que não são fecais. O NMP de coliformes fecais é determinado com base no número de tubos positivos em cada diluição. Um teste adicional permite determinar se a presença ou ausência de E. coli na amostra. Adiciona-se aos tubos inoculados para o teste final reagente de Kovacs (teste do indol). Uma reação positiva (formação de um anel cor-de-rosa) mostra a presença de E. coli. Uma reação negativa (formação de um anel da cor do meio) mostra que E. coli não faz parte da população de coliformes fecais presentes na amostra. Material para uma amostra Material indicado no Protocolo 1.1 (página 12) e no Protocolo 3.1 (página 41) • meio ‘caldo bílis verde brilhante’ de concentração dupla (5 tubos de ensaio) • meio ‘caldo bílis verde brilhante’ de concentração simples (25 tubos de ensaio, apenas para teste presuntivo e final) •; meio ‘caldo peptonado’ (15 tubos de ensaio) • 30 tubos Durham • pipetas de 0.1 mL • pipetas de 1 mL • pipetas de 10 mL • ansa • estufa a 37ºC • estufa a 44ºC • reagente de Kovacs. Primeiro tempo: elaboração dos meios de cultura ‘caldo bílis verde brilhante’ e ‘caldo peptonado’ Composição do ‘caldo bílis verde brilhante’: Triptona 10 g/L • Lactose 10 g/L • Bílis desidratada 20 g/L • Verde brilhante 0.0133 g/L • Água destilada • pH 7.00.1 a 25ºC 1. Adicionar todos os ingredientes e ajustar o pH ou seguir as instruções do preparado em pó (Protocolo 1.1, página 12) para preparar o meio de concentração simples; 2. Preparar meio com dose dupla (isto é, duas vezes a quantidade indicada na embalagem para a mesma quantidade de água); 48 Manuela Abelho 3. Colocar tubos Durham invertidos12 dentro dos tubos de ensaio pequenos (meio de concentração simples) e grandes (meio de concentração dupla); 4. Distribuir 10 mL de meio em cada tubo de ensaio; 5. Esterilizar em autoclave e guardar no frio até à sua utilização. Composição do ‘caldo peptonado’: Peptona 18 g/L • Cloreto de sódio 5 g/L • Extrato de carne 6 g/L • Água destilada • pH 7.20.1 a 25ºC 6. Para calcular a quantidade necessária de caldo peptonado, considerar que todos os tubos terão resultado positivo para coliformes, contando assim com 15 tubos por amostra e um volume de 10 mL de meio por tubo; 7. Adicionar todos os ingredientes e ajustar o pH ou seguir as instruções do preparado em pó (Protocolo 1.1, página 12); 8. Distribuir 10 mL de meio em cada tubo de ensaio; 9. Esterilizar em autoclave guardar no frio até à sua utilização. Segundo tempo: recolha das amostras e teste presuntivo 1. Recolher, manipular e preservar as amostras de acordo com o Protocolo 3.1 (página 41); 2. Inocular 5 tubos contendo 10 mL de meio verde brilhante duplo com 10 mL da amostra; 3. Inocular 5 tubos contendo 10 mL de meio verde brilhante simples com 1 mL da amostra; 4. Inocular 5 tubos contendo 10 mL de meio verde brilhante simples com 0.1 mL da amostra; 5. Incubar a 370.5º C durante 242 horas ou 483 horas. 12 Os tubos Durham são semelhantes a pequenos tubos de ensaio; acumulam o gás produzido pelos coliformes permitindo assim a detecção da sua presença numa dada amostra de água; a presença de gás nos tubos Durham é um resultado positivo para coliformes. 49 Manuela Abelho Terceiro tempo: verificação da existência de coliformes e teste final 1. Verificar a produção de gás nos tubos, anotando o número de tubos positivos em cada conjunto de 5 tubos de cada diluição; 2. Usar esses algarismos para determinar o NMP de microrganismos coliformes na amostra (para evitar falsos positivos, porque a formação de gás no teste presuntivo pode ter sido devida à atividade de microrganismos não coliformes, deveria ser feito o teste confirmativo, mas neste protocolo vamos saltar esse passo); 3. Repicar com uma ansa os tubos positivos para novos tubos contendo 10 mL de meio verde brilhante (cor verde) e para novos tubos contendo meio peptonado (cor amarela); 4. Levar a incubar a 44.5ºC durante 24+24 horas Quarto tempo: verificação da existência de coliformes fecais e de E. coli 1. Verificar a produção de gás nos tubos com meio verde brilhante, anotando o número de tubos positivos em cada diluição; 2. Usar esses algarismos para determinar o NMP de coliformes fecais na amostra; 3. Adicionar uma gota de reagente de Kovacs a cada um dos tubos com meio peptonado (cor amarela); 4. A formação de um anel cor-de-rosa é um resultado positivo que indica a presença de E. coli na amostra; 5. O relatório deve incluir a referência à norma e a classificação da qualidade da água em função da sua utilização e de acordo com a legislação e deve incluir também: a identificação completa da amostra, a técnica de inoculação e o meio de cultura utilizado, o tempo e a temperatura de incubação, os resultados obtidos com os tubos, o NMP de microrganismos coliformes, coliformes fecais e E. coli na amostra e qualquer ocorrência particular observada durante o decorrer da análise. 50 Manuela Abelho Protocolo 3.5 Deteção e enumeração de enterococos intestinais pelo método da filtração por membrana Norma: EN ISO 7899-2 | ISO 7899-2:2000 Consiste na deteção e na enumeração de enterococos13 intestinais, nomeadamente Enterococcus faecalis, E. faecium, E. durans e E. hirae. Eventualmente também se poderão enumerar outras espécies de enterococos e algumas espécies de estreptococos, em particular Streptococcus bovis e S. equinus. Os enterococos podem considerar-se como indicadores de contaminação fecal, embora alguns possam ter outras proveniências. A enumeração dos enterococos intestinais baseia-se na filtração de um volume conhecido de amostra, colocando-se o filtro sobre um meio sólido seletivo que contém azida de sódio (a azida de sódio inibe o crescimento das bactérias Gram-negativas) e cloreto de 2,3,5-trifeniltetrazolio, um composto incolor que se reduz a formazão, de cor vermelha, pela ação dos enterococos intestinais. No meio crescem colónias típicas, de cor vermelha, castanha ou rosa, total ou no centro da colónia. Se se formarem colónias típicas, a confirmação é feita por transferência da membrana para agar de bílis de esculina e azida, previamente aquecido a 44ºC. Neste meio os enterococos intestinais hidrolisam a esculina em 2 horas produzindo 6,7dihidroxicumarina que se combina com os iões ferro para formar um composto de cor castanha ou negra que se difunde pelo meio. Material para uma amostra Material indicado no Protocolo 1.1 (página 12) e no Protocolo 3.1 (página 41) • aparelho de filtração e bomba de vácuo • 2 filtros de 45 m • meio ‘Slanetz e Batley com solução TTT’ (2 caixas de Petri) • meio ‘agar bílis-esculina-azida’ (2 caixas de Petri) • estufa a 37ºC • estufa a 44ºC. 13 Microrganismos capazes de reduzir o cloreto de 2,3,5-trifeniltetrazolio (TTT) a formazão e de hidrolisar a esculina a 44ºC sobre os meios especificados nesta norma. 51 Manuela Abelho Primeiro tempo: elaboração dos meios de cultura ‘Slanetz e Bartley’, ‘solução TTT’ e ‘agar bílis-esculina-azida’ Composição do meio ‘Slanetz e Bartley’: Triptose 20 g/L • Extracto de levedura 5 g/L • Glucose 2 g/L • Hidrogenosulfato de di-potássio (K2HPO4) 4 g/L • Azida de sódio (NaN3) 0.4 g/L •Agar 8-18 g/L • Água destilada • pH 7.20.1 a 25ºC 1. Adicionar todos os ingredientes e ajustar o pH ou seguir as instruções do preparado em pó (Protocolo 1.1, página 12); 2. Esterilizar em autoclave e deixar arrefecer até 50-60ºC; Composição da ‘solução TTT’: 2,3,5-trifeniltetrazolio (TTT) 1 g/100 mL • Água destilada 3. Dissolver 1 g de cloreto de 2,3,5-trifeniltetrazolio (TTT) num pequeno volume de água, perfazer até 100 mL, esterilizar por filtração (0.2 m); ─•─ 4. Juntar 10 mL da solução TTT a 1000 mL do meio base arrefecido a 50-60ºC; 5. Repartir por caixas de Petri (cerca de 20 mL/caixa); 6. Guardar no frio e no escuro e utilizar no prazo máximo de 15 dias. Composição do meio ‘agar bílis-esculina-azida’: Triptona 17 g/L • Peptona 3 g/L • Extracto de levedura 5 g/L • Bílis desidratada 10 g/L • Cloreto de sódio 5 g/L • Esculina 1 g/L • Citrato de ferro (III) e amónia 0.5 g/l • Azida de sódio 0.15 g/L • Água destilada • pH 7.10.1 a 25ºC 7. Esterilizar em autoclave e repartir por caixas de Petri (cerca de 15 mL/caixa) 8. Guardar no frio e no escuro e utilizar no prazo máximo de 15 dias. Segundo tempo: recolha, filtração e incubação das amostras 1. Recolher, manipular e preservar as amostras de acordo com o Protocolo 3.1 (página 41); 2. Filtrar 100 mL (ou 250 mL no caso de águas engarrafadas) através do filtro de membrana (pelo menos dois filtros por amostra); 3. Colocar o filtro sobre a caixa de Petri com meio Slanetz e Bartley; 4. Incubar a 362ºC durante 444 h. 52 Manuela Abelho Terceiro tempo: confirmação e contagem 1. Examinar as membranas e contar todas as colónias que apresentem uma coloração vermelha, castanha ou rosa, no centro ou em toda a colónia; 2. Colocar a membrana numa caixa de Petri com meio agar bílis-esculina-azida, previamente aquecida a 44ºC; 3. Incubar a 440.5ºC durante 2 h; 4. Considerar um resultado positivo todas as colónias que apresentem, no meio circundante, uma coloração castanha ou negra e contá-las como enterococos intestinais 5. O relatório deve incluir a referência à norma, todos os detalhes necessários para a completa identificação da amostra, a técnica e o meio de cultura utilizados, o tempo e a temperatura de incubação, os resultados do ensaio e qualquer ocorrência observado no decurso da análise e a classificação da qualidade da água em função da sua utilização e de acordo com a legislação. Protocolo 3.6 - Detecção e enumeração de estreptococos fecais pelo método do Número Mais Provável (NMP) Material para uma amostra Material indicado no Protocolo 1.1 (página 12) e no Protocolo 3.1 (página 41) • meio ‘bagg’ de concentração dupla (5 tubos de ensaio) • meio ‘bagg’ de concentração simples (10 tubos de ensaio) • pipetas de 0.1 mL • pipetas de 1 mL • pipetas de 10 mL • estufa a 37ºC. Primeiro tempo: elaboração do meio de cultura ‘caldo bagg’ Composição do ‘caldo bagg’: Triptose 20 g/l • Dextrose 5 g/L • Fosfato dipotássico 4 g/L • Fosfato monopotássico 1.5 g/L • Cloreto de sódio 5 g/L • Azida sódica 0.5 g/L • Púrpura bromo cresol 0.015 g/L • Água destilada • pH 6.90.2 a 25ºC 1. Para calcular a quantidade necessária de caldo bagg simples e duplo, considerar, por amostra, 5 tubos de meio duplo e 10 tubos de meio simples, com um volume de 10 mL de meio por tubo; 2. Adicionar todos os ingredientes e ajustar o pH ou seguir as instruções do preparado em pó (Protocolo 1.1, página 12) para preparar o meio de concentração simples; 3. Preparar meio com dose dupla (isto é, duas vezes a quantidade indicada na embalagem para a mesma quantidade de água); 4. Distribuir 10 mL dos meios em tubos de ensaio pequenos (meio de concentração simples) e grandes (meio de concentração dupla); 5. Esterilizar em autoclave e conservar no frio até à sua utilização. 53 Manuela Abelho Segundo tempo: recolha das amostras e incubação 1. Recolher, manipular e preservar as amostras de acordo com o Protocolo 3.1 (página 41); 2. Inocular 5 tubos contendo 10 mL de meio bagg duplo com 10 mL da amostra; 3. Inocular 5 tubos contendo 10 mL de meio bagg simples com 1 mL da amostra; 4. Inocular 5 tubos contendo 10 mL de meio bagg simples com 0.1 mL da amostra; 5. Incubar a 370.5º C durante 242 horas ou 483 horas. Terceiro tempo: verificação da existência de estreptococos fecais 1. Verificar a alteração da cor do meio de cultura de roxo-violeta para amarelo (resultado positivo para a presença de estreptococos); 2. Usar esses algarismos para determinar o NMP de estreptococos fecais na amostra; 3. O relatório deve incluir a referência à norma e a classificação da qualidade da água em função da sua utilização e de acordo com a legislação e deve incluir também: a identificação completa da amostra, a técnica de inoculação e o meio de cultura utilizado, o tempo e a temperatura de incubação, os resultados obtidos com os tubos, o NMP de enterococos na amostra e qualquer ocorrência particular observada durante o decorrer da análise. Protocolo 3.7 - Deteção e enumeração de Clostridium perfringens (incluindo esporos) pelo método da filtração por membrana Material para uma amostra Material indicado no Protocolo 1.1 (página 12) e no Protocolo 3.1 (página 41) • aparelho de filtração e bomba de vácuo • 2 filtros de 45 m • meio ‘agar m-CP’ completo (2 caixas de Petri estufa a 37ºC • estufa a 44ºC. Primeiro tempo: elaboração do meio de cultura ‘agar m-CP’ Composição do meio ‘agar m-CP’: Sulfato de magnésio heptahidratado (MgSO4.7H2O) 0.1 g/L • Cloreto férrico hexahidratado 0.09 g/L • Hidrocloreto de L-cisteína 1.0 g/L • Extracto de levedura 20 g/L • Púrpura bromo cresol 0.04 g/L • Indoxil-D-glucosídeol 0.06 g/L • Triptose 30 g/L • Sacarose 5 g/L • Agar 15 g/L• Água destilada • pH 7.60.2 a 25ºC 1. Adicionar todos os ingredientes e ajustar o pH ou seguir as instruções do preparado em pó (Protocolo 1.1, página 12); 2. Deixar arrefecer e adicionar: D-ciclocernina 0.4 g/L; 54 Manuela Abelho Sulfato de B-poliximin:a 60 g dissolvidos em 8 mL de água destilada e esterilizada; Solução de 0.5% de difosfato de fenolftaleína: 20 mL filtrados e esterilizados; Solução 4.5% de FeCl3.6H2O: 2 mL/L; 3. Distribuir por caixas de Petri (cerca de 15 mL/caixa) e guardar no frio até à sua utilização. Segundo tempo: recolha das amostras e incubação 1. Recolher, manipular e preservar as amostras de acordo com o Protocolo 3.1 (página 41); 5. Filtrar 250 mL através do filtro de membrana (pelo menos dois filtros por amostra); 6. Colocar o filtro sobre a caixa de Petri com meio m-CP; 7. Incubar a 441ºC durante 213 h. Terceiro tempo: diferenciação 1. Examinar as colónias, identificando aquelas que se apresentam com cor amarela opaca; 2. Expor as colónias a vapores de hidróxido de amónio durante 20-30 segundos (com cuidados – por exemplo, numa hotte - para não inalar os vapores); 3. Contar todas as colónias anteriormente identificadas que passaram a rosa ou vermelho após a exposição aos vapores de hidróxido de amónio; 4. O relatório deve incluir a referência à legislação e a classificação da qualidade da água em função da sua utilização e deve incluir também: a identificação completa da amostra, a técnica de inoculação e o meio de cultura utilizado, o tempo e a temperatura de incubação, os resultados obtidos e qualquer ocorrência particular observada durante o decorrer da análise. 55 Manuela Abelho Protocolo 3.8 - Deteção e enumeração de Clostridium perfringens14 (incluindo esporos) pelo método do Número Mais Provável (NMP) Norma: EN 26461-1:1993 | ISO 6461-1:1986 Especifica um método para a deteção e contagem de esporos de microrganismos anaeróbio sulfito-redutores (clostrídios) por enriquecimento em meio líquido. Os esporos de microrganismos anaeróbios sulfito-redutores encontram-se amplamente dispersos no meio ambiente. Estão presentes na matéria fecal humana e animal, nas águas residuais e no solo. Ao contrário de Escherichia coli e de outros microrganismos coliformes, os esporos sobrevivem na água durante grandes períodos de tempo e são mais resistentes que as células vegetativas à ação de fatores químicos e físicos, podendo assim representar um sinal de contaminação antiga ou intermitente. Os esporos podem também resistir aos níveis de cloro utilizados normalmente no tratamento da água, sendo portanto úteis para as ações de controlo. Método da inoculação de tubos múltiplos e contagem segundo o NMP O Decreto-Lei nº306/2007 define o método apresentado no Protocolo 3.7 (página 54) como método analítico de referência para a pesquisa de Clostridium perfringens (incluindo esporos). O Decreto-Lei nº 236/98 considerava como métodos analíticos de referência para a quantificação de clostrídios sulfito - redutores em águas de consumo humano, o aquecimento da amostra a 80ºC e contagem dos esporos por (i) sementeira em meio com glucose, sulfito de ferro e contagem das colónias com halo negro; (ii) filtração através de membrana, colocação do filtro invertido sobre meio com glucose, sulfito de ferro, recoberto de gelose e contagem das colónias negras; e (iii) repartição em tubos de meio DRCM (diferencial reinforced clostridium medium), subcultura dos tubos negros para meio de leite tornesolado e contagem segundo o Número Mais Provável (NMP). Neste protocolo iremos utilizar uma modificação do terceiro método e da norma ISO 6461-1:1986; em vez de meio líquido e incubação em anaerobiose, para garantir a incubação na ausência de oxigénio utilizar-se-á meio sólido em tubos de ensaio. Material para uma amostra Material indicado no Protocolo 1.1 (página 12) e no Protocolo 3.1 (página 41) • meio ‘agar reinforced clostridial’ de concentração dupla (5 tubos de ensaio) • meio ‘agar reinforced clostridial’ de 14 Microrganismos anaeróbios sulfito-redutores que formam esporos, pertencentes à família Bacillaceae. 56 Manuela Abelho concentração simples (10 tubos de ensaio) • pipetas de 0.1 mL • pipetas de 1 mL • pipetas de 10 mL • banho-maria a 45ºC • banho-maria a 80ºC •estufa a 37ºC. Primeiro tempo: elaboração do meio de cultura ‘agar reinforced clostridial’ e das soluções ‘sulfito de sódio’ e ‘ferro amoniacal’ Composição do meio ‘agar reinforced clostridial’: Extracto de carne 4 g/L • Extrato de levedura 5 g/L • Triptona 10 g/L • Glucose 2g/L • Amido solúvel 1 g/L • Cloridrato de L-cisteína 0.3 g/L • Cloreto de sódio 5 g/L • Agar 8 g/L • Água destilada • pH 7.10.1 a 25ºC 1. Adicionar todos os ingredientes ou seguir as instruções do preparado em pó (Protocolo 1.1, página 12); 2. Preparar meio de concentração dupla (isto é, duas vezes a quantidade indicada na embalagem para a mesma quantidade de água); 3. Distribuir 10 mL dos meios de cultura em tubos de 10 mL; 4. Esterilizar em autoclave; 5. Guardar no frio até à sua utilização. Composição da solução ‘sulfito de sódio’: Sulfito de sódio (NaSO3) 1 g/100 mL • Água destilada 6. Dissolver o sulfito de sódio na água destilada e esterilizar por filtração; 7. Guardar no frio (2-5ºC) e utilizar no prazo de 14 dias. Composição da solução ‘ferro amoniacal’: Sulfato de ferro III amoniacal (alúmen de ferro) ou citrato de ferro III amoniacal 5 g/100 mL • Água destilada 8. Dissolver o sulfato ou o citrato de ferro na água destilada e esterilizar por filtração; 9. Guardar no frio (2-5ºC) e utilizar no prazo de 14 dias. Segundo tempo: recolha das amostras, inoculação e incubação 1. Recolher, manipular e preservar as amostras de acordo com o Protocolo 3.1 (página 41); 2. Distribuir a amostra de água em tubos de ensaio: 10 mL em 5 tubos de ensaio grandes (20 mL); 1 mL em 5 tubos de ensaio pequenos (10 mL) e 0.1 mL em tubos de ensaio pequenos (10 mL); 57 Manuela Abelho 3. Aquecer, num banho de água, os tubos com as amostras a 80ºC durante 10 minutos, de forma a inativar as células vegetativas que lá possam existir; 4. Deixar arrefecer e manter a 45ºC até à sua utilização; 5. Ferver em banho de água durante 15 minutos os tubos com o meio base, de forma a regenerar as condições de anaerobiose (i.e., para eliminar o oxigénio do meio de cultura); 6. Esperar que arrefeça e manter a 45ºC até à sua utilização; 7. Imediatamente antes da inoculação, adicionar em cada tubo com meio base de concentração dupla, 1 mL da solução de sulfito de sódio e 0.5 mL da solução de ferro amoniacal; 8. Adicionar em cada tubo com meio base de concentração simples, 0.5 mL da solução de sulfito de sódio e 0.25 mL da solução de ferro amoniacal; 9. Verter o meio de cultura para os tubos que contêm a amostra; meio de cultura de concentração dupla nos tubos que contêm 10 mL de amostra e meio de cultura de concentração simples nos tubos que contêm 1 mL e 0.1 mL de amostra; 10. Agitar suavemente, de forma a evitar a introdução de ar no meio de cultura e arrefecer imediatamente em água fria; 11. Incubar a 37ºC durante 1 a 5 dias. Terceiro tempo: leitura de resultados 1. Verificar se no meio de cultura aparecem colónias negras, isoladas ou não, que são indicadoras da existência de clostrídeos sulfito-redutores na amostra; 2. Contar os tubos que apresentam resultados positivos em cada diluição e usar esses algarismos para determinar o NMP de clostrídeos na amostra; 3. O relatório deve incluir a referência à norma e a classificação da qualidade da água em função da sua utilização e de acordo com a legislação e deve incluir também: a identificação completa da amostra, a técnica de inoculação e o meio de cultura utilizado, o tempo e a temperatura de incubação, os resultados obtidos com os tubos, o NMP de enterococos na amostra e qualquer ocorrência particular observada durante o decorrer da análise. Bibliografia citada Alcântara, F., Cunha, M.A. & Almeida, M.A. (2006). Microbiologia – práticas laboratoriais. Universidade de Aveiro, Aveiro. APA (2011). Qualidade do ar. Agência Portuguesa do Ambiente. Disponível em http://www.qualar.org/?page=5&subpage=1, consultado em 30-Junho-2011. Ferreira, W.F.C., Sousa, J.C.F. & Lima, N. (2010). Microbiologia. Lidel-Edições técnicas, Lda. Lisboa. 622 páginas. ISBN 978-972-757-515-2. 58 Manuela Abelho Filho, P.P.G., Silva, C.R.M. & Kritski, A.L. (2000). Ambientes climatizados, portaria 3.523 de 28/8/98 do Ministério da Saúde e padrões de qualidade do ar de interiores do Brasil. Jornal de Pneumologia, 26 (5). doi: 10.1590/S0102-35862000000500006. Disponível em http://www.scielo.br/scielo.php?script=sci_arttext&pid=S010235862000000500006&lng=pt&nrm=iso&tlng=pt. Friberg, B., Friberg, S. & Burman, L.G. (1999a). Correlation between surface and air count of particles carrying aerobic bacteria in operating rooms with turbulent ventilation. Journal of Hospital Infection, 42: 61-68. Friberg, B., Friberg, S. & Burman, L.G. (1999b). Inconsistent correlation between aerobic bacterial surface and air counts in operating rooms with ultra clean laminar air flows: proposal of a new bacteriological standard for surface contamination. Journal of Hospital Infection, 42: 287-293. Instituto Ciência Hoje (2010). Caça-corantes. Sociedade Brasileira para o Progresso da Ciência. Disponível em http://cienciahoje.uol.com.br/noticias/2010/01/imagens/Fungodescontaminantefig2 .jpg/view, consultado em 05-Julho-2011. Madigan, M.T., Martinki, J.M. & Brock, T.D. (2006). Biology of microorganisms. 11ª edição. Pearson Prentice Hall, Upper Saddle River, NJ. Mendes, B. (2010). Microbiologia da água. Páginas 506-522 in Ferreira, W.F.C, Sousa, J.C.F. & Lima, N. (coords.). Microbiologia. Lidel-Edições técnicas, Lda. Lisboa. 622 páginas. ISBN 978-972-757-515-2. Microbiologia Online (2011). Coloração de Gram. Disponível em http://microbiologiaonlineblog.blogspot.com/2010/12/microbiologia-online-comfoco-em.html, consultado em 30-Junho-2011. Microbiology Virtual Lab (2011). Streak Plate Method. Biotechnology Engineering, Amrita Vishawa VidyapeethamVirtual Labs. Disponível em http://amrita.vlab.co.in/?sub=3&brch=73&sim=213&cnt=1, consultado em 5-Julho2011. MicrobLog (2006). Legionella pneumophila. MicrobLog: Microbiology Training Medical Microbiology, Virology and Infectious Diseases. Disponível em http://microblog.me.uk/90, consultado em 30-Junho-2011. Morais, G.R., Silva, M.A., Carvalho, M.V. Santos, J.G.S., von Dolinger, E.J.O. & Brito, D.D. (2010). Qualidade do ar interno em uma instituição de ensino superior brasileira. Bioscience Journal, 26 (2): 305-310 Scientia (2011). Fungos. Disponível em http://www.scientia.blog.br/wordpress/?tag=fungos, consultado em 5-Julho-2011. 59 Manuela Abelho SGS (2011). Qualidade do ar interior. SGS. Disponível em http://www.pt.sgs.com/pt/quality_of_the_indoor_environment?serviceId=8565&lo bId=30893, consultado em 30-Junho-2011. 60
Download