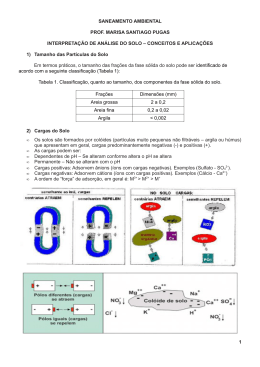
Conceitos Básicos sobre Fertilidade do Solo e Produtividade O solo é a parte superficial intemperizada da crosta terrestre, não consolidada, e contendo matéria orgânica e seres vivos. Nele se desenvolvem os vegetais, obtendo, através das raízes, a água e os nutrientes. (Raij, 1981). O solo é, portanto, o meio no qual as culturas desenvolvem-se para produzir fibras e madeiras para os mais diversos fins, formas de energia renovável (álcool, por exemplo) e, sobretudo, alimentos para atender a crescente demanda decorrente da explosão populacional. A fertilidade do solo é vital para a produtividade, mas um solo fértil não é necessariamente um solo produtivo. FERTILIDADE DO SOLO 1.Estudo da capacidade do solo em ceder elementos essenciais às plantas; 2.Situação do solo que se refere à quantidade e disponibilidade dos elementos necessários para o crescimento das plantas; 3.Qualidade do solo que torna-o capaz ou não de fornecer nutrientes em quantidades adequadas e apropriadamente balanceadas para o crescimento das plantas, quando outros fatores, tais como: luz, umidade, temperatura e condições físicas do solo são favoráveis. SOLO FÉRTIL-Solo que contém os nutrientes essenciais em quantidades adequadas e balanceadas para o normal crescimento e desenvolvimento das plantas cultivadas, apresenta boas características físicas e biológicas e é livre de elementos tóxicos. SOLO PRODUTIVO-Solo fértil, ou seja, que contém os nutrientes essenciais em quantidades adequadas e balanceadas para o normal crescimento e desenvolvimento das plantas cultivadas, apresenta boas características físicas e biológicas, é livre de elementos tóxicos e está situado em uma zona com fatores climáticos favoráveis. A má drenagem, os insetos, a seca e outros fatores podem limitar a produção, mesmo quando a fertilidade é adequada. Para compreendermos completamente a fertilidade do solo, precisamos conhecer também os outros fatores que favorecem, ou limitam, a produtividade, precisamos conhecer as relações solo-planta existentes. Certos fatores externos controlam o crescimento das plantas: ar, calor (temperatura), luz, suporte mecânico, nutrientes e água. A planta depende do solo, pelo menos em parte, para a obtenção de todos esses fatores, à exceção da luz. Cada um desses fatores afetam diretamente o crescimento da planta e está relacionado aos demais. H2 O CO2 B Cl Co Cu N P K Ca Mg S Fe Mn Mo Zn Fotossíntese: o milagre da natureza. Fonte: Malavolta, 1980. A disponibilidade de nutrientes é influenciada pelo balanço entre solo e água, assim como pela temperatura do solo. O crescimento das raízes também é influenciado pela temperatura do solo, bem como pela quantidade de água e pela aeração. Os nutrientes estão sendo constantemente exportados na forma de produtos de plantas e animais. Infelizmente, outros podem ser perdidos por lixiviação e erosão. Se o processo produtivo da agricultura fosse um sistema fechado, o balanço nutricional poderia ser relativamente estável. Isto não ocorre assim, entretanto, e é por isto que é essencial compreender os princípios de fertilidade do solo para uma produção eficiente das culturas e para a proteção ambiental. Constituição do Solo O solo apresenta quatro fases, que são: sólida, líquida, gasosa e biológica. A interação dessas quatro fases é que torna possível o desenvolvimento de vegetais no solo, graças a um conjunto de propriedades e processos que permitem a retenção de água e nutrientes e sua liberação às raízes. O solo apresenta-se em camadas ou horizontes, chamados O, A, E, B e C. O conjunto desses horizontes denomina-se perfil do solo, conforme ilustrado a seguir. o o O A Oo : Material orgânico mal ou não decomposto Od, Odo : Acentuada decomposição de material orgânico E AB ou EB : Horizontes de transição BA ou BE : Horizontes de transição B C BC CB Horizontes de transição R Perfil hipotético de um solo. o O horizonte O ocorre apenas em alguns solos. Consiste em uma camada delgada de restos orgânicos, tais como folhas, galhos e restos de vegetais em decomposição. O horizonte A do solo é a camada mineral próxima da superfície. Apresenta um acúmulo de matéria orgânica, em grande parte já humificada. Em solos cultivados forma-se uma camada arável, de constituição mais ou menos uniforme e que pode incluir, também, parte do horizonte E. O horizonte E, também chamado eluvial, apresenta um empobrecimento relativo de materiais sólidos (argilas) silicatados, óxidos de ferro e alumínio ou matéria orgânica, individualmente ou em conjunto, e que são translocados para o horizonte B. O horizonte B situa-se abaixo do horizonte E. Apresenta-se com cores mais claras que o horizonte A, devido a menores teores de matéria orgânica, com um máximo desenvolvimento da estrutura e, freqüentemente, com acúmulo de materiais removidos do horizonte E. É chamado de horizonte iluvial. O horizonte C situa-se abaixo do horizonte B e é uma camada pouco influenciada pela ação biológica. Apresenta características mais próximas do material que provavelmente deu origem ao solo. Abaixo do horizonte C, encontra-se a rocha (R), em muitos casos similar à rocha que deu origem ao solo. Textura e Estrutura do Solo O solo pode ser considerado como um aglomerado de partículas unitárias de vários tamanhos, de natureza orgânica e inorgânica (ou mineral). A separação e a determinação de partículas de diferentes tamanhos estabelecem a granulometria dos solos. Frações granulométricas do solo Fração Pedras Tamanho das Partículas (mm ) Maior que 20 Cascalho 20 a 2 Areia Grossa 2 a 0,2 Areia Fina Silte ou Limo Argila 0,2 a 0,02 0,02 a 0,002 Menor que 0,002 (Fonte: Raij, 1981) A textura do solo é determinada pela quantidade de areia, limo (silte) e argila que ele possui. Quanto menor o tamanho das partículas, mais próxima da muito argilosa e quanto maior o tamanho das partículas, mais próxima da arenosa estará a textura. As classes texturais para solos são mostradas na Figura a seguir. O termo estrutura refere-se à agregação das partículas unitárias do solo em unidades compostas, de forma e tamanho variável. A textura e a estrutura do solo influenciam a quantidade de ar e de água que as plantas em crescimento podem obter, ou seja, estão diretamente relacionadas com a porosidade do solo que por sua vez se divide em macroporosidade e microporosidade. • A funcionalidade poros: – microporos são os responsáveis pela retenção e armazenamento da água no solo e – macroporos responsáveis pela aeração e pela maior contribuição na infiltração de água no solo. Tipos de estrutura e classes estruturais. Representação da macroporosidade e microporosidade de um solo. O tamanho das partículas é importante por duas razões: 1.As partículas menores, de argila, são mais fortemente unidas do que as partículas maiores, de areia. Isto significa que existem pequenos poros para a água e para o ar. 2.As partículas menores apresentam superfícies específicas muito maiores do que as partículas maiores. Por exemplo, a maior partícula de argila tem cerca de 25 vezes mais área de superfície do que a menor partícula de areia. À medida que a área de superfície aumentar, a quantidade de água adsorvida (retida) aumentará. Influência das frações (areia, silte e argila) em algumas propriedades e comportamento do solo. Muitos solos do Brasil e da região tropical, apesar de terem altos teores de argila, comportam-se, em termos de retenção de água, como solos arenosos. São solos com argilas de baixa atividade (caulinita e sesquióxidos - termo que inclui óxidos, oxi-hidróxidos e hidróxidos), em geral altamente porosos. Muitos Latossolos sob cerrado apresentam esta característica. Apesar dos solos argilosos possuírem, em geral, maior capacidade de retenção de água que os solos arenosos, nem toda esta umidade está disponível para as plantas em crescimento. Os solos argilosos (e aqueles com altos teores de matéria orgânica) retêm mais fortemente a água que os solos arenosos. Isto significa mais água não disponível. Assim sendo, os solos argilosos retêm mais água do que os arenosos, mas a maior parte desta água não é disponível. A água disponível para as plantas em crescimento é a quantidade que o solo contém entre a capacidade de campo e o ponto de murchamento permanente. A Figura abaixo mostra o mm H2 O/30 cm de solo 125 100 75 o mp a c e ed d a cid a p Ca Água disponível nte e n a er m p a r ch u m de o t Pon 50 25 0 Areia Franco arenoso Franco siltoso Franco argiloso Argila Relação entre classe textural e disponibilidade de água no solo. Fonte: Lopes, 1989. o como a água disponível varia de acordo com a textura do solo. A maior ou menor quantidade de água disponível para as plantas dependerá das interações da água dentro do sistema solo-planta-atmosfera. Os solos arenosos não podem armazenar tanta água quanto os solos argilosos, mas uma maior porcentagem da água que está presente nos solos arenosos está disponível. Conseqüentemente, não existe uma relação constante entre textura e água disponível. Os solos de textura fina (argiloso e muito argiloso) são facilmente compactados. Isto reduz o espaço poroso, o que limita o movimento do ar e da água através do solo, causando um grande escorrimento superficial das águas da chuva. O déficit hídrico pode tornar-se um problema, mesmo sob fortes chuvas. Alguns tipos de argilas são pegajosas quando molhadas e formam torrões duros quando secos. Conseqüentemente, o teor adequado de umidade é extremamente importante quando o solo é preparado para o plantio. Muitos solos da região tropical, mesmo apresentando altos teores de argila, apresentam excelente agregação e estrutura. Isto é devido à presença de sesquióxidos de ferro e alumínio em teores elevados. Muitos Latossolos brasileiros apresentam excelentes condições de estrutura. Os solos arenosos são, por natureza, mais secos, porque retêm pouca água. Eles são soltos, com menor tendência para a compactação do que os argilosos e fáceis de preparar. Entretanto, os solos que contêm altas proporções de areia muito fina são facilmente compactados. Os solos com alto teor de silte são geralmente os que apresentam a pior estrutura. As partículas se agregam e eles são compactados muito facilmente. A estrutura do solo influencia de modo marcante o crescimento das raízes e da parte aérea. À medida em que o solo torna-se mais compacto, a proporção de maiores espaços porosos decresce, o crescimento das raízes diminui e a produção declina. A textura e a estrutura do solo e, conseqüentemente a sua porosidade, são fatores determinantes, não somente do armazenamento de água e do desenvolvimento radicular, mas também do armazenamento de nutrientes, mobilidade desses na fase líquida e perdas por lixiviação e erosão. A avaliação da textura em laboratório é indispensável para que o agricultor faça uso eficiente de fertilizantes e corretivos agrícolas. O conhecimento, pelo menos do teor de argila de uma gleba, tem sérias implicações no manejo da adubação. A estrutura e a porosidade do solo de uma gleba, embora mais difíceis de serem avaliadas, ajudam a determinar (Lopes e Guilherme, 1989b): . A maior ou menor predisposição a perdas decorrentes da erosão; . Problemas de impedimentos físicos ao desenvolvimento normal das raízes; .Potencial de lixiviação de nutrientes, em conjunção com o conhecimento da textura do solo da área. O solo "ideal" para a produção das culturas deve possuir as seguintes características: . Textura franca e teor adequado de matéria orgânica para o movimento da água e do ar; . Quantidade suficiente de argila para reter a umidade de reserva no solo; . Subsolo permeável e profundo, com níveis adequados de fertilidade; . Meio ambiente adequado para as raízes se aprofundarem em busca de umidade e nutrientes. O manejo adequado mantém ou desenvolve a boa estrutura, que estimula um sistema radicular extenso. O tamanho e a forma dos grânulos determinam a qualidade da estrutura. A melhor estrutura do solo é em blocos ou granular, com partículas agregadas, para permitir o livre movimento do ar e da água. Algumas técnicas de manejo para a manutenção de uma adequada estrutura do solo são as seguintes: . Evitar a movimentação de máquinas e implementos em solos argilosos com excessiva umidade; .Evitar práticas de preparo intensivo que levem à pulverização do solo; . Fazer uso do cultivo mínimo ou plantio direto, quando aplicável; . Manter cobertura vegetal durante o maior tempo possível, para evitar o impacto direto da gota de chuva que provoca o desagregamento e posterior arrastamento superficial das partículas de solo (erosão); . Manter ou aumentar o teor de matéria orgânica do solo mediante práticas de adubação verde, rotação de culturas, manejo dos restos culturais e adubação orgânica; . Implementar um programa adequado de conservação do solo e de água. Colóides e Íons do Solo À medida que os solos são formados, durante os processos de intemperização, alguns minerais e a matéria orgânica são reduzidos a partículas extremamente pequenas. As mudanças químicas diminuem ainda mais estas partículas, até o ponto em que elas não podem ser vistas a olho nu. Estas partículas de menor tamanho são chamadas de "colóides". Os cientistas aprenderam que os colóides minerais argilosos possuem estrutura semelhante a placas e são de natureza cristalina. Na maioria dos solos, os colóides argilosos excedem em quantidade os colóides orgânicos. Os colóides são os principais responsáveis pela atividade química dos solos. A maioria dos colóides (argilosos ou orgânicos) apresenta carga líquida negativa (-), desenvolvida durante o processo de formação. Isto significa que ele pode atrair e reter materiais com carga positiva (+), do mesmo modo que pólos diferentes de um ímã se atraem. Esses colóides repelem outros materiais de carga negativa, da mesma forma que pólos idênticos de um imã se repelem. 1. Origem das cargas negativas: As cargas negativas no solo, que, em geral, superam as cargas positivas, são consideradas como originárias de: 1a) Faces quebradas do cristal da argila: Quando um cristal de argila é rompido, alguns grupos hidroxílicos (OH) podem ficar expostos, e o hidrogênio (H+) desses radicais OH, frouxamente retido, pode ser facilmente trocado por outro cátion, conforme exemplificado na Figura a seguir. o o Hidrogênio trocável mantido frouxamente Uma valência do oxigênio é atendida por Al-O- ..........................H dentro do cristal + Formação de cargas negativas nas arestas quebradas de argila. Fonte: Lopes & Guidolim , 1989. o o 1b) Substituição isomórfica: Em certos tipos de argilas, notadamente aquelas do tipo 2: 1 como as montmorilonitas, alguns íons de Al3+ dos octaedros são substituídos por íons de Mg2+. Cada substituição resulta em uma valência (carga) negativa livre não atendida, uma vez que um íon trivalente (Al3+) é substituído por um divalente (Mg2+). Do mesmo modo, em minerais como a ilita, a substituição de um íon tetravalente (Si4+) dos tetraedros por um íon trivalente (Al3+) deixa uma valência (carga) negativa livre. As cargas geradas pelo processo de substituição isomórfica são permanentes, pois não dependem do pH do solo para ocorrerem. Em solos em que predominam esses tipos de argila, esse processo natural é responsável pela parcela principal de sua capacidade de adsorção ou capacidade de troca catiônica (CTC). (Lopes e Guidolin, 1989). 1c) Dissociação do grupo OH-: A presença do grupo OH nas bordas de um cristal da argila ou na matéria orgânica possibilita a formação de carga elétrica negativa. o o OH O OH OH Al Al O OH OH O OH OH Mg Al O OH 1/2 Sem substituição 1/2 Com substituição Exemplo de substituição isomórfica (Fonte: Lopes & Guidolin, 1989). o As cargas oriundas da dissociação dos radicais orgânicos (carboxílicos e fenólicos, em geral) e do OH presente nos minerais, principalmente sesquióxidos de ferro e alumínio, são chamadas de cargas dependentes do pH, pois, à medida que se eleva o pH, o seu aparecimento é favorecido. O mesmo pode ocorrer pela desobstrução de cargas da matéria orgânica ocupadas por alumínio, ferro e manganês. É um processo que ocorre em função da calagem adequada dos solos ácidos. (Lopes e Guidolin, 1989) o o o (Dissociação) (1) Carboxílicos O R C O OH + OH R C O + H2O (2) Fenólicos (Dissociação) O OH + OH + H2O Elevação do pH Formação de cargas negativas dependentes depH (Fonte: Lopes & Guidolin, 1989). o o o (3) Óxidos OH OH Al O OH + 3OH O OH OH o R O C O R O C O + 3H 2O Al OH (4) Complexos O C O o Al Al R (Dissociação) (Desobstrução) O R C O O Al + 3OH R C O + Al(OH) 3 O R C O Elevação do pH Exemplos de formação de cargas dependentes de pH (Fonte: Lopes & Guidolin , 1989) o A carga negativa (-) do solo pode ser então permanente ou variável. A carga variável, que depende do pH do solo, é muito importante para as condições da maioria dos solos brasileiros. Sob estas condições, as únicas formas de aumentar a carga negativa variável e, conseqüentemente, aumentar a capacidade de troca de cátions (CTC), é através da calagem (elevação do pH), manejo adequado dos restos culturais, adubação verde e adubação orgânica. 2. Origem de cargas positivas: Muitos solos da região tropical apresentam também cargas positivas, muito embora na grande maioria predominem as cargas negativas. Mesmo em solos que apresentam uma grande proporção de colóides com cargas elétricas positivas, a presença da matéria orgânica, cuja quase totalidade é formada por cargas negativas e dependentes de pH, leva a um balanço final de cargas negativas nas camadas superiores do solo. Isto não elimina a possibilidade de ocorrer em certos solos, nas camadas subsuperficiais, uma predominância de cargas positivas. As cargas positivas do solo ocorrem pela protonação das hidroxilas (OH) dos óxidos de ferro e alumínio, em condições de pH extremamente baixos . (Lopes e Guidolin, 1989). o o OH2+ OH Al O Al OH2+ 3H+ + Al O OH Al OH2+ OH Diminuição do pH Exemplo de formação de cargas positivas no solo pela protonação de hidroxilas (OH) dos óxidos e hidróxidos de ferro e alumínio, em condições de pH extremamente baixo. Fonte: Raij, 1981. o O fato das partículas coloidais do solo apresentarem cargas elétricas negativas (-), predominantemente, e positivas (+). Este é, sem dúvida alguma, um dos fenômenos mais importantes da natureza, sendo o responsável pelo armazenamento e liberação dos nutrientes, que se encontram na forma iônica no solo. Um elemento com uma carga elétrica é chamado de "íon". O potássio, o sódio, o hidrogênio, o cálcio e o magnésio possuem cargas positivas. Eles são chamados de "cátions", e podem ser escritos na forma iônica, como é mostrado a seguir. Note-se que alguns cátions possuem mais de uma carga positiva. ___________________________________________________ Nutriente Símbolo Químico Forma Iônica ___________________________________________________ Potássio K K+ Sódio Na Na+ Hidrogênio H H+ Cálcio Ca Ca2+ Magnésio Mg Mg2+ Alumínio Al Al3+ ___________________________________________________ Os colóides de cargas negativas atraem os cátions e os retêm, como um imã retém pequenos pedaços de metal. o o + N _ _ S S + N Polos iguais (cargas) se repelem _ _ _ _ _ S Al+++ Na+ _ _ _ NO3 _ K+ Cl + N S Polos diferentes (cargas) se atraem Ca++ _ Mg++ _ + N _ _ _ Ca++ SO4 H+ NO3 Cátions são atraídos por partículas de argila e de matéria orgânica do solo. Fonte: PPI, 1995. o o Esta característica dos colóides explica porque o nitrogênio, na forma de nitrato (NO3_ ), é lixiviado mais facilmente no solo do que o nitrogênio na forma de amônio. (NH4+). O nitrato possui carga negativa, como os colóides do solo. Assim sendo, o nitrato não é retido pelo solo, mas permanece como um íon na água do solo, passível de ser lixiviado através do perfil, em alguns solos e sob certas condições de pluviosidade. Os íons com cargas negativas, tais como o nitrato e o sulfato (SO42-) são chamados de "ânions". A seguir são mostrados alguns ânions comuns: ___________________________________________________ Ânion Forma Iônica ___________________________________________________ Cloreto CINitrato NO3Sulfato SO42Fosfato PO43___________________________________________________ Retenção de Ânions no Solo Muitos solos da região tropical apresentam também cargas positivas, muito embora na grande maioria predominem as cargas negativas. As cargas positivas do solo ocorrem pela protonação das hidroxilas (OH) dos óxidos de ferro e alumínio, em condições de pH extremamente baixos (Lopes e Guidolin, 1989). A superfície do óxido pode apresentar-se desprovida de carga é o pH a que isso ocorre é chamado de ponto de carga zero ou PCZ. Se o pH se elevar acima do PCZ, ocorre dissociação de hidroxilas da superfície do mineral, com liberação de cargas negativas e aumento da capacidade de troca catiônica (CTC). Essas cargas negativas serão contrabalanceadas por cátions trocáveis, como cálcio, magnésio, potássio e sódio. Argilas e MO Goethita Hematita Gibsita Caulinita Húmus PCZ 6,7 5,4 5,0 <4,0 <3,0 Por outro lado se o pH estiver abaixo do PCZ, ocorre a adsorção de prótons ou íons H+, passando apresentar capacidade de troca aniônica (CTA) e possibilidade de reter ânions como NO3-, Cl-, SO42-, H2PO4e HPO42- que se encontram dissolvidos na solução do solo. Deve-se ressaltar que a troca de ânions aumenta com a diminuição do pH, ao contrário do que ocorre com a troca de cátions que aumenta com a elevação do pH. No caso particular dos ânions SO42-, H2PO4- e HPO42- que ocorrem na solução do solo em princípio participariam da troca aniônica como no caso dos ânions NO3- e Cl-. Mais comumente eles seriam repelidos da superfície do solo pelas cargas negativas, permanecendo na solução do solo. No entanto os fosfatos têm tendência de formar compostos de solubilidade muito baixa com ferro, alumínio e cálcio, razão pela qual o fósforo inorgânico ocorre ligado ao ferro, alumínio e cálcio. A reação do fósforo com esses metais pode-se dar na solução do solo, com formação de precipitados, ou pode ocorrer na superfície das partículas de argilas, óxidos de ferro e alumínio, ou de carbonato de cálcio, sendo a ligação do tipo covalente de alta energia. O íon sulfato pode se comportar de maneira semelhante ao do fosfato, em solos com predominância de cargas elétricas negativas é pouco retido, já em solos com apreciáveis teores de óxidos de ferro e alumínio, o sulfato pode ser adsorvido ao solo, contudo, a retenção é bem menos energética que a de fosfatos. O mecanismo de formação de cargas na matéria orgânica tem alguma similaridade como o desenvolvimento de cargas negativa e positivas nos óxidos. Na matéria orgânica as cargas negativas desenvolvem-se a valores de pH bem mais baixos que os óxidos e é provável que o PCZ da MO seja baixo demais para permitir a ocorrência de cargas positivas operantes nas condições usuais de acidez dos solos. (Raij, 1991). Considerando que predominam nas condições dos solos tropicais cargas negativas, pode-se concluir que a retenção de ânions em solos deverá ser mais importante em valores de pH mais baixos e nas camadas mais profundas dos solos. O solo como um reservatório de cátions Os cátions, elementos químicos que ocorrem nos solos, podem ser ácidos ou básicos: Cátions Ácidos: Hidrogênio (H+) Alumínio (Al3+) Cátions Básicos: Cálcio (Ca2+) Magnésio (Mg2+) Potássio (K+) Sódio (Na+) O valor de pH dá uma idéia da relação entre a soma de cátions ácidos e de cátions básicos no solos. Quanto mais ácido o solo, maior o teor desses cátions ácidos e menor o teor de cátions básicos. pH do Solo O termo pH define a acidez ou a alcalinidade relativa de uma substância. A escala de pH cobre uma amplitude de 0 a 14. Um valor de pH igual a 7,0 é neutro. Valores abaixo de 7,0 são ácidos e acima de 7,0 são básicos ou alcalinos. Quando saturado com H+, um solo comporta-se como um ácido fraco, dissociam-se pouco. Quanto mais H+ for retido no complexo de troca maior será a acidez do solo. O pH do solo simplesmente mede a atividade do íon hidrogênio. O alumínio também age como um elemento acidificante e ativa o H+. Os íons básicos, tais como Ca2+ e Mg2+, tornam o solo menos ácido (mais básico). O pH da maioria dos solos produtivos varia entre os valores de 4,0 a 9,0. Os graus de acidez e de alcalinidade para esta amplitude de pH são mostrados a seguir. o o pH 9,0 Forte Alcalinidade Média 8,0 Fraca Neutralidade 7,0 Fraca Moderada 6,0 Média 5,0 Forte 4,0 Muito forte Acidez Faixas de acidez e alcalinidade encontradas na maioria dos solos agrícolas. Fonte: Lopes, 1989. o o pH e disponibilidade dos elementos no solo para as plantas Para fins práticos, considera-se a faixa de pH entre 6,0 e 6,5 adequada para a maioria das plantas cultivadas no Brasil. o o Disponibilidade crescente Ferro Faixa Cobre adequada Manganês para a Zinco maioria das culturas Molibdênio Cloro Fósforo Nitrogênio Enxofre Boro Potássio Cálcio Magnésio Alumínio 5,0 6,0 7,0 pH 8,0 9,0 Amplitude de pH vs disponibilidade de nutrientes e alumínio. Fonte: Malavolta, 1979. o o Embora a maioria das culturas desenvolva-se melhor quando o pH está entre 6,0 e 6,5, outras apresentam melhor desenvolvimento em diferentes faixas de pH, veja o ex. A seguir. Faixas de pH mais adequadas para algumas culturas Cultura pH mais favorável Aboboreira 5,5 - 6,5 Aipo 6,0 - 7,0 Alface 6,0 - 7,0 Alfafa 6,5 - 7,5 Algodoeiro 5,5 - 6,5 Arroz 5,0 - 6,5 Aspargo 6,0 - 7,0 Aveia 5,5 - 7,0 Batatinha 5,0 - 5,5 Batata Doce 5,0 - 5,7 Beringela 5,5 - 6,0 Beterraba 6,0 - 7,0 Cafeeiro 6,0 - 7,0 Cana-de-açúcar 5,5 - 6,5 Capins 5,5 - 7,0 Cebola 6,0 - 6,5 Cenoura 5,7 - 7,0 Centeio 5,5 - 7,0 Cevada 5,5 - 7,0 Cítricos 5,0 - 7,0 Couve 5,7 - 7,0 Couve-Flor 6,0 - 7,0 (Fonte: Malavolta, 1981) continua As propriedades do solo variam em diferentes áreas. O pH ótimo em uma região pode não ser o melhor em outras regiões. Mesmo em uma determinada área existe considerável variação quanto ao pH ótimo para o desenvolvimento das culturas. As diferenças entre as regiões podem existir para culturas como o milho, a soja e a alfafa, mas não para a batata inglesa. Algumas culturas, como a batata inglesa e a soja, podem ser afetadas por doenças e/ou deficiências de micronutrientes, se o pH do solo estiver abaixo ou acima de suas necessidades individuais, independentemente da área geográfica. Um exemplo de como a produção de algumas culturas pode variar em função do pH do solo está demonstrado na Tabela abaixo. Produção relativa (%) em função do pH Cultura pH 4,7 pH 5,0 pH 5,7 pH 6,8 pH 7,5 Milho 34 73 83 100 85 Trigo 68 76 89 100 99 Aveia 77 93 99 98 100 Centeio 0 23 80 95 100 Alfafa 2 9 42 100 100 Trevo doce 0 2 49 89 100 Trevo Vermelho 12 21 53 98 100 Soja 65 79 80 100 93 32,3 47,0 71,9 97,5 97,1 Médias (Fonte: Malavolta, 1985) Origem da Acidez do solo O pH do solo é influenciado por vários fatores, incluindo: material de origem, precipitação, decomposição da matéria orgânica, vegetação nativa, tipo de cultura, profundidade do solo, inundação, adubação nitrogenada e hidrólise do alumínio. Os dois principais fatores que provocam a acidificação do solo são a decomposição da matéria orgânica e a adubação nitrogenada. 1. Material de Origem - O grau de acidez ou de alcalinidade do solo é influenciado pelos tipos de materiais de origem do solo. Os solos desenvolvidos de rochas ou de material de origem básicos geralmente possuem valores de pH mais altos do que aqueles formados de rochas ácidas (por exemplo: granito). 2. Precipitação - A chuva também afeta o pH do solo. A água, passando pelo solo, lixivia os nutrientes básicos, como o cálcio e o magnésio, na água de drenagem. Eles são substituídos por elementos acidificantes como o hidrogênio, o manganês e o alumínio. Assim sendo, os solos formados sob condições de alta pluviosidade são mais ácidos do que aqueles formados sob condições áridas. 3. Decomposição da matéria orgânica - A matéria orgânica do solo está, continuamente, sendo decomposta pelos microorganismos em ácidos orgânicos e outros compostos, bem como dióxido de carbono (CO2) e água, estes últimos formando ácido carbônico. O ácido carbônico, por sua vez, reage com os carbonatos de cálcio e magnésio no solo para formar bicarbonatos solúveis que são lixiviados, deixando o solo mais ácido. Além disso, pela dissociação do gás carbônico: CO2 + H2O => H+ + HCO3-, o H+ transfere-se então para a fase sólida do solo e libera cátions trocáveis (Ca e Mg), que serão lixiviados na forma de bicarbonatos, deixando o solo mais ácido. Esse fenômeno é favorecido por valores de pH elevados, tornando-se menos importante em pH baixos, sendo inexpressivo a pH abaixo de 5,2. Portanto, em solos muito ácidos não é provável uma grande acidificação através do bicarbonato. 4. Vegetação Nativa - O tipo de vegetação existente durante a formação do solo influencia o pH. Os solos formados sob vegetação de floresta tendem a ser mais ácidos do que aqueles desenvolvidos sob vegetação de gramíneas. As coníferas causam maior acidez do que as florestas decíduas. 5. Tipo de Cultura - Os solos podem tornar-se mais ácidos quando as colheitas removem as bases. Culturas diferentes removem quantidades diferentes de cálcio e magnésio, como pode ser visto, para algumas culturas na Tabela a seguir. Quantidade de Ca e Mg removidos pelas culturas Remoção (kg/ha) Cultura Produção Ca Mg Alfafa 20 t (Feno) 224 45 Milho 9 t (Grã os) 2 16 11 t (Colmo + Sabugo) 29 34 1,2 t (Fibra) 2 3 2,4 t (Ramos + Folhas) 31 20 3,4 t (Grãos) 8 17 Algodão Soja As leguminosas geralmente contêm maiores quantidades desses nutrientes do que as plantas não leguminosas. As quantidades de cálcio e de magnésio também variam de acordo com a parte da planta que é removida. Várias leguminosas liberam íons de hidrogênio (H+) na sua rizosfera quando estão fixando ativamente o nitrogênio (N2) atmosférico. A acidez gerada pode variar de 0,2 a 0,7 unidades de pH por mol de nitrogênio fixado. O O 7,5 pH do s olo 7,0 Ryegrass 6,5 6,0 Trevo vermelho 5,5 5,0 Fonte: PPI, 1995. 4,5 4,0 O 1 2 3 4 5 6 7 Colheita Efeito da fixação simbiótica de N no pH do solo. Comparação entre gramínea (ryegrass) e trevo vermelho. Solo fértil, vasos, 14 meses. O 6. Profundidade do Solo - A acidez geralmente aumenta com a profundidade do solo, exceto em áreas de baixa pluviosidade. A perda do solo superficial por erosão pode aumentar a acidez na camada arável. À medida em que a profundidade do solo superficial diminui, mais subsolo é incluído na camada arável. Existem casos em que o pH do subsolo é mais elevado do que o solo superficial. Como resultado, a erosão poderia contribuir para elevar os valores de pH do solo. 7. Inundação - O efeito geral da inundação é uma elevação do pH nos solos ácidos e a diminuição do pH nos solos básicos. Independente do pH original, a maioria dos solos atinge pH entre 6,5 e 7,2 após um mês sob inundação e permanece assim até secar. Conseqüentemente, a calagem tem pouco valor para arroz irrigado por inundação. Calagem, nesse caso, é muito mais fonte de cálcio e magnésio para as plantas. 8. Adubação Nitrogenada - O nitrogênio do fertilizante, da matéria orgânica, do esterco, e da fixação por leguminosas, produz acidez. Não obstante os diversos benefícios da adubação no aumento da produtividade agropecuária, a segunda causa principal da acidificação é ocasionada por alguns fertilizantes (sobretudo os amoniacais e a uréia), os quais, durante a sua transformação no solo (pelos microorganismos), resultam em H+: 9. Hidrólise do Alumínio - Alguns autores ainda atribuem uma outra causa importante da acidificação dos solos, que é devida à hidrólise do alumínio, a qual produz íons H+, de acordo com a reação: Al3+ + 3H2O =======> Al (OH)3 + 3H+ Componentes da Acidez do Solo A acidez do solo pode ser dividida em acidez ativa e acidez potencial e esta, por sua vez, em acidez trocável e acidez não trocável. Denomina-se acidez ativa a parte do hidrogênio que está dissociada, ou seja, na solução do solo, na forma de H+, e é expressa em valores de pH. A acidez trocável refere-se aos íons H+ e Al3+ que estão retidos na superfície dos colóides por forças eletrostáticas. A quantidade de hidrogênio trocável, em condições naturais, parece ser pequena. A acidez não trocável é representada pelo hidrogênio de ligação covalente, associado aos colóides com carga negativa variável e aos compostos de alumínio. A acidez potencial corresponde à soma da acidez trocável e da acidez não trocável do solo. Em resumo: . Acidez ativa ........................ H+ da solução do solo . Acidez trocável .................. Al3+ trocável + H+, quando houver . Acidez não trocável .......... H+ de ligação covalente . Acidez pontencial .............. Al3+ trocável + H+ trocável,quando houver, + H+ de ligação covalente. Um esquema dos principais componentes de acidez, em relação às frações ativas de matéria orgânica, minerais de argila, óxidos, oxihidróxidos e hidróxidos de ferro e alumínio, é mostrado na figura a seguir. o o Fase sólida Fase líquida Al 3+ _ Ca Al _ AlO H Argila CTC Humus _ _ COO _Al _ COO _H _ O _H _ Óxidos FeO H Acidez trocável Acidez não trocável _ AlO H Ca2+ H+ H+ Acidez ativa Acidez trocável + Acidez não trocável = Acidez potencial Componentes da acidez do solo (Fonte: Adaptado deRaij & Quaggio, 1984). o o Capacidade de Troca de Cátions (CTC) Os cátions retidos nos colóides do solo podem ser substituídos por outros cátions. Isto significa que eles são trocáveis. O cálcio pode ser trocado por hidrogênio e/ou potássio ou vice-versa. O número total de cátions trocáveis que um solo pode reter (a quantidade de sua carga negativa) é chamado de sua "capacidade de troca de cátions" ou CTC. Quanto maior o valor da CTC do solo, maior o número de cátions que ele pode reter. A CTC depende da quantidade e do tipo de argila e da matéria orgânica presentes. Por exemplo, um solo com alto teor de argila pode reter mais cátions trocáveis do que um solo com baixo teor de argila. A CTC também aumenta com o aumento no teor de matéria orgânica. De maneira geral os minerais de argila apresentam valores de CTC variando entre 10 e 150 cmolc/dm3 , matéria orgânica variando de 100 a 250 cmolc/dm3. Conseqüentemente, o tipo e a quantidade de argila e de matéria orgânica influenciam muito a CTC dos solos. CTC de alguns materiais Material CTC (cmolc/kg) Superfície Específica (m2/g) Tamanho (micra) Matéria orgânica* Vermiculita 100 - 250 100 - 150 - - Montmorilonita 80 - 120 800 0, 01 a 1,0 Ilita 30 - 50 100 0,1 a 2,0 Clorita 10 - 40 - - Glauconita 5 - 40 - - Haloisita 5 - 10 - - Caulinita 3 - 15 3 0,1 a 5,0 Óxidos de Fe e Al 2 -5 - - * Humificada (Fonte: Adaptado de Fassbender, 1980) Nas regiões tropicais, inclusive em grandes áreas no Brasil, onde os solos são mais intemperizados, predominando argilas de baixa atividade (tipo 1:1), como a caulinita e a haloisita; ou óxidos, hidróxidos ou oxihidróxidos de ferro e alumínio e teor baixo a médio de matéria orgânica, os níveis de CTC são baixos. Em regiões menos intemperizadas, onde ocorrem argilas de alta atividade (tipo 2:1), como montmorilonita, a vermiculita e a ilita, e os níveis de matéria orgânica são, usualmente, mais altos, valores da CTC podem ser, por natureza, bastante elevados. Solos com baixa CTC retêm somente pequenas quantidades de cátions, sendo, mais susceptíveis a perdas de nutrientes por lixiviação. Isto faz com que a época e as doses de fertilizantes a serem aplicadas sejam importantes ao se planejar um programa de adubação. A contribuição individual dos componentes do solo e diferentes minerais de argila, óxidos e matéria orgânica, na CTC é muito difícil de se determinar no entanto, é possível, determinar a contribuição da matéria orgânica e da fração mineral presente no solo. Capacidade de troca de cátions de solos típicos do Estado de São Paulo (CTC total e da mat éria orgânica) Tipo de solo Profundidade (cm) PVLs Pml Pln Pc PV TE LR LEa 0 -6 0 - 15 0 - 14 0 - 16 0 - 12 0 - 15 0 - 18 0 - 17 Argila (g/kg) Mat. Org. (g/kg) CTC Total CTC Mat. Org. CTC devido Mat.Org.(%) ...............( cmolc/dm3).............. 50 60 120 190 130 640 590 240 8 6 25 24 14 45 45 12 3,2 3,3 10,0 7,4 3,7 24,4 28,9 3,9 2,2 2,1 8,2 6,0 2,7 15,0 16,1 2,9 69 64 82 81 73 62 56 74 (Fonte: Adaptado deRaij, 1981) Observe que a matéria orgânica, apesar de ocorrer em teores bem mais baixos que a fração argila, foi a principal responsável pela CTC, contribuindo com 56 a 82% do total de cargas elétricas negativas. Esses dados ressaltam a importância de um manejo adequado da matéria orgânica, quando se tem por meta um balanço eficiente de cátions no solo. Relação de entre cátions trocáveis e pH 7,0 6,5 H 6,0 CTC a pH 7,0 5,5 pH atual do solo Al 3+ 5,0 CTC efetiva Ca 2+ Mg 2+ K+ Na + 4,5 SB O solo como reservatório de cátions. Fonte: Raij, 1981. ACIDEZ ATIVA • É mostrada na figura no valor atual do solo (pH 4,9). • É dada pela concentração de íons H+ que se encontram livres ou dissociados na solução do solo. • Para a maioria dos solos do Brasil, o índice pH varia de 4,0 a 7,5. ACIDEZ TROCÁVEL (cmolc/dm3, cmolc/L ou mmolc/dm3) • Refere-se ao alumínio (Al3+) que está adsorvido nas superfícies dos colóides minerais ou orgânicos, por forças eletrostáticas. • Nos boletins de análise, este tipo de acidez é representado por Al trocável. • A acidez trocável, também conhecida por Al trocável ou acidez nociva, apresenta efeito detrimental ao desenvolvimento normal de um grande número de culturas. • Portanto, quando um solo apresenta toxidez de alumínio, isto significa que ele apresenta altos índices de acidez trocável ou acidez nociva. ACIDEZ NÃO TROCÁVEL (cmolc/dm3, cmolc/L ou mmolc/dm3) • Esse tipo de acidez é representado por H+ em ligação covalente (mais difícil de ser rompida) com as frações orgânicas e minerais do solo. • O ponto relevante em relação a este tipo de acidez é que ela não é detrimental ao crescimento vegetal. • Outro ponto relevante é que a acidez não-trocável é uma estimativa das cargas negativas, passíveis de serem liberadas a pH 7,0, em decorrência da metodologia utilizada. É, portanto, um parâmetro que interage intimamente com a CTC do solo. H+ = (H+ + Al3+) - Al3+ SOMA DE BASES TROCÁVEIS (cmolc/dm3, cmolc/L ou mmolc/dm3) • Este parâmetro, como o próprio nome indica, reflete a soma de cálcio, magnésio, potássio e, se for o caso, também o sódio, todos na forma trocável, no complexo de troca de cátions do solo. • A soma de bases dá uma indicação do número de cargas negativas dos colóides que está ocupado por bases, no valor atual de pH ou a pH 7,0. S ou SB = Ca2+ + Mg2+ + K+ + (Na+) CTC efetiva • A CTC efetiva é representada pela soma dos cátions trocáveis, ou seja, pela soma de bases e alumínio trocável que estão adsorvidos no valor atual do solo. CTC efetiva = Al3+ + Ca2+ + Mg2+ + K+ Saturação por alumínio (%) • Representa o quanto das cargas negativas da CTC efetiva, estão ocupadas por alumínio. m= Al/ CTC efetiva X 100 CTC a pH 7,0 (cmolc/dm3, cmolc/L ou mmolc/dm3) • Esta CTC, também conhecida como capacidade de troca potencial do solo, é definida como a quantidade de cátions adsorvida a pH 7,0. • Sob o ponto de vista prático, é o nível da CTC de um solo que seria atingido, caso a calagem deste fosse feita para elevar o pH a 7,0; ou o máximo de cargas negativas liberadas a pH 7,0, passíveis de serem ocupadas por cátions. • A CTC a pH 7,0 é também simbolizada pela letra T. CTC a pH 7,0 = SB + (H+ + Al3+) Saturação por bases (%) • A saturação por bases representa a parte da CTC que é ocupada por cálcio, magnésio e potássio, ou seja, representa o quanto das cargas negativas do solo estão ocupadas por bases. No valor atual do solo ou a pH 7,0. V% = SB/CTC a pH 7,0 X 100 ou V% = SB/CTC efetiva X 100 UNIDADES USUAIS EM FERTILIDADE DO SOLO Em química e fertilidade do solo tem-se utilizado diferentes unidades para expressar os resultados analíticos obtidos com amostras de solo, planta, adubos e corretivos. Em 1960 foi aprovado em París o “Système International d’Unités (SI)”, que tem sido regulamentado por diversas entidades internacionais, com o propósito de uniformizar as unidades adotadas nos diversos ramos da ciência. O Brasil aderiu ao SI em 1980, o qual é, atualmente, reconhecido como oficial, sendo que a sua regulamentação compete ao Instituto Nacional de Peso e Medidas (INPM). Na Ciência do Solo, especificamente, o SI foi oficialmente adotado a partir de 1993, por ocasião da realização do XXIV Congresso Brasileiro de Ciência do Solo, em Goiânia. No SI as unidades agrupam-se em três categorias: as unidades de bases, as unidades derivadas e as unidades suplementares. Aquelas de maior interesse para a fertilidade do solo encontram-se nas duas primeiras categorias, sendo que as de uso mais freqüente são apresentadas no Quadro 1. As unidades derivadas são expressões algébricas das unidades de bases. O ajuste destas unidades às dimensões dos múltiplos e submúltiplos é feito adicionando-lhes prefixos. Os prefixos recomendados pelo SI de maior interesse para a fertilidade do solo são apresentados no Quadro 2. Além destas unidades são aceitas algumas outras, estranhas ao SI, por serem de uso consagrado. Aquelas relacionadas com as grandezas de interesse para a fertilidade do solo estão relacionadas no Quadro 3. mol é definido como: • a quantidade de matéria de um sistema que contem as mesmas unidades elementares, quantas forem os átomos contidos em 12 g do 12C - Corresponde a um mol qualquer quantidade de matéria que contenha 6,022 x 1023 (n° de Avogrado) entidades. Desse modo o mol é uma unidade de grandeza da quantidade de matéria do mesmo modo que o metro é uma unidade de grandeza do comprimento. Pode-se ter um mol de átomos, de moléculas, de íons, de prótons e de 5 elétrons, portanto, também, de cargas elétricas, ou de qualquer outra entidade. Deste modo a unidade mol deve ser acompanhada da entidade considerada. A massa de qualquer quantidade de matéria correspondente a um mol (6,022 x 1023 entidades) é denominada de massa molar (M). Tem-se, portanto a massa molar para moléculas - massa molecular - (p. ex. H2O = 18 g/mol), para elementos - massa atômica - (p. ex. K = 39 g/mol) e para íons (p. ex. OH- = 17 g/mol), para elétrons e outros. Concentração, as unidades foram divididas em duas situações: quando se conhece a composição química do composto ou seja sua massa molar e quando não se conhece. Concentração = mol do soluto/volume da solução A unidade de concentração é mol/dm3, sendo aceito o uso dos múltiplos ou de submúltiplos, como exemplos: damol/kg ou mmol/dm3. O volume da solução também pode ser expresso em L, mol/L; μmol/mL; etc. Ainda com respeito as unidades de concentração, não é mais recomendável o uso da percentagem (%), assim como, de parte por milhão (ppm) ou parte por bilhão (ppb). Em lugar de percentagem recomenda-se a utilização de unidades que mostrem a relação entre as grandezas envolvidas, como g/kg, mg/g e μg/g (relação de massa/massa) ou g/L (relação de massa/volume). Aceita-se, no entanto, o uso de percentagem para comparações fracionais bem definidas, isto é, quando se determina proporções, como nos casos saturação por alumínio, saturação de bases (V) etc... V % = SB/CTC x 100 Para a ordem de grandeza de ppm devem ser utilizadas as unidades mg/kg ou μg/g (para relações massa/massa) e mg/L, μg/mL, mg/dm3 (para relações massa/volume). Quando não se conhece a massa molar a concentração em massa expressa, a quantidade de massa por unidade de massa, ou, de volume e a unidade é g/kg ou g/dm3. A percentagem (%) é a unidade que tem sido utilizada tradicionalmente para teores totais, no entanto esta não é aceita pelo SI. Conforme demonstrado a seguir, um valor percentual expresso como unidades do SI (g/kg), tem seu valor numérico multiplicado por 10. % = g/100 g = 10 g/1.000 g = 10 g/kg ou 3 3 3 % = g/100 cm = g/ 0,1 dm = 10 g/dm Nas análises químicas para avaliação da fertilidade, atualmente são determinados os teores disponíveis de P e K. A unidade aceita pelo SI para expressar estes teores são: mg/kg, quando a amostra é medida em 3 peso de solo, ou mg/dm , quando a amostra é medida em volume de solo. 6 Observe que estas unidades guardam uma relação de 1/10 , portanto elas substituem diretamente a unidade ppm (parte por milhão) que tem sido tradicionalmente utilizada para expressar os teores disponíveis, mas não é aceita pelo SI. 3 5 ppm de P (peso/volume) = 5 mg/dm de P Os teores trocáveis de cátions, assim como a CTC do solo, têm sido expressos em termos de equivalente- grama e a unidade normalmente utilizada tem sido meq (milequivalente) por 100 g ou 100 cm3 de solo. As restrições impostas pelo SI ao uso do conceito de equivalente inviabilizou o uso destas unidades. No entanto, devido ao conceito de mol possibilitar expressar a quantidade de matéria em termos de cargas negativas ou positivas, os teores trocáveis, segundo o SI, devem ser expressos como molc (mol de carga) por kg ou dm3 de solo. Tomando-se os cátions Ca2+, K+ e Al3+ demonstra-se no quadro abaixo que os conceitos de equivalente e mol são diferentes, entretanto o de equivalente e mol de carga são iguais: Ex. Eq Ca = 40/2 № Eq em 1 mol de Ca = 40/20 = 2 Considerando a ordem de grandeza dos valores dos teores trocáveis as unidades utilizadas segundo o SI, são: Quando utiliza-se a unidade mmolc o valor em equivalente miligrama (meq), tradicionalmente utilizado fica multiplicado por 10, enquanto que utilizando-se cmolc este valor não se altera. se: Eq-grama = molc, então meq = mmolc 3 3 1 meq/ 100 cm (unidade tradicional) = 1 mmolc/100 dcm 3 3 = 10 mmolc/1.000 cm = 10 mmolc/dm = 1 cmolc/dm 3 Exercícios 1. O teor de N total de um solo está expresso como 0,3 %. Qual é a unidade correspondente no SI e qual o valor em mg/kg. 2. Com freqüência encontram-se teores de K disponível expresso em ppm. Assim, expresse o teor de 117 ppm (peso/volume) de K em unidade equivalente do SI e também em cmolc /dm3. 3. Demonstrar que 0,43 meq de K /100cm3 = 4,3 mmolc de K/dm3 e que consequentemente o fator de conversão é 10. 4. Demonstrar que 0,3 meq de K/100cm3 = 0,3 cmolc de K/dm3 e que consequentemente o fator de conversão é 1.
Download