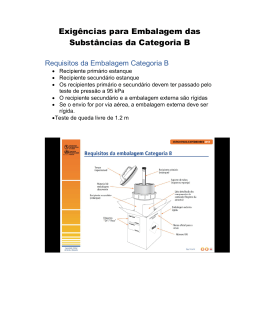
CAPÍTULO 2.6 CLASSE 6 - SUBSTÂNCIAS TÓXICAS E SUBSTÂNCIAS INFECTANTES Notas Introdutórias Nota 1: Organismos e microorganismos geneticamente modificados que não se enquadrem na definição de substância infectante devem ser considerados para classificação na Classe 9 e alocação no Nº ONU 3245. Nota 2: Toxinas de origem vegetal, animal ou bacteriana que não contenham substâncias infectantes, ou toxinas contidas em substâncias não-infectantes devem ser consideradas para classificação na Subclasse 6.1 e alocação no Nº ONU 3172. 2.6.1 Definições A Classe 6 é dividida nas duas subclasses seguintes: a) Subclasse 6.1 - Substâncias tóxicas São substâncias capazes de provocar morte, lesões graves ou danos à saúde humana, se ingeridas ou inaladas, ou se entrarem em contato com a pele. b) Subclasse 6.2 - Substâncias infectantes São substâncias que contenham patógenos ou estejam sob suspeita razoável de tal. Patógenos são microorganismos (incluindo bactérias, vírus, rickéttsias, parasitas, fungos) ou microorganismos recombinantes (híbridos ou mutantes) que possam — ou estejam sob suspeita razoável de poderem — provocar doenças infecciosas em seres humanos ou em animais. 2.6.2 Subclasse 6.1 - Substâncias tóxicas 2.6.2.1 Definições Para fins deste Regulamento: 2.6.2.1.1 DL50 para toxicidade oral aguda é a dose de substância ministrada oralmente que tenha a maior probabilidade de causar, num prazo de quatorze dias, a morte da metade de um grupo de ratos albinos adultos jovens, tanto machos quanto fêmeas. O número de animais testados deve ser suficiente para fornecer resultado estatisticamente significativo e estar de acordo com a boa prática farmacológica. O resultado é expresso em miligramas por quilograma de massa corporal. 83 2.6.2.1.2 DL50 para toxicidade dérmica aguda é a dose de substância que, ministrada por contato contínuo com a pele nua de coelhos albinos, por vinte e quatro horas, tenha a maior probabilidade de causar, num prazo de quatorze dias, a morte de metade dos animais testados. O número de animais testados deve ser suficiente para fornecer resultado estatisticamente significativo e estar de acordo com a boa prática farmacológica. O resultado é expresso em miligramas por quilograma de massa corporal. 2.6.2.1.3 CL50 para toxicidade aguda por inalação é a concentração de vapor, neblina ou pó que, ministrada por inalação contínua, durante uma hora, a ratos albinos adultos jovens, machos e fêmeas, tenha a maior probabilidade de provocar, num prazo de quatorze dias, a morte de metade dos animais testados. Uma substância sólida deve ser testada se no mínimo 10% (em massa) de sua massa total tiver probabilidade de ser pó respirável, ou seja, o diâmetro aerodinâmico da fração particulada for de 10 micra ou menos. Uma substância líquida deve ser testada se houver probabilidade de geração de neblina em caso de vazamento da embalagem de transporte. As amostras de substâncias sólidas ou líquidas preparadas para ensaio de toxicidade por inalação devem ter mais de 90% da massa na faixa respirável, conforme definido acima. O resultado é expresso em miligramas por litro de ar para pós e neblinas, ou em mililitros por metro cúbico de ar (partes por milhão) para vapores. 2.6.2.2 Alocação a grupos de embalagem 2.6.2.2.1 Os produtos da Subclasse 6.1, pesticidas inclusive, são alocados a um dos três seguintes grupos de embalagem, conforme o seu nível de risco durante o transporte: a) Grupo de Embalagem I: substâncias e preparações que apresentem risco de toxicidade muito elevado; b) Grupo de Embalagem II: substâncias e preparações que apresentem sério risco de toxicidade; c) Grupo de Embalagem III: substâncias e preparações que apresentem risco de toxicidade relativamente baixo. 2.6.2.2.2 Na classificação de um produto, devem ser levadas em conta a experiência humana em casos de envenenamento acidental, bem como quaisquer propriedades especiais de um produto, tais como estado líquido, alta volatilidade, probabilidade especial de penetração e efeitos biológicos especiais. 2.6.2.2.3 Na ausência de experiência humana, a classificação deve ser baseada em dados obtidos em experimentos com animais. Devem ser examinadas três possíveis vias de administração das substâncias tóxicas. Essas vias são exposição por meio de: a) Ingestão oral; b) Contato dérmico; e c) Inalação de pós, neblinas ou vapores. 2.6.2.2.3.1 Experimentos com animais, apropriados para as diversas vias de administração, são descritos em 2.6.2.1. Quando uma substância exibir níveis diferentes 84 de toxicidade em duas ou mais dessas vias de administração, deve ser-lhe atribuído o maior nível de risco indicado pelos experimentos. 2.6.2.2.4 Os critérios de classificação de uma substância de acordo com a toxidade que apresenta em cada uma das vias de administração são apresentados nos parágrafos a seguir. 2.6.2.2.4.1 Os critérios de classificação relativos às vias oral e dérmica, bem como à inalação de pós e neblinas, são apresentados no quadro seguinte. CRITÉRIOS DE CLASSIFICAÇÃO POR INGESTÃO ORAL, CONTATO DÉRMICO E INALAÇÃO DE PÓS E NEBLINAS Grupo de embalagem Toxicidade oral DL50 (mg/kg) Toxicidade dérmica DL50 (mg/kg) Toxicidade por inalação de pós e neblinas CL50 (mg/litro) I ≤ 5 ≤ 40 ≤ 0,5 II > 5 - 50 > 40 - 200 > 0,5 - 2 > 200 - 1000 > 2 - 10 III (a) Sólidos: > 50 - 200 Líquidos: > 50 - 500 (a) Substâncias lacrimogêneas gasosas devem ser incluídas no Grupo de Embalagem II, mesmo que seus dados toxicológicos correspondam a valores do Grupo de Embalagem III. Nota: Substâncias que se enquadrem nos critérios da Classe 8 e que apresentem toxicidade à inalação de pós e neblinas (CL50) correspondente ao Grupo de Embalagem I só devem ser aceitas para alocação à Subclasse 6.1 se a toxicidade à ingestão oral ou ao contato dérmico situar-se, pelo menos, na faixa dos Grupos de Embalagem I ou II. Caso contrário, deve-se alocar à Classe 8, se apropriado (ver nota de rodapé 1, no Capítulo 2.8). 2.6.2.2.4.2 Os critérios de determinação da toxicidade por inalação de pós e neblinas, constantes em 2.6.2.2.4.1, baseiam-se em dados de CL50 relativos a uma hora de exposição, e tal informação deve ser usada quando disponível. Entretanto, quando só se dispuser de dados relativos a quatro horas de exposição a pós e neblinas, tais valores podem ser multiplicados por quatro, substituindo-se os dados do quadro pelo produto obtido, ou seja, CL50 (4 horas) x 4 é considerada equivalente a CL50 (1 hora). 2.6.2.2.4.3 Líquidos que desprendam vapores tóxicos devem ser classificados num dos grupos seguintes; onde“V” é a concentração de vapor saturado, em mililitros por metro cúbico de ar, a 20°C e à pressão atmosférica normal: a) Grupo de Embalagem I: se V ≥ 10 CL50 e CL50 ≤ 1.000ml/m3; b) Grupo de Embalagem II: se V ≥ CL50 e CL50 ≤ 3.000ml/m3 e não forem atendidos os critérios do Grupo de Embalagem I; 85 c) Grupo de Embalagem III( * ): se V ≥ 1/5 CL50 e CL50 ≤ 5.000ml/m3 e não forem atendidos os critérios dos Grupos de Embalagem I e II. 2.6.2.2.4.4 A Figura 2.3 apresenta, sob a forma de gráfico, os critérios descritos em 2.6.2.2.4.3, para facilitar a classificação. Entretanto, em razão das aproximações inerentes ao uso de gráficos, substâncias situadas nos limites ou perto dos limites de um grupo de embalagem devem ser verificadas pelos critérios numéricos. 2.6.2.2.4.5 Os critérios de determinação de toxicidade por inalação de vapores, constantes em 2.6.2.2.4.3, baseiam-se em dados de CL50 relativos a uma hora de exposição e, sempre que disponível, tal informação deve ser utilizada. Entretanto, quando essa informação não estiver disponível, podem-se substituir os valores indicados no critério acima pelos valores relativos a quatro horas de exposição multiplicados por dois; ou seja, CL50 (4 horas) x 2 é considerada equivalente a CL50 (1 horas). 2.6.2.2.4.6 Misturas de líquidos que são tóxicos à inalação devem ser alocadas a um grupo de embalagem de acordo com 2.6.2.2.4.7 ou 2.6.2.2.4.8. 2.6.2.2.4.7 Se forem disponíveis os dados de CL50 de cada substância tóxica componente de uma mistura, o grupo de embalagem pode ser determinado da seguinte maneira: a) Estimar a CL50 da mistura pela aplicação da fórmula: CL50 i (mistura) = 1 n fi Σ i=1 CL50 i onde: fi = fração molar do componente i do líquido; CL50 i = concentração letal média do componente i em ml/m3; b) Estimar a volatilidade de cada substância componente pela fórmula: Pi x 10 6 Vi = ml/m3 101,3 onde: Pi = pressão parcial da substância componente i em kPa, a 20ºC e 1atm; c) Determinar a razão volatilidade/CL50 pela fórmula: R = n Vi Σ ; i= 1 CL50i (*) Gases lacrimogêneos são incluídos no Grupo de Embalagem II mesmo que seus dados toxicológicos correspondam a valores do Grupo de Embalagem III. 86 d) Com os valores calculados de CL50 (mistura) e R, o grupo de embalagem da mistura é determinado como se segue: Grupo de Embalagem I: R ≥ 10 e CL50 (mistura) ≤ 1.000ml /m3; Grupo de Embalagem II: R ≥ 1 e CL50 (mistura) ≤ 3.000ml /m3 e não forem atendidos os critérios do Grupo de Embalagem I; (iii) Grupo de Embalagem III: R ≥ 1/5 e CL50 (mistura) ≤ 5.000ml/m3 e não forem atendidos os critérios dos Grupos de Embalagem I ou II. (i) (ii) 87 FIGURA 2.3 88 2.6.2.2.4.8 Na ausência de informações referentes às CL50 das substâncias tóxicas componentes, pode-se atribuir à mistura um grupo de embalagem com base nos seguintes ensaios simplificados de determinação dos limites e de toxicidade. Quando empregados tais ensaios, o grupo de embalagem mais restritivo deve ser utilizado no transporte da mistura. a) Deve-se alocar determinada mistura ao Grupo de Embalagem I somente se atender aos dois critérios a seguir: (i) (ii) b) Deve-se alocar uma mistura ao Grupo de Embalagem II somente se ela atender aos dois critérios a seguir, mas não atender aos critérios do Grupo de Embalagem I: (i) (ii) c) Vaporizar uma amostra da mistura líquida e diluí-la em ar para criar uma atmosfera de ensaio de 1.000ml/m3 de mistura vaporizada em ar. Expor dez ratos albinos (cinco machos e cinco fêmeas) à atmosfera de ensaio por uma hora e observálos por quatorze dias. Se cinco ou mais animais morrerem no período de observação, presume-se que a CL50 da mistura seja igual ou inferior a 1.000ml/m3; Diluir uma amostra do vapor em equilíbrio com a mistura líquida, a 20ºC, em nove volumes iguais de ar, formando a atmosfera de ensaio. Expor dez ratos albinos (cinco machos e cinco fêmeas) à atmosfera de ensaio por uma hora e observálos por quatorze dias. Se cinco ou mais animais morrerem no período de observação, presume-se que a mistura apresente uma volatilidade igual ou superior a dez vezes a CL50 da mistura; Vaporizar uma amostra da mistura líquida e diluí-la em ar para criar uma atmosfera de ensaio de 3.000ml/m3 de mistura vaporizada em ar. Expor dez ratos albinos (cinco machos e cinco fêmeas) à atmosfera de ensaio por uma hora e observálos por quatorze dias. Se cinco ou mais animais morrerem no período de observação, presume-se que a CL50 da mistura seja igual ou inferior a 3.000ml/m3; Uma amostra do vapor em equilíbrio com a mistura líquida, a 20ºC, é utilizada para formar uma atmosfera de ensaio. Expor dez ratos albinos (cinco machos e cinco fêmeas) à atmosfera de ensaio por uma hora e observá-los por quatorze dias. Se cinco ou mais animais morrerem no período de observação, presume-se que a volatilidade da mistura seja igual ou superior à CL50 da mistura; Deve-se alocar uma mistura ao Grupo de Embalagem III somente se ela atender aos dois critérios a seguir, mas não atender aos critérios dos Grupos de Embalagem I e II: (i) Vaporizar uma amostra da mistura líquida e diluí-la em ar para criar uma atmosfera de ensaio de 5.000ml/m3 de mistura vaporizada em ar. Expor dez ratos albinos (cinco machos e cinco fêmeas) à atmosfera de ensaio por uma hora e observálos por quatorze dias. Se cinco ou mais animais morrerem no 89 (ii) 2.6.2.3 período de observação, presume-se que a CL50 da mistura seja igual ou inferior a 5.000ml/m3; Medir a pressão de vapor da mistura líquida; se a concentração de vapor for igual ou maior que 1.000ml/m3, presume-se que a volatilidade da mistura seja igual ou superior a um quinto da CL50 da mistura. Métodos de determinação da toxicidade oral e dérmica de misturas 2.6.2.3.1 Na determinação do grupo de embalagem apropriado a misturas da Subclasse 6.1 de acordo com os critérios de toxicidade oral e dérmica de 2.6.2.2, é necessário determinar a DL50 aguda da mistura. 2.6.2.3.2 Se uma mistura contiver apenas uma substância ativa, e a DL50 daquele componente for conhecida, na ausência de dados confiáveis sobre a toxicidade oral e dérmica aguda da mistura a ser transportada, a DL50 oral ou dérmica pode ser obtida pelo seguinte método: Valor da DL50 da substância ativa X 100 Valor da DL50 da preparação = %, em massa, de substância ativa 2.6.2.3.3 Se uma mistura contiver mais de um componente ativo, há três maneiras possíveis de determinar a DL50 oral ou dérmica da mistura. O método preferível é a obtenção de dados confiáveis sobre a toxicidade oral e dérmica aguda da própria mistura a ser transportada. Não havendo dados confiáveis, pode-se usar um dos dois métodos seguintes: a) Classificar a formulação de acordo com o componente de maior risco, como se esse componente estivesse presente na mesma concentração que a concentração total de todos os componentes ativos; ou b) Aplicar a fórmula: CA TA + CB TB + .... + Cz = Tz 100 TM onde: C = concentração, em %, dos componentes A, B, ... Z, na mistura; T = valores da DL50 oral dos componentes A, B, ..., Z; TM = valor da DL50 oral da mistura. Nota: Esta fórmula pode ser usada também para toxicidades dérmicas, desde que tal informação esteja disponível em relação às mesmas espécies para todos os componentes. O uso desta fórmula não leva em consideração nenhum fenômeno de proteção ou potenciação. 2.6.2.4 Classificação de pesticidas 2.6.2.4.1 Todas as substâncias pesticidas ativas e suas preparações cujos valores de DL50 e/ou CL50 sejam conhecidos e que pertençam à Subclasse 6.1, devem ser 90 classificadas no grupo de embalagem apropriado segundo os critérios descritos em 2.6.2.2. Substâncias e preparações que apresentem riscos subsidiários devem ser classificadas de acordo com o quadro de precedência de risco do Capítulo 2.0 e alocadas aos grupos de embalagem apropriados. 2.6.2.4.2 Se o valor da DL50 oral ou dérmica de uma preparação pesticida não for conhecido, mas conheça-se o valor da DL50 de sua(s) substância(s) ativa(s), o valor da DL50 da preparação pode ser obtido mediante os procedimentos estabelecidos em 2.6.2.3. Nota: Dados relativos à toxicidade DL50 de certo número de pesticidas comuns podem ser obtidos na edição mais recente do documento “The WHO Recommended Classification of Pesticides by Hazard and Guidelines to Classification”, disponível no Programa Internacional de Segurança Química, Organização Mundial de Saúde (OMS), 1211 Genebra, 27, Suíça. Embora tal documento possa ser usado como fonte de dados sobre a DL50 de pesticidas, seu sistema da classificação não deve ser empregado na classificação para fins de transporte, nem na determinação de grupos de embalagem a pesticidas, o que deve ser feito de acordo com o que dispõe este Regulamento. 2.6.2.4.3 O nome de apropriado para embarque a ser usado no transporte do pesticida deve ser selecionado com base no ingrediente ativo, no estado físico do pesticida e em quaisquer riscos subsidiários que apresente. 2.6.3 Subclasse 6.2 - Substâncias infectantes 2.6.3.1 Definições Para os fins deste Regulamento: Substâncias infectantes são substâncias que contenham patógenos ou 2.6.3.1.1 estejam sob suspeita razoável de tal. Patógenos são microorganismos (incluindo bactérias, vírus, rickéttsias, parasitas, fungos) ou microorganismos recombinantes (híbridos ou mutantes) que possam — ou estejam sob suspeita razoável de poderem — provocar doenças infecciosas em seres humanos ou em animais. Nota 1: Esses microorganismos, entretanto, não estão sujeitos às exigências desta Subclasse se for improvável que venham a causar doenças em pessoas ou animais. Nota 2: Substâncias infectantes estarão sujeitas às exigências desta Subclasse se, mediante exposição a elas, forem capazes de disseminar doença. 2.6.3.1.2 Produtos biológicos são aqueles derivados de organismos vivos, fabricados e distribuídos de acordo com exigências das autoridades governamentais nacionais, as quais podem exigir licenciamento especial, e que são usados para prevenção, tratamento ou diagnose de doenças humanas ou animais, ou, ainda, para fins de desenvolvimento, experimentação ou investigação. Eles incluem, mas não se limitam a produtos acabados ou não-acabados, tais como vacinas e produtos diagnósticos. Para os fins deste Regulamento, os produtos biológicos dividem-se nos seguintes grupos: 91 a) Os que contêm patógenos do grupo de risco 1; os que contêm patógenos em condições tais que sua capacidade de provocar doenças é muito pequena ou inexistente; e aqueles que sabidamente não contêm patógenos. Substâncias desse grupo são consideradas não-infectantes para os fins deste Regulamento; b) Os manufaturados e embalados de acordo com as exigências das autoridades nacionais governamentais de saúde(1) e transportados para fins de embalagem ou distribuição final e para uso por profissionais médicos ou por indivíduos, em tratamentos de saúde. Substâncias deste grupo não estão sujeitas à regulamentação aplicável à Subclasse 6.2; c) Os que contenham, ou haja razões para se esperar que contenham, patógenos dos grupos de risco 2, 3 ou 4 e que não se enquadrem nos critérios de 2.6.3.1.2(b) acima. Substâncias desse grupo devem ser classificadas na Subclasse 6.2 sob o número ONU 2814 ou o número ONU 2900, conforme o caso. Nota: Alguns produtos biológicos licenciados podem apresentar risco biológico apenas em certas partes do mundo. Nesse caso, as autoridades competentes podem exigir que tais produtos atendam às exigências relativas a substâncias infectantes ou podem impor outras restrições. 2.6.3.1.3 Espécimes para diagnóstico são quaisquer materiais de origem humana ou animal, incluindo (mas não se limitando a) dejetos, secreções, sangue e seus componentes, tecidos ou fluídos expedidos para fins de diagnóstico, mas excluindo animais vivos infectados. Para os fins deste Regulamento, as espécimes para diagnóstico são divididas nos seguintes grupos: a) Os que contenham, ou haja expectativa razoável de que contenham, patógenos dos grupos de risco 2, 3 ou 4, e aqueles que apresentem probabilidade relativamente baixa de conterem patógenos do grupo de risco 4. Essas substâncias devem ser enquadradas na Subclasse 6.2 sob o número ONU 2814 ou 2900, conforme o caso. Espécimes transportadas para fins de teste inicial ou confirmatório quanto à presença de patógenos recaem neste grupo; b) Aqueles que apresentem probabilidade relativamente baixa de conter patógenos dos grupos de risco 2 ou 3. Espécimes transportadas para fins de diagnose inicial (que não incluam detecção de patógenos) ou para testes de rotina são enquadrados neste grupo; c) Os que sabidamente não contenham patógenos. 2.6.3.1.4 Microorganismos e organismos geneticamente modificados são microorganismos e organismos cujo material genético tenha sido deliberadamente (1) Ministério da Saúde 92 modificado, por meio de engenharia genética, de uma forma que não ocorra naturalmente. Eles são divididos nas seguintes categorias: a) Microorganismos geneticamente modificados que se enquadrem na definição de substância infectante devem ser classificados na Subclasse 6.2 e transportados sob o número ONU 2814 ou 2900; b) Organismos geneticamente modificados que se saiba ou se suspeite serem perigosos para pessoas, animais ou meio ambiente, devem ser transportados de acordo com o que dispuserem as autoridades competentes(1); c) Animais que contenham microorganismos geneticamente modificados ou estejam por eles contaminados e organismos que se enquadrem na definição de substância infectante devem ser transportados de acordo com as exigências estabelecidas pelas autoridades competentes(1); d) Microorganismos geneticamente modificados (à exceção dos autorizados para uso incondicional pelos Governos dos países de origem, trânsito e destino) que não se enquadrem na definição de substância infectante, mas que sejam capazes de provocar alterações que normalmente não seriam resultantes de reprodução natural em animais, plantas ou substâncias microbiológicas, devem ser incluídos na Classe 9 e receber o número ONU 3245. 2.6.3.1.5 Resíduos (transportados sob o número ONU 3291) são resíduos resultantes de tratamento médico de pessoas ou animais, ou de pesquisas biológicas, em que seja relativamente baixa a probabilidade de haver substâncias infectantes. Resíduos de substâncias infectantes que possam ser especificadas devem ser alocados ao número ONU 2814 ou 2900. Resíduos que tenham contido substâncias infectantes, mas que tenham sido descontaminados, devem ser considerados não-perigosos, desde que não se enquadrem nos critérios de outra classe. 2.6.3.2 Classificação de substâncias infectantes e alocação a grupos de risco 2.6.3.2.1 Substâncias infectantes devem ser classificadas na Subclasse 6.2 e alocadas, conforme o caso, ao número ONU 2814 ou ONU 2900, com base em seu enquadramento em um dos três grupos de risco a seguir, de acordo com os critérios desenvolvidos pela Organização Mundial de Saúde (OMS) e publicados no “Manual de Biossegurança Laboratorial”, 2ª edição (1993) pela OMS. Um grupo de risco é caracterizado pela patogenia do organismo, o modo e a relativa facilidade de transmissão, o nível de risco, tanto para um indivíduo quanto para uma comunidade, e a reversibilidade da doença pela disponibilidade de tratamentos e agentes preventivos conhecidos e eficazes. 2.6.3.2.2 (1) Os critérios de cada grupo, conforme o nível de risco são: Ministério da Saúde/ Ministério da Agricultura 93 a) Grupo de Risco 4: um patógeno que costuma provocar grave doença grave em pessoas ou animais, de fácil transmissão (direta ou indiretamente) de um indivíduo para outro, e para o qual, em geral, não se dispõe de tratamento ou profilaxia eficazes (ou seja, alto risco para indivíduos e para comunidades); b) Grupo de Risco 3: um patógeno que costuma provocar grave doença grave em pessoas ou animais, mas que em geral não se transmite de um indivíduo infectado para outro, e para o qual se dispõe de tratamento e profilaxia eficazes (ou seja, alto risco para indivíduos e baixo risco para comunidades); c) Grupo de Risco 2: um patógeno que pode provocar doença em pessoas ou animais, mas provavelmente não representa grave risco, e que, embora capaz de causar infecção séria mediante exposição, há disponibilidade de tratamento e profilaxia eficazes e apresenta risco limitado de disseminação da infecção (ou seja, risco moderado para indivíduos e baixo risco para comunidades). Nota: O Grupo de Risco 1 inclui microorganismos que muito provavelmente não provocam doenças em pessoas ou animais (ou seja, não apresentam risco, ou este é muito baixo, para indivíduos ou para a comunidade). Substâncias que contenham apenas tais microorganismos não são consideradas substâncias infectantes para os fins deste Regulamento. 2.6.3.3 Produtos biológicos, espécimes para diagnóstico e resíduos clínicos ou (bio)médicos 2.6.3.3.1 Produtos biológicos que contenham, ou se considere provável que contenham, quaisquer substâncias infectantes devem cumprir as exigências aplicáveis a substâncias infectantes. Os produtos biológicos referidos em 2.6.3.1.2 (a) e (b) não estão sujeitos às exigências aplicáveis à Subclasse 6.2. 2.6.3.3.2 Espécimes para diagnóstico que contenham, ou se considere provável que contenham, substâncias infectantes devem cumprir as exigências deste Regulamento aplicáveis a substâncias infectantes. As espécimes para diagnóstico referidas em 2.6.3.1.3(b) não estarão sujeitas às exigências aplicáveis a substâncias infectantes se atenderem às seguintes condições: a) O(s) recipiente(s) primário(s) não contiver(em) mais de 100ml; b) A embalagem externa não contiver mais de 500ml; c) O(s) recipiente(s) primário(s) for(em) estanques(s); e d) A embalagem incluir: (i) uma embalagem interna, compreendendo: • • recipiente(s) primário(s) estanque(s); uma embalagem secundária estanque; 94 • (ii) material absorvente em quantidade suficiente para absorver todo o conteúdo, colocado entre o(s) recipiente(s) primário(s) e a embalagem secundária; se uma embalagem secundária contiver mais de um recipiente primário, estes devem ser embrulhados um a um, de forma a evitar contato entre eles. uma embalagem externa com resistência adequada a sua capacidade, massa e uso pretendido, com dimensão externa mínima de 100mm. 2.6.3.3.3 Resíduos clínicos ou (bio)médicos devem atender a todas as exigências aplicáveis ao número ONU a que tenham sido alocados. 95 96
Download