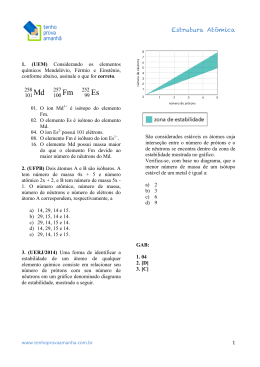
www.professormazzei.com - ATOMÍSTICA – Folha 04 – João Roberto Mazzei Questão 01 Rutherford idealizou um modelo atômico com duas regiões distintas. Esse modelo pode ser comparado a um estádio de futebol com a bola no centro: a proporção entre o tamanho do estádio em relação à bola é comparável ao tamanho do átomo em relação ao núcleo (figura). Acerca do modelo idealizado por Rutherford e considerando os conhecimentos sobre o átomo, é correto afirmar: a) Os prótons e os nêutrons são encontrados na eletrosfera. b) Os elétrons possuem massa muito grande em relação à massa dos prótons. c) O núcleo atômico é muito denso e possui partículas de carga positiva. d) A eletrosfera é uma região onde são encontradas partículas de carga positiva. e) O núcleo atômico é pouco denso e possui partículas de carga negativa. Questão 02 Os núcleos dos átomos são constituídos de prótons e nêutrons, sendo ambos os principais responsáveis pela sua massa. Nota-se que, na maioria dos núcleos, essas partículas não estão presentes na mesma proporção. O gráfico mostra a quantidade de nêutrons (N) em função da quantidade de prótons (Z) para os núcleos estáveis conhecidos. www.professormazzei.com - ATOMÍSTICA – Folha 04 – João Roberto Mazzei O antimônio é um elemento químico que possui 50 prótons e possui vários isótopos ― átomos que só se diferem pelo número de nêutrons. De acordo com o gráfico, os isótopos estáveis do antimônio possuem a) entre 12 e 24 nêutrons a menos que o número de prótons. b) exatamente o mesmo número de prótons e nêutrons. c) entre 0 e 12 nêutrons a mais que o número de prótons. d) entre 12 e 24 nêutrons a mais que o número de prótons. e) entre 0 e 12 nêutrons a menos que o número de prótons. Questão 03 Considere um átomo, cujo número atômico é igual a 11, que forma cátion, ao participar de reações químicas e que apresenta 12 nêutrons. Seus números de elétrons, prótons e de massa são, respectivamente, a) 11, 11 p e 23. b) 10, 11 p e 22. c) 10, 10 p e 23. d) 10, 11 p e 23. e) 10, 12 p e 24. www.professormazzei.com - ATOMÍSTICA – Folha 04 – João Roberto Mazzei Questão 04 O elemento químico B possui 20 nêutrons, é isótopo do elemento químico A, que possui x prótons, e isóbaro do elemento químico C, que tem 16 nêutrons. O número de massa de C é 2x+2. Sabendo-se que A e C são isótonos, pode-se afirmar que o somatório do número de massa, do número atômico e de número de nêutrons dos elementos, respectivamente, está relacionado na alternativa: a) 109, 56 e 53. b) 110, 58 e 52. c) 112, 54 e 48. d) 118, 62 e 56. e) 116, 58 e 54. Questão 05 Considere as espécies químicas monoatômicas indicadas na tabela abaixo. Espécie química monoatômica Prótons Nêutrons elétrons I 12 12 12 II 12 13 10 III 20 20 20 IV 20 21 20 V 17 18 18 Em relação às espécies químicas monoatômicas apresentadas na tabela, pode-se afirmar que: a) III e IV são de mesmo elemento químico. b) V é cátion. c) III é ânion. d) II é eletricamente neutro. e) I e II não são isótopos. Questão 06 O íon X3 possui 30 nêutrons e número de massa igual a 54. A quantidade de elétrons que essa espécie possui é a) 21. b) 24. www.professormazzei.com - ATOMÍSTICA – Folha 04 – João Roberto Mazzei c) 27. d) 84. e) 96 Questão 07 + -3 +3 Os íons F , Li , N e Al são provenientes dos respectivos átomos neutros. A partir dos dados a seguir, indique as espécies que apresentam a maior relação entre o número de nêutrons e o de elétrons 19 7 14 27 (Dados: 9F 3Li 7N 13Al ) - + a) F e Li b) Li e N + -3 -3 +3 c) N e Al - d) F e N +3 e) Al -3 e Li + Questão 08 A partir do século XIX, a concepção da ideia de átomo passou a ser analisada sob uma nova perspectiva: a experimentação. Com base nos dados experimentais disponíveis, os cientistas faziam proposições a respeito da estrutura atômica. Cada nova teoria atômica tornava mais clara a compreensão da estrutura do átomo. Assinale, no quadro a seguir, a alternativa que apresenta a correta associação entre o nome do cientista, a fundamentação de sua proposição e a estrutura atômica que propôs. a) b) Cientista Fundamentação Estrutura atômica John Dalton Experimentos com raios catódicos que foram interpretados como um feixe de partículas carregadas negativamente denominadas elétrons, os quais deviam fazer parte de todos os átomos. O átomo deve ser um fluído homogêneo e quase esférico, com carga positiva, no qual estão dispersos uniformemente os elétrons. Niels Bohr Leis ponderais que relacionavam entre si as massas de substâncias participantes de reações. Os elétrons movimentam-se em torno do núcleo central positivo em órbitas específicas com níveis energéticos bem definidos. Experimentos envolvendo o fenômeno da radioatividade. O átomo é constituído por um núcleo central positivo, muito pequeno em relação ao tamanho total do átomo, porém com grande massa, ao redor do qual orbitam os elétrons com carga negativa. c) Ernest Rutherford d) Joseph Thomson Princípios da teoria da mecânica quântica. A matéria é descontínua e formada por minúsculas partículas indivisíveis denominadas átomos. e) Demócrito Experimentos sobre condução de Os átomos são as unidades elementares da matéria e comportam-se como se www.professormazzei.com - ATOMÍSTICA – Folha 04 – João Roberto Mazzei corrente elétrica em meio aquoso. GABARITO: 01. [C] 02. [D] 03. [D] 04. [B] 05. [A] 06. [A] 07. [E] 08. [C] fossem esferas maciças, indivisíveis e sem cargas.
Download