Modelo quântico – distribuição electrónica Princípio da energia mínima: Os electrões distribuem-se pelas várias orbitais por forma a que resulte para o átomo um estado de energia mínima (máxima estabilidade) e que se designa por estado fundamental. 1H Princípio de exclusão de Pauli: Não podem coexistir dois electrões na mesma orbital com o mesmo número quântico de spin. Como só há dois valores para o número quântico de spin, isto implica que cada orbital só pode comportar no máximo dois electrões, que terão de ter spins opostos. Os electrões com spins opostos representam-se por setas de sentidos opostos (↑↓ ↑↓). ↑↓ 2He Regra de Hund: No preenchimento de orbitais com igual energia, distribui-se primeiro um electrão por cada orbital, de modo a ficarem com o mesmo spin, e só depois se completam, ficando com spins opostos. 7N Modelo quântico – distribuição electrónica Número de electrões na orbital Designação da orbital Designação dos electrões 0 Orbital vazia ---------- 1 Orbital semipreenchida desemparelhados 2 Orbital completa ou totalmente preenchida emparelhados Diagrama de Linus Pauling Com base nos princípios e regras enunciados, o químico Linus Pauling elaborou um diagrama de preenchimento das orbitais, que facilita a escrita das configurações electrónicas dos átomos polielectrónicos. Exemplos: 11Na 17Cl 19K – 1s2 2s2 2p6 3s1 – 1s2 2s2 2p6 3s2 3p5 – 1s2 2s2 2p6 3s2 3p6 4s1 Modelo quântico – distribuição electrónica Os electrões que ocupam a ultima camada/nível são designados por electrões de valência Ao conjunto do núcleo com os electrões mais internos chama-se cerne. Pode simplificar-se a configuração electrónica de um átomo: basta representar os electrões mais interiores do átomo pela configuração electrónica do gás nobre do período anterior da Tabela Periódica, seguida dos electrões de valência. Exemplos: 11Na – [Ne] 3s1 19K – [Ar] 4s1
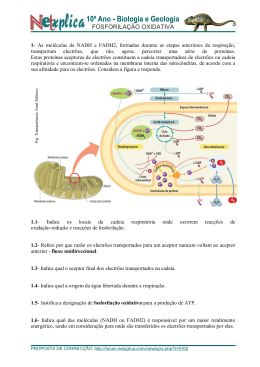
Download