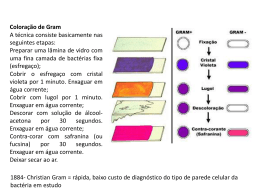
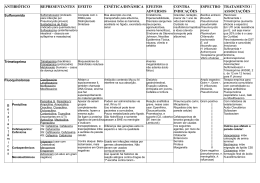
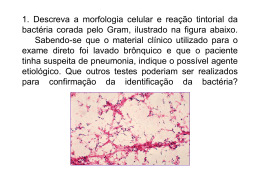
Haemophilus Corynebacterium Mycobacterium Haemophilus spp. Bacilos Gram negativos pleomórficos oxidase positivos Família Pasteurellaceae • Principais espécies de importância clínica: – H. influenzae – H. parainfluenzae – H. ducreyi Características • • • • • “Amantes do sangue” Bacilos Gram negativos pleomórficos (Cocobacilos) Oxidase positivo Anaeróbios facultativos Crescimento ótimo: – 5 a 7% de CO2 – 35-37º C – 24 a 48 horas (H. ducreyi – 7 dias) • Requerimento nutricional fastidioso – Formação de colônias satélites Infecções em Humanos • Menos complicadas – Conjuntivite – Sinusite – Otite média • Invasivas – Pneumonia – Meningite • H. influenzae tipo b (2 meses a 3 anos de idade) – Cancro mole ou cancróide • H. ducreyi (úlceras perigenitais e perianais) Fatores de Virulência • Polissacarídeo capsular – 6 sorotipos (a, b, c, d, e, f) • Pili – Aderência a células da mucosa humana • Protease IgA1 – Inativa IgA presente na orofaringe • Produção de hemocinina – Inibe crescimento bacteriano da flora normal Coleta e Transporte • Espécimes clínicos: – – – – – – – – Líquido cefalorraquidiano (líquor / LCR) Sangue Escarro Aspirado traqueal Lavado brônquico Amostras uretrais Swab de úlceras genitais Secreção ocular Diagnóstico - Gram • Bastonetes Gram negativos pequenos e pleomórficos (cocobacilos) Diplococos Gram Positivos Streptococcus pneumoniae Cocobacilos Gram Negativos Pequenos Haemophilus influenzae Diagnóstico - Prova da Oxidase • Pesquisa presença da enzima Citocromo Oxidase • Colocar bactéria em papel filtro • Adicionar uma gota do reativo da oxidase • Positivo Desenvolvimento de cor azul escuro ou roxo Negativo Positivo Diagnóstico - Cultura • Necessário fatores de crescimento presente em hemácias • FATOR X – Derivado da hemina (encontrado em quantidade no sangue) – Substância termoestável – Necessário para a síntese das enzimas respiratórias que contém ferro: citocromo oxidase, catalase, peroxidase • FATOR V – É a coenzima NAD (Nicotinamida Adenina Dinucleotídeo) – Substância termolábil – Produzida pelo Staphylococcus aureus • Satelitismo Meios de Isolamento Primário • Ágar sangue – 5% de sangue – Sangue de carneiro não recomendado (inativa fator V) – Sangue de cavalo ou coelho – Utilizar apenas se na presença de S. aureus • Ágar chocolate – 5% de sangue aquecido a 80º C – Lisa as hemácias e libera o fator X – Inativa a enzima do sangue de carneiro – Pode inativar o fator V (termolábil) • IsoVitaleX Prova do Satelitismo • • • • Prova realizada em AS Produção de Fator V por bactérias (S. aureus) Prova de identificação presuntiva para o gênero Colônias pequenas ao redor das colônias de S. aureus Prova do Satelitismo Placa 1 – Ágar Sangue Placa 2 – Ágar Muller Hinton Placa 1 Placa 2 Uso dos Fatores Situação 1 + (junto da estria) + V Situação 2 + (junto da estria) - XeV Situação 3 + (fora da estria) - X Tiras de Papel Filtro Requerimento do Fator V Requerimento do Fator X x v x Requerimento dos Fatores X e V x v v Características Diferenciais das Espécies de Haemophilus Requerimento de Fator X V Catalase H. influenzae + + + H. parainfluenzae - + + H. ducreyi + - - Tratamento • H. influenzae são susceptíveis in vitro – Ampicilina – Amoxacilina – Cefaosporinas, tetraciclinas, aminoglicosídeos e sulfonamidas • Algumas cepas produzem beta lactamase – Resistência à ampicilina Corynebacterium spp. Bacilos Gram positivos com extremidades arredondadas e arrumados como letras chinesas Características • Catalase positivo e são imóveis • Bastonetes Gram positivos com extremidades arredondadas arrumados em letras chinesas – – – – Bastonetes pequenos Grânulos de acúmulo de substâncias A bactéria não é corada uniformemente no Gram Coloração Albert-Laybourn (coloração metacromática: corpo esverdeado e extremidades marrons) • Várias espécies fazem parte da flora normal • Principal espécie de importância médica: – Corynebacterium diphtheriae Difteria • Doença infecto-contagiosa de curto período de incubação • Faringite exsudativa envolvendo palato e úvula • Membrana muco-purulenta que pode envolver laringe e traquéia • Virulência provocada por exotoxina – Toxina Diftérica – Ação da infecção da bactéria por fago • A toxina diftérica tem ação sistêmica, atingindo sistema cardíaco, respiratório e sistema nervoso central Corynebacterium diphtheriae • Coleta e transporte – Material do trato respiratório • Nasofaringe e orofaringe – Coletar a amostra das bordas da pseudomembrana utilizando um Swab – A bactéria pode ser preservada e transportada com segurança em meios de transporte até 24 horas Diagnóstico – Exame Direto • Gram • Coloração de Albert-Laybourn – – – – – – – Fixar o esfregaço pelo calor Cobrir o esfregaço com corante de Albert-Laybourn - 3 minutos Lavar rapidamente com água corrente Cobrir o esfregaço com o Lugol - 2 minutos Lavar rapidamente com água corrente Secar à temperatura ambiente ou em estufa à 35 – 37ºC; Proceder a microscopia em objetiva de 100X Diagnóstico - Cultura • Semear o swab em toda a superfície dos seguintes meios – AS – Ágar Sangue • • • • Meio não seletivo Não permite diferenciar Corynebacterium spp. de outras espécies Crescimento sem hemólise Usado como diagnóstico de exclusão (beta hemolítico: S. pyogenes) – ACT – Ágar Chocolate Telurito de Potássio • Meio seletivo de favorecimento para o Corynebacterium spp. • Diferenciação de biotipos (gravis, intermedium e mitis) – Loeffler • Ágar com soro de cavalo coagulado • Deixar o sawb depositado na parte inclinada • Meio de enriquecimento 2 a 4 horas a 35º C – Gram e Albert-Laybourn – Subcultivo em ACT (18 a 24 horas a 35º C) Diagnóstico – Produção de Toxina • ELEK – Teste de imunodifusão – Meio ágar protease peptona (meio transparente) – Ao preparar o meio acrescenta-se um tira de papel filtro embebida com anticorpo antitoxina diftérica – Amostra inoculada e incubada a 35º C 24-48 hrs – Resultado positivo: formação de linha de precipitação formando ângulo de 45º – Incluir sempre controle positivo e negativo Diagnóstico – Produção de Toxina • ELEK Papel Filtro embebido em Antitoxina Cepa produtora de toxina diftérica Cepa não produtora de toxina diftérica Mycobacterium spp. Bacilos finos não corados pelo Gram, aeróbios, resistentes à ação de ácidos e bases Mycobacterium • Família Mycobacteriaceae • Principais espécies – Mycobacterium tuberculosis (BK - Bacilo de Koch) – Mycobacterium bovis – Mycobacterium leprae Tuberculose • É uma das doenças que mais mata no mundo • Estimativa de que 1/3 da população esteja infectada • A transmissão é feita através do ar, de pessoa para pessoa (espirro, tosse, risada, etc.) • Afeta principalmente os pulmões, mas pode afetar outros órgãos Diagnóstico - Cuidados • Cuidado no manuseio de amostras no laboratório alto risco de contaminação principalmente por aerossóis • Altamente recomendado uso de máscaras de barreira • Quando se deseja fazer apenas baciloscopia, sem cultura, pode-se adicionar hipoclorito na amostra. O BK continua inviável, mas é visualizado na baciloscopia Diagnóstico • Espécimes clínicos: – – – – – – – Escarro Swab de nasofaringe Sangue Líquor Lavado brônquico Lavado gástrico Material de biópsia • Coleta do escarro: – Colher de preferência no início da manhã – Fazer higiene bucal e fazer 4 a 10 inspirações profundas Diagnóstico – Exame Direto • Coloração de Ziehl Neelsen (Baciloscopia) – – – – – – – Cobrir lâmina com Fucsina Fenicada Aquecer até emissão de vapores (3 a 4 vezes por 5’) Lavar rapidamente em água corrente Descorar com álcool-ácido Lavar rapidamente com água corrente Cobrir a lâmina com Azul de metileno por 30-60’’ Lavar rapidamente com água corrente e esperar secar Diagnóstico – Exame Direto • Resultado semiquantitativo (percorrer 100 campos) Lâmina Resultado Reportado BK não visualizado Ausência de BAAR na amostra examinada 1 a 9 BK em 100 campos Positivo + 1 a 9 BK em 10 campos Positivo ++ 1 a 9 BK por campo Positivo +++ > 9 BK por campo Positivo ++++ Diagnóstico - Cultura • Espécime clínico (escarro) contaminado com flora normal – Método de PETROFF • O escarro é misturado ao NaOH 1N e depois de dez minutos o material é centrifugado por 20 minutos. O sedimento é neutralizado com solução de HCl 1N com indicador. Só então a amostra é inoculada no meio de LJ. – Método do Lauril Sulfato de Sódio • Meio de cultura Lowenstein-Jensen (LJ) – – – – Meio em tubo à base de ovo coagulado Geralmente inocula em 2 tubos 35º C, por até 45 dias, leitura feita semanalmente Nas primeiras 24 horas deixar o tubo deitado e a tampa frouxa Diagnóstico - Cultura • Resultado de crescimento semiquantitativo Resultado Interpretação Ausência de colônias Não houve crescimento bacteriano depois de 45 dias (+) Crescimento de 1 a 20 colônias em cada tubo + Crescimento de 20 a 100 colônias em cada tubo ++ Crescimento de mais de 100 colônias em cada tubo Diagnóstico - Cultura • Característica da colônia: – Tamanho médio a grande, semelhante a couve-flor, rugosa, bordas irregulares, coloração creme – Fazer baciloscopia da colônia • Identificação do M. tuberculosis – Prova da Niacina e Redução de Nitrato a Nitrito POSITIVO Diagnóstico Não Bacteriológico • PPD (Derivado de Proteína Purificado) ou Teste de Mantoux • Injeção intradérmica de tuberculina • Não tem importância diagnóstica • Resultado positivo indica que houve contato com o bacilo, mas não indica doença ativa • Teste utilizado para fins de controle epidemiológico e profilaxia em contactantes de pacientes com tuberculose • Reação Positiva – Formação de endurecimento (infiltrado celular) Diagnóstico Não Bacteriológico • A leitura do resultado é feita de 48-72 horas após aplicação do teste • Possíveis resultado: – 0 – 4 mm = Não reator Indivíduo não infectado pelo M. tuberculosis ou com hipersensibilidade reduzida. – 5 – 9 mm = Reator fraco Indivíduo vacinado com BCG ou infectado por M. tuberculosis ou outras micobactérias. – ≥ 10 mm = Reator forte indivíduo infectado pelo M. tuberculosis,(doente ou não) e indivíduos vacinados com BCG nos últimos dois anos.
Download