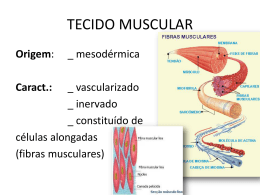
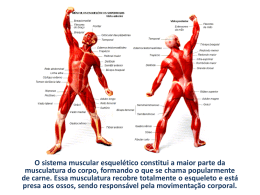
SIMULADO 5. 2012 CADERNO DE SAÚDE PROVA DE BIOLOGIA PROVA DE FÍSICA PROVA DE QUÍMICA MATEMÁTICALINGUAGENS, CÓDIGOS E SUAS TECNOLOGIAS PROVA DE CIÊNCIAS HUMANAS E SUAS TECNOLOGIAS “Ninguém pode construir em teu lugar as pontes que precisarás passar, para atravessar o rio da vida. Ninguém, exceto tu, só tu.” (Friedrich Nietzsche) PROVA DE BIOLOGIA QUESTÃO 01 O estudo comparativo dos diversos tipos de tecido muscular na espécie humana permite concluir que: 0 0 O tecido muscular é formado de células alongadas,especializadas na contração, podendo ou não estar sujeito ao controle voluntário. 1 1 O músculo cardíaco, apesar de apresentar estrias transversais, é de contração involuntária e está sobre controle do sistema nervoso somático. 2 2 3 3 4 4 Os íons Ca , participantes do mecanismo de contração muscular, são concentrados nas cisternas do retículo sarcoplasmático liso da fibra muscular. A fibra muscular esquelética é multinucleada, com núcleos periféricos e contração rápida e voluntária. O músculo estriado esquelético é meuroativado e não obedece a Lei do Tudo ou Nada. A) B) ++ VFVVV FVVFV C) VVFFV D) FVFFF E) VVVFF QUESTÃO 02 Analise as afirmativas sobre o músculo estriado esquelético: 0 0 O sarcômero, unidade funcional do tecido muscular, apresenta um sistema de filamentos protéicos que dispensam a utilização de energia para promoverem aos processos de contração e relaxamento. 1 1 A placa motora é a região de comunicação (sinapse) entre a terminação nervosa e a superfície da fibra muscular que utiliza o mediador químico acetilcolina. 2 2 O tônus muscular é mantido graças a impulsos nervosos de baixa freqüência, descarregados sobre os músculos. 3 3 Durante a contração da fibra esquelética, verifica-se a diminuição do comprimento dos miofilamentos de actina e miosina. 4 4 A) B) QUESTÃO 03 Considere as seguintes representações de um músculo esquelético e as faixas indicadas pelas letras. O músculo esquelético é aquele que obedece à nossa vontade, por isso a sua contração está na dependência do sistema nervoso autônomo. VVFVF FVVFF C) VVFFV D) FVFFF 0 0 A faixa A, denominada de Banda A (anisotrópica), corresponde à justaposição de moléculas de actina e miosina. 1 1 A faixa B corresponde ao sarcômero, que vai de uma linha Z a outra. 2 2 A faixa C, denominada Banda I (isotrópica), corresponde a uma região onde são encontradas apenas moléculas de miosina. 3 3 A faixa C (Banda I) reduz de tamanho na contração muscular. 4 4 A zona H situa-se no centro da Banda A (faixa A) e se reduz na contração muscular. A) B) VVFVF FVVFF C) VVFFV D) FVFFF E) VVFVV E) VFVFV 03. Considere as seguintes representações de um músculo esquelético e as faixas indicadas pelas 04. A figura abaixo mostra de forma esquemática o processo de contração muscular. Com base nela, PROVA DE BIOLOGIA QUESTÃO 04 A figura abaixo mostra de forma esquemática o processo de contração muscular. Com base nela, analise as alternativas apresentadas e identifique as verdadeiras e falsas. 0 0 1 1 2 2 3 3 4 4 Duas condições são necessárias para que os filamentos de miosina deslizem sobre os de actina e a contração muscular ocorra: a presença de ATP e íons de cálcio. O estímulo para a contração chega à fibra muscular e ativa as bolsas do retículo endoplasmático para liberarem íons de cálcio. O excesso de ATP faz com que as moléculas de miosina se unam fortemente às de actina e o músculo enrijeça e não se movimente. O ATP gasto durante a contração muscular é rapidamente reposto graças a uma substância denominada fosfocreatina. A creatina-fosfato desempenha o papel de reservatório secundário para a contração muscular. A) VVFVF B) FVVFF C) FVFVF D) FVFFV E) VVFVV QUESTÃO 05 Os sistemas reguladores das várias funções orgânicas são representados pelo sistema nervoso e pelas glândulas endócrinas. Sobre o sistema endócrino: 0 0 1 1 2 2 3 3 4 4 Em estado de perigo, num momento de susto ou de raiva, verifica-se no sangue um aumento do hormônio adrenalina. Quando o indivíduo apresenta uma hiperglicemia, as células alfa liberam insulina que permite a saída de glicose das células. A falta de hormônio HAD, também chamado vasopressina, ocasiona uma doença caracterizada pela eliminação de uma grande quantidade de urina denominada diabetes insipidus. O hormônio STH, produzido pelo córtex das adrenais, promove o crescimento ósseo e medular influenciando também o metabolismo celular da glicose. A espermatogênese, assim como a estimulação das células de Sertoli, para produzir a testosterona, depende dos hormônios hipofisários: FSH e LH. A) VVFVF B) FVVFV C) FVFVF D) VFVFF E) VFFFV 06. Quanto ao sistema endócrino que representa a forma de controle químico do organismo realizado através de hormônios: PROVA DE BIOLOGIA QUESTÃO 06 Quanto ao sistema endócrino que representa a forma de controle químico do organismo realizado através de hormônios: 0 0 Uma das funções mais importantes do hipotálamo é o controle da glândula hipófise. 1 1 O FSH e o LH constituem as gonadotrofinas, hormônios reguladores do funcionamento dos ovários e testículos. 2 2 A falta de STH, na infância, acarreta o nanismo e seu excesso leva ao gigantismo. 3 3 O hormônio HAD, no sexo feminino, provoca a contração uterina e induz ao trabalho de parto. 4 4 A diabetes insipidus, caracterizada pela eliminação de uma grande quantidade de urina, é provocada pela falta do ACTH produzido pela neuroipófise. A) VVVFF C) FVFFV B) FVVFF D) FVFFF E) VFFVV QUESTÃO 07 Sobre a figura abaixo, assinale as proposições verdadeiras e falsas: QUESTÃO 08 Assinale as proposições abaixo: 0 1 2 3 4 A hipofunção da hipófise – caracterizada pela diminuição da secreção de paratormônio – conduz a uma acentuada remoção de cálcio dos ossos, com aumento de sua concentração no sangue. 1 A insulina, hormônio produzido na região endócrina do pâncreas, age ao nível de membranas celulares, tornando-as permeáveis à glicose. 2 Na regulação do metabolismo dos açúcares, atuam a insulina e o glucagon – produzido no pâncreas (ilhotas de Langerhans) – sendo o hormônio insulina produzido pelas células beta e o glucagon, pelas células alfa. 3 Adrenalina e noradrenalina são hormônios produzidos na região medular das suprarenais (adrenais) e, quando liberados o sague, reforçam o efeito do sistema nervoso simpático. 4 O hormônio de crescimento (somatotrofina), é produzido pela tireóide, alojado numa cavidade (sela túrcica) do osso esfenóide do crânio. A) VFVVF C) FVVFV B) FVVVF D) FVFFF E) VFVFV 0 QUESTÃO 09 Sobre o mecanismo de retroação negativa pela qual a concentração de glicose no sangue é estabilizada, em indivíduos normais: 0 1 2 0 1 2 3 4 0 Quando a produção de ADH em 1 é baixa, surge uma doença chamada diabetes insipidus. 1 Uma produção de somatotrofina excessiva em 5, no indivíduo adulto, provoca a acromegalia. 2 Aldosterona, produzida em 3, promove um aumento da reabsorção de sódio nos túbulos renais. 3 Glucagon, produzido em 4, tem o efeito de diminuir a glicemia. 4 O cortisol, produzido em 2, estimula a produção de glicose. A) VFVVF C) FVFFV B) FVVFF D) FVFFF E) VFVFV 3 4 0 A secreção de insulina é controlada pela glicose circulante no sangue. 1 A glicose sanguínea estimula a secreção de insulina pelo pâncreas de forma que, quando os níveis plasmáticos de glicose são altos, ocorre maior secreção de insulina. 2 Se o nível de glicose aumentar, a insulina fica retida no pâncreas e só será liberada quando, através do mecanismo de retroação, este nível atinge o normal. 3 Com o aumento da secreção da insulina, incrementa-se a utilização de glicose (aumenta a permeabilidade da membrana celular à glicose), fazendo com que volte ao normal o nível de açúcar no sangue. 4 Se o nível de glicose no sangue cair, menos insulina será secretada, havendo menor utilização de glicose e, como conseqüência, o nível subirá até atingir novamente o normal. A) FFVVF C) VVFFV B) FVVFF D) VVFVV E) VFVFV 0. Internamente, os testículos são subdivididos em PROVA DE BIOLOGIA QUESTÃO 10 Internamente, os testículos são subdivididos em lóbulos, cada um com longos e finos túbulos seminíferos enovelados. Esse conjunto de túbulos reúne-se na região do epidídimo, saindo daí um canal deferente, para a eliminação dos espermatozóides. 0 1 2 3 4 A) 0 Nas paredes dos túbulos seminíferos, há várias camadas celulares em diferentes fases do processo de formação dos espermatozóides e, próximo à luz de cada túbulo, ficam as células que caracterizam a fase de maturação da espermatogênese (1). 1 Os espaços entre os túbulos seminíferos são preenchidos por um tecido conjuntivo, onde estão pequenos grupos de células intersticiais denominadas células de Leydig (2). 2 Os hormônios LH (folículo estimulante) e FSH (estimulante das células intersticiais) são produzidos no lobo anterior da hipófise, denominado neuroipófise (3). 3 O hormônio FSH (4) estimula a produção de espermatozóides (espermatogênese) e o hormônio ICSH, também denominado hormônio luteinizante (5), estimula as células intersticiais para a produção de testosterona. 4 O hormônio LH (4) estimula o amadurecimento dos espermatozóides e o hormônio FSH (5), também chamado ICSH, estimula a secreção de testosterona pelas células de Leydig. VVFVF B) FVVFF C) FVFVF D) VFVFF E) VFFVF QUESTÃO 11 Os animais utilizam-se dos músculos para movimentar o corpo ou partes dele. É graças à atividade muscular que conseguem andar, nadar, correr etc. Sobre este assunto, observe a figura adiante e analise as proposições a seguir. 0 0 1 2 1 2 3 3 4 4 As fibras musculares esqueléticas apresentam em seu citoplasma finíssimas fibras contrácteis, as miofibrilas. Cada miofibrila é formada por uma seqüência linear de sarcômeros. O sistema muscular estriado esquelético é auto-suficiente para produzir os movimentos do corpo humano, não havendo cooperação de nenhum outro sistema. ++ A presença de íons cálcio (Ca ) no líquido intracelular é uma condição necessária para que ocorra a contração dos sarcômeros. No relaxamento dos sarcômeros, não há gasto de ATP. PROVA DE BIOLOGIA A) VVFVF B) FVVFF D) VFVFF C) FVFVF E) VFFVF QUESTÃO 12 Analise as alternativas abaixo e identifique as verdadeiras e falsas. 0 1 2 0 1 2 3 3 4 4 A) VVFVF As proteínas responsáveis pela contração muscular são capazes de deslizar umas sobre as outras, formando um complexo chamado actomiosina. A nível celular, as mitocôndrias são as únicas organelas envolvidas, por produzir ATP, necessários à contração muscular. Durante um curto período de contração muscular, nos mamíferos, a concentração local de ATP não decresce de modo significativo em face de haver o transporte de novas moléculas de ATP de outros compartimentos biológicos. ++ A miosina, na presença de Ca , adquire atividade ATPásica liberando energia que provoca o deslizamento de actina entre os de miosina. A fadiga muscular se deve diretamente ao baixo suprimento de oxigênio. B) FVVFF D) VFVFF C) FVFVF E) VFFVF QUESTÃO 13 Analise as alternativas abaixo e identifique as verdadeiras e falsas. 0 0 1 1 2 2 3 3 4 4 Um atleta, participando de uma corrida de 1500m, desmaiou depois de ter percorrido cerca de 800m, devido a oxigenação deficiente do seu cérebro. Nele deve ter havido acúmulo de monóxido de carbono. Num mamífero adulto, grande quantidade de células em divisão ocorre normalmente no músculo cardíaco. O músculo estriado esquelético apresenta faixas claras e escuras. A função da fosforil-creatina é atuar como reservatório de energia elétrica para a atividade muscular. Os filamentos de miosina são mais claros e espessos que os de actina. A) VVFVF B) FVVFF D) VFVFF C) FFVFV E) VFFVV Quanto às funções da ocitocina, analise as alternativas abaixo e identifique as verdadeiras e falsas. QUESTÃO 14 Quanto às funções da ocitocina, analise as alternativas abaixo e identifique as verdadeiras e falsas. 0 0 1 2 1 2 3 4 3 4 Remover o cálcio da matriz óssea para o plasma. Estimular as contrações uterinas no parto. Atuar no metabolismo geral do corpo e crescimento. Estimular a ejeção do leite materno. Estimular a produção de leite pelas glândulas mamárias. A) VVFVF B) FVVFF D) FVFVF C) FFVFV E) VFFVV QUESTÃO 15 Quando um composto é um hormônio, associamos ao mesmo sempre as seguintes características: 0 0 1 1 2 2 3 3 4 4 Atuação sobre vários órgãos simultaneamente; estrutura molecular sempre representada por peptídeos simples. Existem receptores específicos que o reconhecem; sua estrutura química é variada, podendo ser desde uma simples amina até uma macromolécula. Ação regulatória sobre variados domínios da fisiologia humana, provocando respostas geralmente duradouras; atua apenas sobre determinadas células. Produz respostas tissulares rápidas, mas de curta duração quando comparadas com as respostas produzidas por ação do sistema nervoso; atua sobre um único tipo de célula. Tem um mecanismo de ação igual ao dos outros compostos do mesmo grupo de substâncias; pertence sempre ao grupo químico dos esteróides. A) VVFVF B) FVVFF D) VFVFF C) FFVFV E) VFFVV PROVA DE FÍSICA PROVA DE FÍSICA QUESTÃO 16 No circuito esquematizado a seguir, tem-se um gerador G, que fornece 60v sob corrente de 8,0A, uma bateria com f.e.m. de 12v e resistência interna de 1,0Ω, e um resistor variável R. QUESTÃO 19 No circuito da figura a seguir, o amperímetro A registra uma corrente i=0,2A. Cada um dos três resistores representados na figura tem resistência R=40Ω. Qual é a potência dissipada pelo par de resistores associados em paralelo (multiplique sua resposta por 10), em Watts? Para que a bateria seja carregada com uma corrente de 8,0A, qual o valor que se deve ajustar R, em Ohms: QUESTÃO 20 No circuito representado no esquema a seguir, a resistência de R2‚ é igual ao triplo da resistência R1. QUESTÃO 17 Uma fonte de tensão ideal F, cuja força eletromotriz é 12 volts, fornece uma corrente elétrica de 0,50 ampéres para um resistor R, conforme indica o esquema a seguir. Se essa fonte de tensão F for substituída por outra, também de 12 volts, a corrente elétrica em R será de 0,40 ampéres. A resistência interna da nova fonte de tensão é, em ohms, igual a O valor do resistor R, em ohms, é igual a QUESTÃO 21 No circuito, cada resistência é igual a 1,0 k Ω, e o gerador é uma pilha de 1,5 V. A corrente total estabelecida pelo gerador é, em miliamperes: QUESTÃO 18 No circuito esquematizado, onde i=0,6 A, a força eletromotriz E vale, em Volts: RESPOSTA 36 4º) No circuito da figura a seguir, o amperímetro A registra uma corrente i=0,2A. Cada um dos três resistores representados na figura tem resistência 7º) Os três corpos, A, B e C, representados na figura a seguir têm massas iguais, m=3,0kg PROVA DE FÍSICA QUESTÃO 22 Os três corpos, A, B e C, representados na figura a seguir têm massas iguais, m=3,0kg QUESTÃO 25 A figura mostra um bloco, de peso igual a 700N, apoiado num plano horizontal, sustentando um corpo de 400N de peso, por meio de uma corda inextensível, que passa por um sistema de roldanas consideradas ideais. O módulo da força, em unidades 2 de 10 newtons, do plano sobre o bloco é: O plano horizontal, onde se apóiam A e B, não oferece atrito, a roldana tem massa desprezível e a aceleração local da gravidade pode ser considerada 2 g=10m/s . A tração no fio que une os blocos A e B tem módulo, em Newtons: QUESTÃO 23 Os blocos A e B têm massas m A=5,0kg e mB=2,0kg e estão apoiados num plano horizontal perfeitamente liso. Aplica-se ao corpo A a força horizontal ù, de módulo 21N. A força de contato entre os blocos A e B tem módulo, em newtons, QUESTÃO 24 O sistema indicado na figura a seguir, onde as polias são ideais, permanece em repouso graças a força de atrito entre o corpo de 10kg e a superfície de apoio. Podemos afirmar que o valor da força de atrito é, em newtons: RESPOSTA 20 10º) A figura mostra um bloco, de peso igual a 700N, QUESTÃO 26 Num local onde a aceleração gravitacional tem 2 módulo 10m/s , dispõe-se o conjunto a seguir, no qual o atrito é desprezível, a polia e o fio são ideais. Nestas condições, a intensidade da força que o bloco A exerce no bloco B, em newtons é: Dados: m (A) = 6,0 kg m (B) = 4,0 kg m (C) = 10 kg cos α = 0,8 sen α = 0,6 QUESTÃO 27 Uma esfera oca feita de papel tem diâmetro igual a 0,50m e gira com determinada freqüência f 0, conforme figura adiante. Um projétil é disparado numa direção que passa pelo equador da esfera, com velocidade v=500m/s. Observa-se que, devido à freqüência de rotação da esfera, a bala sai pelo mesmo orifício feito pelo projétil quando penetra na 2 esfera. A freqüência f0 da esfera, em unidades de 10 hertz, é: PROVA DE QUÍMICA QUESTÃO 30 Uma esfera de aço de massa 200g desliza sobre uma mesa plana com velocidade igual a 2m/s. A mesa está a 1,8m do solo. A que distância da mesa, em metros, a esfera irá tocar o solo? Obs.: despreze o atrito e multiplique sua resposta por 10. 2 Considere g = 10 m/s QUESTÃO 28 Uma torneira mal fechada pinga a intervalos de tempo iguais. A figura a seguir mostra a situação no instante em que uma das gotas esta se soltando. Supondo que cada pingo abandone a torneira com velocidade nula e desprezando a resistência do ar, pode-se afirmar que a razão A/B entre a distância A e B mostrada na figura (fora de escala) vale: PROVA DE QUÍMICA QUESTÃO 29 O gráfico a seguir mostra a velocidade de um automóvel em função do tempo. QUESTÃO 31 Em 1868, Kekulé e Couper propuseram a utilização do termo “valência” para explicar o poder da combinação dos átomos. A seguir, são fornecidos cinco elementos A, B, C, D e E e seus respectivos números atômicos (Z): A (Z =11), B (Z = 13), C (Z =15), D (Z = =16) e E (Z =17). Usando os seus conhecimentos de valência, julgue os itens a seguir. O deslocamento sofrido pelo automóvel de 0 a 8s foi de (em m): 15º) Uma esfera de aço de massa 200g desliza sobre uma mesa plana com velocidade igual a 2m/s. A mesa está a 1,8m do solo. A que distância da mesa, 0 0 Alguns elementos, quando combinados com outros, violam a regra do octeto, como é o caso de “C”, que, combinado com “E”, forma o composto CE5. 1 1 A combinação entre “B” e “E” origina um composto molecular com fórmula BE3, em que 2 “B” apresenta hibridação do tipo sp . 2 2 A combinação entre “A” e “D” origina um composto tipicamente iônico, que, ao ser posto em água, apresenta características alcalinas. 3 3 O composto formado por “A” e “E” apresenta ligação covalente. 4 4 A geometria molecular apresentada pela combinação dos elementos “C” e “E” pode ser do tipo piramidal ou bipiramidal. PROVA DE QUÍMICA A) B) VVVFF VVVFV C) FFFVV D) FVVFF E) FFVVV QUESTÃO 32 Conhecendo-se a distribuição eletrônica dos elementos, podemos identificar a sua posição no quadro periódico e, consequentemente, prever certos comportamentos reacionais deles. E1 [2He] 2s2 E2 [10Ne] 3s1 E3 [10Ne] 3s2 3p4 E4 [10Ne] 3s2 3p5 FFFVV VVVFV C) VVVFF D) FVVFF E) FFVVV QUESTÃO 33 Conhecer o pH do solo é um fator de grande importância, por exemplo, na floricultura, em especial no caso das hortênsias, que, quando cultivadas em solo ácido, geram flores azuis e, quando em solo alcalino, róseas. Suponhamos dois floricultores “A” e “B”: “A” cultiva hortênsias em solo ligeiramente neutro. “B” cultiva hortênsias em solo próximo a uma refinaria petroquímica, onde há considerável emissão de gases na atmosfera (como SO2, SO3 etc.) 0 0 1 1 2 2 3 3 4 4 Se “A” adicionar solução aquosa de cloreto de amônio periodicamente, após um tempo adequado, a tendência é crescerem flores predominantemente rósea. Na falta do cloreto de amônio, o floricultor “A” poderia fazer uso do acetato de amônio e obter o mesmo resultado, pois ambos são sais de amônio. O floricultor “B” provavelmente obterá hortênsias de cor predominantemente azuis, sem necessidade de interferir no pH do solo. O pH do solo cultivado por “B” é provavelmente menor que o pH do solo cultivado por “A”. Se o cloreto de amônio for usado pelo floricultor “A”, ele provoca-rá uma acidificação do solo devido à hidrólise do cátion amônio. A) B) FFFVV VVVFV Para as substâncias listadas abaixo, assinale, na coluna V, os aspectos verdadeiros e, na coluna F, os aspectos falsos. III. KOH 0 0 A ligação entre E1 e E4 é fortemente iônica. 1 1 E2 é um metal alcalino que, ao interagir quimicamente com a água, torna o meio levemente ácido. 2 2 O elemento E4 tende a formar substâncias simples homonucleares triatômicas. 3 3 E3 representa um elemento situado no mesmo período da tabela periódica que o gás nobre 18Ar. 4 4 E2 e E4 se ligam quimicamente por interação eletrostática, formando um composto que, quando dissolvido em água, não sofre hidrólise. A) B) QUESTÃO 34 O comportamento químico das substâncias, de forma “isolada” ou nas diversas reações, depende de vários aspectos, tais como entalpia de ligações, geometria molecular, reatividade química etc. C) VVVFF D) FVVFF E) FFVVV I. NaHCO3 II. H2SO4 IV. HCl V. CaO 0 0 1 2 3 4 O ácido representado ela estrutura II, quando concentrado, desidrata os hidratos de carbono. Nesse ácido, o enxofre faz duas ligações covalentes normais e duas coordenadas. 1 O composto representado por I possui comportamento básico quando em água e pode ser obtido pela neutralização parcial do ácido carbônico. 2 A reação em meio aquoso das substâncias representadas pelas estru-turas III e IV origina um sal cuja hidrólise é nitidamente alcalina. 3 A substância representada por V é um óxido que pode ser adicionado a um determinado solo para corrigir sua acidez. 4 A reação de I com IV, em meio aquoso, pode ser corretamente expressa por: H (aq) HCO3(aq) H 2O(l ) CO2( g ) A) B) FFFVV FVFVV C) VVFVV D) FVVFF E) VFFVV QUESTÃO 35 Quimicamente falando, não se deve tomar água ..................., mas apenas água ................... . A água ..................inúmeros sais, por exemplo, o cloreto de .................., o mais abundante na água do mar. Em regiões litorâneas,ameniza variações bruscas de temperatura, graças à sua capacidade de armazenar grande quantidade de energia térmica, o que se deve ao seu alto ..................... . Na forma de suor, sua evaporação abaixa a temperatura do corpo humano, para o que contribui seu elevado .................... . Completa-se corretamente o texto, obedecendo-se a ordem em que as lacunas aparecem, por: a) pura, potável, dissolve, sódio, calor específico, calor de vaporização. b) de poço, pura, dissolve, magnésio, calor específico, calor de vaporização. c) destilada, potável, dilui, sódio, calor de vaporização, calor específico. d) de poço, destilada, dissolve, magnésio, calor de vaporização, calor específico. e) pura, destilada, dilui, sódio, calor de vaporização, calor específico. PROVA DE QUÍMICA QUESTÃO 36 Considere espécies: I. II. III. IV. V. o caráter ácido-base das seguintes H2O C5H5N (piridina) (C2H5)2NH (dietilamina) (C2H5)2NH2 (dietilamômio) C2 H5OH (etanol) Das afirmações feitas, estão CORRETAS a) apenas I, II e III c) apenas III e IV Segundo definição ácido-base de Bronsted, dentre estas substâncias, podem ser classificadas como base: a) b) c) d) e) Apenas I e II Apenas I, II e III Apenas II e III Apenas I, II,III, e V Todas O dióxido de enxofre é produzido como subproduto da queima de combustíveis fósseis. Pode-se combinar com água e formar ácido sulfuroso, um ácido fraco, que se dissocia em: H3O + - (aq) + HSO3 (aq) - 0 0 H2SO3 é um ácido de Bronsted, e HSO3 sua base conjugada. 1 1 O pH de uma solução aquosa de H2SO3 é maior que sete a 25ºC. 2 2 Uma solução aquosa 1 molar de H2SO3 contém íons hidrônio numa concentração 1 molar. 3 3 O íon HSO3 também pode ser considerado um ácido, pois em meio aquoso o mesmo + 2pode produzir H3O e SO3 . 4 4 O íon SO3 deve ser uma base mais fraca que o íon HSO3 . A) B) b) apenas I, II e V d) apenas III, IV e V e) todas QUESTÃO 39 A opção que contém a sequencia CORRETA de comparação do comprimento de ligação química entre os átomos de carbono e oxigênio nas espécies CO, CO2, HCOOH e CH3OH, todas no estado gasoso, é: a) CO > CO2 > CH3OH > HCOOH. b) CH3OH > CO2 > CO > HCOOH. c) HCOOH > CO > CO2 > CH3OH. d) CO2 > HCOOH > CH3H > CO. e) CH3OH > HCOOH > CO2 > CO. QUESTÃO 37 H2SO3(g) + H2O(I) V A energia necessária para excitar um elétron do estado fundamental do átomo de hidrogênio para o orbital 3s é igual àquela necessária para excitar este mesmo elétron para o orbital 3d. QUESTÃO 40 Assinale a opção que contem a geometria molecular CORRETA das espécies OF2, SF2, BF3, NF3, CF4 e XeO4, todas no estado gasoso. a) Angular, linear, piramidal, piramidal, tetraédrica e quadrado planar. b) Linear, linear, trigonal plana, piramidal, quadrado planar e quadrado planar. c) Angular, angular, trigonal plana, piramidal, tetraédrica e tetraédrica. d) Linear, angular, piramidal, trigonal plana, angular e tetraédrica. e) Trigonal plana, linear, tetraédrica, piramidal, tetraédrica e quadrado planar. - 2- FFFVV FVFVV C) VVFVF D) FVVFF E) VFFVF QUESTÃO 38 Considere as seguintes afirmações: I O nível de energia de um átomo, cujo número quântico principal é igual a 4, pode Ter, no máximo, 32 elétrons. 2 2 2 2 II A configuração eletrônica 1s 2s 2px 2py representa um estado excitado do átomo de oxigênio. III O estado fundamental do átomo de fósforo contém três elétrons desemparelhados. IV O átomo de nitrogênio apresenta o primeiro potencial de ionização menor que o átomo de flúor. QUESTÃO 41 Considere as seguintes afirmações: I- Óxidos como Na2O, MgO e ZnO são compostos iônicos. II- Óxidos como K2O, BaO, CuO são básicos. III- Óxidos de carbono, nitrogênio e enxofre são compostos moleculares. IV- PbO2 e MnO2 são oxidantes fortes. Destas afirmações estão corretas: a) Apenas I e II. c) Apenas III e IV. b) Apenas I e III. d) Apenas I, II e III. e) Todas. QUESTÃO 42 Colocando grãos de nitrato de potássio em um frasco com água nota-se que com o passar do tempo o sólido desaparece dentro d’água. Qual das equações abaixo é a mais adequada para representar a transformação que ocorreu dentro do frasco? PROVA DE QUÍMICA a) KNO3 (c) KNO3 (L) b) KNO3 (c) + H2O (L) KOH (aq) + KNO3 ( aq) c) KNO3 (c) K+ (aq) + NO3 - ( aq) d) KNO3 ( c) K( L) + NO3 ( aq) e) KNO3 (c) + H2O (L) KNO2 ( aq) + H2O2 (aq) QUESTÃO 43 Hidreto de enxofre é subproduto de refinarias de petróleo, quando nestas se faz a dessulfuração dos combustíveis. Esse composto pode ser convertido em ácido sulfúrico através das seguintes etapas: oxidação a enxofre, realizada na refinaria de petróleo; oxidação do enxofre a dióxido de enxofre e deste, sob catálise, a trióxido de enxofre, na fábrica de ácido sulfúrico. Esse procedimento se justifica, entre outros pelos seguintes fatos: I - Compostos sulfurados, quando presentes nos combustíveis produzem, por queima, gás sulfídrico que é tóxico. II - A reação de oxidação do hidreto de enxofre a enxofre ocorre nos seguintes dois estágios: 2 H2S + 3 O2 2 H2O + 2 SO2 2 H2S + SO2 2 H2O + 3 S III - Na queima do enxofre com oxidação com oxigênio verifica-se elevada velocidade de formação do dióxido de enxofre e baixíssima velocidade de formação do trióxido de enxofre. São certas as afirmações: a) Apenas a I. d) Apenas a II e III. b) Apenas a II. c) Apenas a III. e) I, II e III. QUESTÃO 44 Assinale a opção que apresenta um sal que, quando dissolvido em água, produz uma solução aquosa ácida. a) Na2CO3 d) Mg(ClO4)2 b) CH3COONa e) NaF c) CH3NH3Cl QUESTÃO 45 Na temperatura de 25ºC e pressão igual a 1 atm, a concentração de H2S numa solução aquosa saturada é –1 de aproximadamente 0,1 mol L . Nesta solução, são estabelecidos os equilíbrios representados pelas seguintes equações químicas balanceadas: De acordo com o exposto, assinale a afirmação correta: a) De acordo com o conceito de Bronsted Lowry H2S e -2 S são pares conjugados. -2 b) H2S é a base conjugada de S . + c) A concentração de H no primeiro equilíbrio é igual a 0,1 mol/L. -2 d) S deve ser uma base conjugada mais fraca que HS . + -2 -23 e) [H ]²[S ] 1 x 10
Download