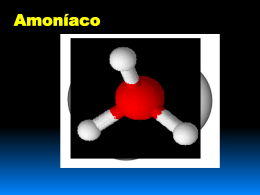
Equilíbrios e desequilíbrios QUÍMICA E INDÚSTRIA A INDÚSTRIA DO AMONÍACO O objetivo é fabricar um produto a preço tão baixo quanto possível mas respeitando as imposições de segurança e de proteção ambiental. É necessário avaliar os benefícios/prejuízos de modo a tomar as decisões mais acertadas. O Conceito de química verde foi introduzido há cerca de 2 décadas. Apostou-se na prevenção de acidentes, no aperfeiçoamento dos processos de fabrico e na redução de emissões de poluentes para a atmosfera. A INDÚSTRIA DO AMONÍACO O amoníaco é a matéria-prima para o fabrico de ácido nítrico, sais de amónio e ureia, utilizados na preparação de adubos azotados e de muitas outras substâncias, como o nylon, o poliuretano, polímeros acrílicos, explosivos, corantes e muitos outros produtos da vida moderna. APLICAÇÕES DO AMONÍACO O uso de amoníaco como fertilizante ou como matéria-prima para fertilizantes prende-se com a importância do elemento azoto para a vida vegetal. APLICAÇÕES DO AMONÍACO O AMONÍACO Uma molécula de amoníaco é formada por um átomo de azoto (nitrogénio) rodeada por três átomos de hidrogénio. O par de eletrões não ligantes no átomo de azoto conduz à geometria piramidal trigonal. O AMONÍACO Encontra-se no estado gasoso à temperatura ambiente e à pressão normal. À pressão normal, tem ponto de ebulição - 33ºC e ponto de fusão - 78º C. É um gás tóxico, incolor e inflamável, apresentando um cheiro característico picante e intenso. É altamente solúvel em água. O AMONÍACO As suas soluções são fortemente corrosivas, sendo especialmente perigosas se entrarem em contacto com a pele, os olhos e as vias respiratórias. Os reagentes usados pelas fábricas de amoníaco para a síntese industrial do amoníaco são as substâncias elementares Hidrogénio (H2) e azoto (N2); mas como se obtêm? A INDÚSTRIA DO AMONÍACO As três matérias primas utilizadas na síntese do amoníaco são: Gás natural, vapor de água e o ar. A INDÚSTRIA DO AMONÍACO A reação de síntese do não é completa; o azoto e o hidrogénio que não reagiram são novamente introduzidos no conversor através de uma bomba de reciclagem. Como se obtém o Hidrogénio necessário à SINTESE DO AMONÍACO? As fábricas de amoníaco usam atualmente nafta ou gás natural (constituído essencialmente por CH4)para a obtenção do hidrogénio. CH4 (g) + H2O (g) CO (g) + 3 H2 (g) Também a eletrólise da água permite obter hidrogénio (método usado na 1ª fábrica em Portugal). 2 H2O (l) 2 H2 (g) + O2 (g) Como se obtém o Hidrogénio necessário à SINTESE DO AMONÍACO? O Hidrogénio, que não existe livre, tem de ser preparado. O processo mais antigo de síntese industrial é a gaseificação do carvão. C (s) + H2O (g) CO (g) + H2 (g) O HIDROGÉNIO As células de combustível têm-se revelado uma fonte de energia muito promissora para mover veículos. A empresa coreana Hyunday Motor Company anunciou para 2005 o lançamento do primeiro «carro limpo», movido a hidrogénio. 2 H2 (g) + O2 (g) 2 H2O (g) O hidrogénio é o combustível do futuro, pois não produz qualquer poluição quando arde (dá simplesmente água), nem contribui para o aquecimento global do planeta (efeito de estufa). O PROCESSO DE HABER-BOSCH O azoto, reagente necessário para a produção do amoníaco, era obtido no século XIX a partir dos depósitos naturais de nitratos de sódio (NaNO3), que existiam principalmente no Chile (os chamados «nitratos do Chile»). Em finais do século XIX ficou claro que esses depósitos não podiam satisfazer a crescente necessidade de compostos de azoto em todo o mundo. COMPOSIÇÃO DO AR O azoto é extraído diretamente do ar, onde ele é muito abundante. O PROCESSO DE HABER-BOSCH Obter compostos de azoto a partir do azoto atmosférico tornou-se, então, um dos principais desafios da investigação em química. Fritz Haber (1868-1934) Carl Bosch (1874-1940 Foram o químico Fritz Haber e o engenheiro químico Carl Bosch, ambos de nacionalidade alemã, que se destacaram nesta «corrida» no início do séc. XX. O PROCESSO DE HABER-BOSCH Durante anos estudaram as melhores condições de temperatura e pressão para a reação de síntese do amoníaco. Fritz Haber (1868-1934) Carl Bosch (1874-1940 A solução para a eficiência industrial deste processo de produção acabaria por envolver o uso de catalisadores. O PROCESSO DE HABER-BOSCH Montagem de Haber para a produção de amoníaco. A SÍNTESE DO AMONÍACO A síntese do amoníaco é uma reação incompleta. NATUREZA DAS REACÇÕES QUÍMICAS REACÇÕES QUÍMICAS DECOMPOSIÇÃO ELéctrolise Fotólise Hidrólise Pirólise SÍNTESE Total Parcial SÍNTESE TOTAL A síntese é total quando todos reagentes são substâncias elementares. Exemplo: 2 H2 (g) + O2 (g) 2 H2O (g) os SÍNTESE PARCIAL A síntese é parcial quando os reagentes são substâncias elementares e compostas, ou só compostas. Exemplos : PCl3 (g) + Cl2 (g) PCl5 (g) CaO (g) + H2O (l) Ca(HO)2 (g) REACÇÕES QUÍMICAS Completas Pelo menos um dos reagentes esgota-se ou atinge uma concentração não mensurável. Incompletas Nenhum dos reagentes se esgota no decorrer da reação A maioria das reações químicas são incompletas quando ocorrem em sistema fechado (sistema em que há trocas de energia com a vizinhança mas não há trocas de matéria). SENTIDO DE PROGRESSÃO REAÇÃO DIRETA E INVERSA A obtenção de hidrogénio necessária ao processo de Haber-Bosch implica, numa dada fase que se remova o CO2 da mistura reacional. A adição de K2CO3 tem essa função. CO (g) + H O (l) + K CO (s) 2 KHCO (s) 2 2 2 3 3 R. DIRETA - ocorre se a pressão de CO2 for elevada O processo pode no entanto ser invertido para reciclar o K2CO3. 2 KHCO (s) CO (g) + H O (l) + K CO (s) 3 2 2 2 3 R. inversa - ocorre se T = 300ºC O facto de ocorrer a reação direta ou a inversa depende das condições reacionais impostas ao sistema químico. A reação direta é aquela que consideramos mais importante. Geralmente escreve-se da esquerda para a direita. REAÇÕES COMPLETAS • Uma reação diz-se completa se, pelo menos, um dos reagentes se transforma integralmente nos produtos de reação, isto é, esgota-se. • O seu rendimento é praticamente 100% (ou 1). C3H8 (g) + 5 O2 (g) 3 CO2 (g) + 4 H2O ( g ) No início No final REACÇÕES INCOMPLETAS Uma reação diz-se incompleta se nenhum dos reagentes se esgota, sendo neste caso o rendimento inferior a 100% (ou 1). N2 (g) + 3 H2 (g) 2 NH3 ( g ) A síntese do amoníaco não é uma reação completa porque o processo direto e inverso ocorrem nas mesmas condições reacionais. Inicialmente: presentes N2 (g) + H2 ( g ) No final: presentes N2 (g), H2 (g) e NH3 (g) REACÇÕES INCOMPLETAS N2 (g) + 3 H2 (g) 2 NH3 ( g ) - As temperaturas devem ser baixas mas não tão baixas que comprometessem a rapidez da reação. - A adição de ferro em pó e de vários óxidos ao sistema aumenta a rapidez da reação. - No início a síntese de amoníaco destinava-se à produção de fertilizantes mas durante a 1ª guerra a produção foi canalizada para a produção de explosivos. - Mais tarde Haber foi considerado um criminoso de guerra. SÍNTESE DE COMPOSTOS INORGÂNICOS Os sais podem obter-se por síntese, destacando-se: • Reação entre um ácido e uma base Exemplo: H2 SO4 (aq) + Mg(HO)2 (aq) MgSO4 (aq) + 2 H2O (l ) • Reação entre um ácido e um metal Exemplo: 2 HNO3 (aq) + Fe (s) Fe(NO3)2 (aq) + H2 (g) SÍNTESE DE COMPOSTOS INORGÂNICOS •Reação entre um ácido e um óxido metálico Exemplo: H2S (aq) + Na2O (s) Na2S (aq) + H2O (l) SÍNTESE COMPOSTOS INORGÂNICOS O nome do sal está relacionado com o nome do ácido que lhe dá origem e do ião metálico que entra na sua constituição. NOME DO ÁCIDO • terminado em ídrico • terminado em oso • terminado em ico NOME DO SAL terminado eto terminado em ito terminado em ato SÍNTESE COMPOSTOS INORGÂNICOS Exemplos: ácido clorídrico + óxido de cálcio cloreto de cálcio + água ácido sulfuroso + hidróxido de lítio sulfito de lítio + água ácido sulfúrico + ferro sulfato de ferro + hidrogénio SAIS SIMPLES Designam-se por sais simples os que são formados por um único tipo de catião e um único tipo de anião. Exemplos: KBr — brometo de potássio Na3PO4 — fosfato de sódio Ca(NO3)2 — nitrato de cálcio SAIS DUPLOS Alguns sais contêm catiões provenientes de duas bases diferentes ou aniões provenientes de dois ácidos diferentes, chamando-se, por isso, sais duplos. Para dar o nome a um sal duplo formado por dois catiões e um anião, refere-se em primeiro lugar o nome do anião seguido do nome dos catiões, por ordem alfabética. SAIS DUPLOS Exemplos: KNaSO4 – sulfato de potássio e sódio MgNH4PO4 – fosfato de amónio e magnésio BaBrI – brometo iodeto de bário
Download