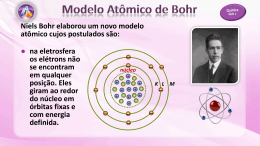
MODELOS ATÔMICOS - TEORIA Introdução Desde a Antigüidade, a humanidade tem tentado achar explicações para os fenômenos que acontecem ao seu redor. Nos tempos remotos, diversos conceitos foram propostos a partir de aspectos filosóficos, mas, que apesar da ausência de fundamentação científica, ainda existem nos dias de hoje. Entre os assuntos discutidos na época e que foram tema de inúmeras análises e desenvolvimento com bases científicas posteriores está o conceito de átomo (do grego, “aquele que não pode ser dividido”). O presente artigo tem por finalidade discutir os principais modelos atômicos e as descobertas que foram elementos chave em suas construções. Gregos O primeiro conceito sobre átomos data de antes de Cristo (450 a.C.), quando os gregos acreditavam que a matéria era composta por partículas indivisíveis, os chamados átomos. Essa proposta inicial é considerada um modelo filosófico, já que não foi pautada em nenhuma base científica. Os responsáveis por esse conceito inicial foram Leucipo e Demócrito. Modelo de Dalton (1805) O conceito proposto pelos gregos perdurou durante um grande intervalo de tempo. A discussão sobre um novo modelo atômico se inicia quando surgem duas leis muito importantes na história da química, as chamadas leis ponderais, que se seguem abaixo: a) Lei de Lavoisier (1774): A lei de Lavoisier se refere à conservação das massas. Num enunciado dentro da Química podemos dizer que para Lavoisier “Numa reação em sistema fechado, a massa se conserva”. Trazendo a lei para o dia a dia, temos uma das frases mais conhecidas dentro das Ciências: “Na natureza nada se perde, nada se cria, tudo se transforma”. Assim, por exemplo, quando 2 gramas de hidrogênio reagem com 16 gramas de oxigênio verifica-se a formação de 18 gramas de água, ou seja a massa total dos reagentes é igual à massa total dos produtos da reação química. Ex: 2g H2 + 16g O2 → 18g H2O b) Lei de Proust (1797): A lei de Proust está relacionada com a proporção entre componentes de uma determinada substância, por isso é chamada Lei das Proporções Constantes. Ela pode ser enunciada como “Quando duas ou mais substancias se combinam para formar um composto, elas devem guardar entre si proporções certas e definidas”. Na vida real, podemos pensar na preparação de um bolo. Se na preparação de 100g de um bolo precisamos de uma quantidade X do ingrediente A e Y do ingrediente B, quando passamos a preparar 500g, a massa de cada ingrediente também é multiplicada por 5, mas a proporção permanece constante, ou seja: 100g de bolo → X g de A + Y g de B → Proporção = X/Y 500g de bolo → 5X g de A + 5Y g de B → Proporção = 5X/5Y = X/Y Resumindo, independente da quantidade total da substância a ser produzida, a proporção entre seus componentes é constante. Para explicar essas leis era necessário um novo modelo com uma maior base científica. Sendo assim em 1805, Dalton propõe o “Modelo da bola de bilhar”, com base nos seguintes postulados: I) Matéria formada por partículas indivisíveis, chamadas átomos. II) Átomos são esferas maciças, indestrutíveis e indivisíveis. III) Átomos de uma mesma espécie química têm mesma massa e mesmas propriedades. Átomos de espécies diferentes possuem massas e propriedades diferentes. Surge o conceito de elemento químico. IV) Os átomos se combinam para formar outras espécies, permanecendo inalteráveis, ocorrendo apenas rearranjo. Surge o conceito dos chamados “átomos compostos”, que mais tarde originou o conceito de moléculas. Modelo de Thomson (1898) A descoberta da eletricidade e o estudo de diversos fenômenos elétricos foram elementos chave para o aparecimento de um novo modelo atômico. O modelo de Dalton tratava o átomo como elemento indivisível e sem carga, mas principalmente os estudos de Faraday, em torno de 1832, demonstraram que a matéria deveria possuir em seu interior alguma espécie de natureza elétrica. Na época de Thomson, os físicos estavam fascinados pelos raios catódicos (radiações que surgiam quando se aplicava uma diferença de potencial entre um pólo negativo (catodo) e um pólo positivo (anodo)) e trabalhavam arduamente para entender sua natureza. Sabia-se que as trajetórias de partículas carregadas eram afetadas tanto por campos magnéticos como por campos elétricos. Assumindo que os raios catódicos eram partículas carregadas negativamente, Thomson pôde prever o que aconteceria a esses raios quando eles passassem através de tais campos. Por exemplo, a deflexão por um campo magnético poderia ser exatamente balanceada por um campo elétrico com dada direção e magnitude. Essas predições foram verificadas num experimento no qual foi utilizada a Ampola de Crookes, um tubo com gás rarefeito no qual esses raios catódicos se propagavam e sofriam a aplicação de campos elétricos e magnéticos. Pelos resultados, Thomson pôde concluir que os raios catódicos realmente agiam como partículas carregadas, e, com isso, calcular a partir de dados experimentais a razão da carga de uma partícula negativa por sua massa: q C = − 1,76 x1011 m kg Partindo disso, Thomson, em 1898, propõe um novo modelo atômico, denominado “Modelo do pudim de passas”, que se constituía numa massa carregada positivamente (“pudim”) com partículas de carga negativa espalhadas em seu interior (“passas”). Observe a figura abaixo: Thomson, em seus experimentos, utilizou diversos tipos de materiais como fonte dos raios catódicos em tubos com os mais diversos tipos de gases. Se baseando no fato de que a relação era mantida para diferentes tipos de situações, ele induziu de que as partículas negativas (elétrons) deveriam estar contidas em todos os tipos de matéria. É importante ressaltar que Thomson apenas determinou a razão entre carga e massa de partículas carregadas, não tendo sido responsável pela obtenção de nenhum dos dois valores isoladamente. Modelo de Rutherford (1911) No início do século XX, com o surgimento de novas descobertas como, por exemplo, a radioatividade, Rutherford e seus colaboradores (Geiger e Marsden) realizaram experimentos que objetivavam validar o modelo proposto por Thomson na década anterior. O experimento de maior destaque e que serviu como base para o novo modelo atômico de Rutherford, foi o chamado experimento do espalhamento, representado na figura abaixo: Nesse experimento, um elemento (polônio) servia como fonte de um feixe de partículas de natureza radioativa (partículas alfa - 2α4), que eram partículas positivamente carregadas. Esses feixes eram direcionados a uma folha de ouro e os resultados vistos deveriam servir como base para a análise de Rutherford. Pelo modelo de Thomson explicado anteriormente, esse feixe de partículas não deveria ser desviado significativamente, já que o átomo de Thomson tem cargas espalhadas homogeneamente. Mas, contrariando o esperado, o experimento do espalhamento mostrou que a maioria das partículas passava diretamente sem sofrer desvios, enquanto uma parte muito menor sofria desvios ou mesmo retornava no caminho inicial (para cada 10.000 partículas alfa que atravessam sem desviar, 1 era desviada). Com base nesse resultado, Rutherford propõe o chamado “Modelo planetário”, pelo qual existiria uma região central extremamente pequena e de carga positiva (núcleo), na qual, quando as partículas α se chocavam, sofriam desvios ou retornavam e outra região ao redor, de carga negativa (eletrosfera), na qual as partículas passariam sem sofrer desvios. A relação calculada pautada na proporção entre partículas desviadas e não desviadas é de que o tamanho do átomo correspondia a 10000 vezes o tamanho do núcleo. Além disso, para que o efeito observado fosse completamente explicado, Rutherford propõe que a massa do átomo estava concentrada nessa região central (núcleo). A figura representativa do modelo se segue abaixo: http://www.enciclopediavirtual.vilabol.uol.com.br Modelo de Bohr (1913) A partir de diversos experimentos, Bohr identificou dois problemas no modelo proposto por Rutherford: a) uma carga negativa, colocada em movimento ao redor de uma carga positiva estacionária, adquire movimento espiralado em direção à carga positiva acabando por colidir com ela; b) uma carga negativa em movimento irradia (perde) energia constantemente, emitindo radiação. Porém, sabe-se que o átomo em seu estado normal não emite radiação e que não existia tal colisão. O modelo de Bohr utilizou estudos de diversos outros cientistas da época como Planck, Rydberg e Balmer. No que se refere à Planck, segundo seus estudos, a energia radiante (radiações) não varia continuamente, mas aos saltos ou “quanta” de energia. O valor do quantum de energia (menor porção de energia) radiante pode ser obtido pela expressão: E = h.f, onde: E: valor do quantum de energia; f: freqüência da radiação (s-1 ou Hz (hertz)); h: constante de Planck (h = 6,63x10-34 J. s). Do estudo de ondas, temos: c = λ.f, onde: c: velocidade da luz no vácuo: v = 300000 km/s λ: comprimento de onda Em 1913, Bohr propôs que um elétron num átomo só pode ter certas energias específicas e cada uma delas corresponde a uma órbita particular. O átomo está no estado fundamental quando todos os seus elétrons estiverem nas configurações de menor energia possível. Seu modelo foi baseado nos seguintes postulados: I) O elétron descreve órbitas circulares e estacionárias em torno do núcleo (cada órbita correspondendo a um nível quântico de energia). II) Quando uma partícula unieletrônica (hidrogenóide) recebe energia seu elétron salta para um nível energético mais alto (órbita ou camada mais externa). Cessada a excitação o elétron volta ao seu nível de origem, sendo a energia absorvida, então emitida sob a forma de radiação eletromagnética (luz), formando o espectro de emissão. III)A força eletrostática (coulombiana) elétron-núcleo é igual à força centrípeta resultante do movimento circular uniforme do elétron em torno do núcleo. Feletrostática = k . Fcentrípeta = q1 . q 2 ; r2 mv 2 , onde: r k: constante coulombiana (k = 9,0x 109 N.m2.C-2) q1: carga do elétron (–e) q2: carga do núcleo (+Ze) e = 1,6x10-19 C r: raio da órbita (circular) do elétron m: massa do elétron (m = 9,1x10-31 kg) v: velocidade do elétron (em sua órbita) IV) O momento angular do elétron (m v r), em sua órbita, é um múltiplo inteiro da quantidade mvr = h 2π nh , onde: 2π r: raio da órbita (circular) do elétron m: massa do elétron (m = 9,1x10-31 kg) v: velocidade do elétron (em sua órbita) h: constante de Planck (h = 6,63x10-34 J. s) n: camada energética (K = 1 / L = 2 / M = 3, etc.) A energia total (Et) de um elétron em uma órbita é: E t = − 13,6 Z2 (eV ) n2 , onde Z é o número atômico do elemento Observações: a) O eV (elétron-volt) é uma unidade de energia, cujo valor em joule é: 1 eV = 1,602.10-19 J b) As energia potencial e total crescem para a periferia do átomo, enquanto a energia cinética decresce no mesmo sentido. Para um nível bastante afastado (n = ∞), a energia total é por convenção igual a zero. Justifica-se, assim, o sinal menos (-) na equação. No limite, quando n = ∞ , o elétron está, de fato, separado do núcleo, sendo a sua energia igual a zero (convenção). c) Dizemos que um átomo está no estado fundamental (normal) quando seus elétrons apresentam as mais baixas energias possíveis. Se a energia é absorvida por um átomo no estado fundamental, o valor aumentará. Dizemos, então, que o átomo está em um estado excitado, podendo voltar ao normal emitindo energia. Essa absorção ou emissão de energia sempre se dá na forma de radiação (onda). Quando falamos sobre o salto de elétrons entre níveis de Bohr no átomo de hidrogênio, podemos relacionar o comprimento da onda de energia absorvida/emitida com as camadas envolvidas de acordo com a fórmula abaixo: ⎛ 1 1 ⎞ = Rh .⎜ 2 − 2 ⎟ , onde: ⎜n λ n f ⎟⎠ ⎝ i 1 λ: comprimento de onda Rh: constante de Rydberg para o átomo de hidrogênio: 1,1 x 107 m-1 ni: camada energética inicial nf: camada energética final Se um elétron é arrancado do átomo, pelo modelo de Bohr devemos considerar que nf = ∞ O modelo de Bohr está representado na figura abaixo: Modelo de Sommerfeld (1916) O modelo de Bohr considerava que a energia do elétron dependia exclusivamente do nível energético ao qual ele pertence. Mas, em alguns experimentos foi identificado que existiam elétrons dentro de um mesmo nível com energias diferentes. Para explicar esse fenômeno Sommerfeld propõe que além das órbitas circulares propostas por Bohr, também existiriam órbitas elípticas o que explicaria a diferença de energias. Para uma camada n de Bohr existiriam n possibilidades de órbitas, sendo uma circular e as restantes elípticas. A introdução dessa múltipla possibilidade de órbitas dentro de uma mesma camada pode ser considerada como surgimento da idéia dos subníveis, com um nível n podendo possuir até n subníveis. Exercícios Resolvidos 1. Dalton, Rutherford e Bohr propuseram, em diferentes épocas, modelos atômicos diferentes. Alguns desses modelos são apresentados a seguir: Modelo e Características I- núcleo atômico, denso, com carga positiva e elétrons ao redor. II- Átomos maciços e indivisíveis III- Núcleo atômico denso, com carga positiva e elétrons em órbitas circulares de energia quantizada. A associação modelo-cientista correta é: a) I/Bohr; II/Dalton; III/Rutherford. b) I/Dalton; II/Bohr; III/Rutherford. c) I/Dalton; II/Rutherford; III/Bohr. d) I/Rutherford; II/Bohr; III/Dalton. e) I/Rutherford; II/Dalton; III/Bohr. Solução: De acordo com o estudado, Dalton em seu conceito inicial acreditava num átomo indivisível levou em consideração a natureza elétrica da matéria. Sendo assim, está de acordo com a afirmativa II. Rutherford ao realizar sua experiência do espalhamento verificou que o átomo deveria ter uma parte positiva concentrada no centro (núcleo) com uma região composta por partículas negativas ao seu redor (eletrosfera). Ele ainda não tratou dos níveis energéticos, que foi citada pela primeira vez no modelo de Bohr. Sendo assim, o gabarito é a letra E. 2. (ITA) Considerando a experiência de Rutherford, assinale a afirmativa FALSA. a)A experiência consistiu em bombardear películas metálica com partículas alfa. b)Algumas partículas alfa foram desviadas do seu traçado devido a repulsão exercida pelo núcleo positivo do metal. c)Observando o espectro de difração das partículas alfa, Rutherford concluiu que o átomo tem densidade uniforme. d)Essa experiência permitiu descobrir o núcleo atômico e seu tamanho relativo. e)Rutherford sabia antecipadamente que as partículas alfa eram carregadas positivamente. Solução: De acordo com o experimento do espalhamento, a grande maioria das partículas não sofria desvio, enquanto uma pequena parte, que se chocava com o núcleo, desviava ou retornava. Sendo assim, ficava caracterizada a concentração da massa na região central, ou seja, a densidade não era uniforme. A resposta é letra C. 3. Para uma transição eletrônica do lítio, a diferença de energia é 195,9 kJ/mol. Calcule o comprimento de onda, em nm, da luz emitida nesta transição. Dados: h = 6,626 x 10-34 J.s NA = 6,02 x 1023 mol-1 c = 3 x 108 m.s-1 1 nm = 10-9 m Solução: hc Ef ‐ Ei = λ hc = 6,626 x 10‐34 x 10‐3 kJ.s x 3 x 108 x 109 nm.s‐1 x 6,02 x 1023mol‐1 = 1,197 x 105 kJ.nm/ mol hc Ef ‐ Ei = λ = 195,9 kJ.mol‐1 = λ = 1,197 x10 5 kJnm / mol λ 1,197 x10 5 kJnm / mol = 611,0nm 195,9
Download