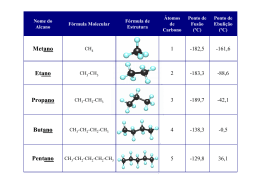
RELAÇÕES DE MASSA-parte 1 Massa atômica Em química, no lugar das unidades convencionais, a massa de um átomo é expressa em unidades de massa atômica (u) que equivale exatamente a 1/12 da massa do isótopo 12C (carbono 12). Na unidade comum, corresponde: 1u = 1,6605402 x 10-24 g RELAÇÕES DE MASSA-parte 1 Massa atômica Portanto, a massa atômica do carbono = 12 u, do hidrogênio = 1 u, etc. Algumas vezes é usada a designação peso atômico, que conceitualmente é incorreta. RELAÇÕES DE MASSA-parte 1 Massa atômica RELAÇÕES DE MASSA-parte 1 Massa molecular É dada pela soma das massas atômicas de todos os átomos de uma molécula. Exemplo: Para a molécula C12H22O11 (açúcar), a massa molecular é calculada por: RELAÇÕES DE MASSA –parte 1 Massa molecular 12 átomos de carbono = 12 x 12,0 u = 144 u. 22 átomos de hidrogênio = 22 x 1,0 u = 22 u. 11 átomos de oxigênio = 11 x 16 = 176 u. Assim a massa molecular (M.A.) da sacarose – açúcar - é 342 u.
Download