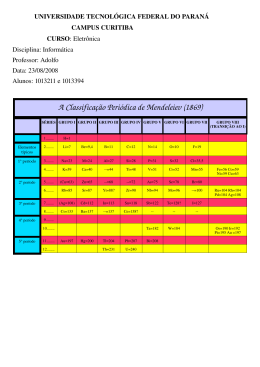
“Um novo jeito de se aprender química” Helan Carlos e Lenine Mafra- Farmácia- 2014.2 ATENÇÃO: Não sou o detentor dos direitos e também não tenho a intenção de violá-los de nenhuma imagem, exemplo prático ou material de terceiros que porventura venham a ser utilizados neste ou em qualquer outro material. TABELA PERIÓDICA E SUAS PROPRIEDADES A tabela periódica é um modelo utilizado para agrupar todos os elementos químicos conhecidos, levando em conta diversa das suas propriedades. Hoje os elementos encontram-se organizados em ordem crescente correspondente aos números atômicos, ou seja, o número de prótons presente no núcleo atômico. No total, a Tabela Periódica possui 118 elementos químicos, no qual cada quadrado especifica o nome do elemento químico, seu símbolo e seu número atômico. 1 “Um novo jeito de se aprender química” Helan Carlos e Lenine Mafra- Farmácia- 2014.2 HISTÓRIA DA TABELA PERIÓDICA A Tabela Periódica atualmente utilizada no mundo inteiro segue os padrões que são estabelecidos pela IUPAC (sigla em inglês da União Internacional de Química Pura e Aplicada), mas a elaboração essencial dela envolveu o trabalho de várias cientistas ao longo de muitos anos. Embora o químico russo Dmitri Mendeleiev seja frequentemente citado como o inventor da Tabela Periódica, outros cientistas antes dele já vinham tentando elaborar um sistema de classificação dos elementos químicos. JOHANN WOLFGANG DOBEREINER (Tríades) Em 1829 o químico alemão Döbereiner analisou os elementos cálcio, estrôncio e bário, e percebeu que a massa do átomo de estrôncio correspondia, aproximadamente, à média dos valores das massas atômicas do cálcio e do bário. Foi então que ele reuniu os elementos em grupos de 3 denominados tríades. Exemplo: Ca = 40,1u 40,1+137,3 2 = 87,6 Sr = 87,6u Ba = 137,3u Döbereiner foi o primeiro cientista a relacionar os elementos químicos conhecidos com base em um determinado critério, entretanto, suas observações não foram tidas como relevantes pela comunidade científica da época. Uma das falhas do seu método é que muitos metais não podiam ser agrupados em tríades. ALEXANDRE CHANCOURTOIS (Parafuso Telúrico) Em 1862 foi a fez do geólogo francês Chancourtois propor o modelo que ficou conhecido como parafuso telúrico. Ele elaborou um agrupamento dos elementos químicos sobre um cilindro, este era dividido por linhas verticais em 16 faixas, de modo que os elementos que possuíam propriedades semelhantes apareciam uns sobre os outros dentro dessas faixas. Esse modelo relacionava as propriedades dos elementos químicos às posições que eles ocupavam na sequência. 2 “Um novo jeito de se aprender química” Helan Carlos e Lenine Mafra- Farmácia- 2014.2 O modelo de parafuso telúrico despertou pouco interesse a comunidade científica, pois ele só se aplicava para elementos com massa atômico igual ou inferior a 40 além de havia elementos que, apesar de estarem em posição correta na ordem crescente, apresentavam propriedades diferentes dos demais elementos situados na mesma faixa, o que invalidava o padrão. JOHN ALEXANDER NEWLANDS (Lei das Oitavas) Newlands buscou inspiração na música. Sabe-se que em uma sequência crescente de sete notas iniciada em dó, a oitava nota é dó novamente e depois dela a sequência se repete. Em 1864, Newlands elaborou uma periodicidade semelhante a essa para ser aplicada aos elementos químicos. Ele enfileirou os elementos conhecidos na época em linhas horizontais, sete em cada linha, em ordem crescente de massas atômicas. Nessa forma de classificação, a cada oito elementos as propriedades se repetiam, por isso a proposta de Newlands recebeu o nome de Lei das Oitavas. Entretanto, o modelo só se mostrava coerente até chegar ao cálcio e não valia para os elementos que vinham depois dele conforme a ordem crescente de massas atômicas. Apesar disso, hoje ele é reconhecido como o cientista que trouxe a noção de periodicidade para o campo da química, e seu trabalho é tido como precursor do de Mendeleiev. DIMITRI IVANOVICH MENDELEIEV Em 1869, Mendeleey, um químico russo que ficou conhecido como pai da tabela periódica apresentou uma classificação que é a base da classificação periódica moderna, baseado em seu jogo de cartas ele colocou os elementos em ordem crescente de suas massas atômicas, observando que as propriedades químicas 3 “Um novo jeito de se aprender química” Helan Carlos e Lenine Mafra- Farmácia- 2014.2 apresentadas por eles se repetem periodicamente. Por essa razão, ele chamou o modelo de Tabela Periódica dos Elementos. A Tabela Periódica, de certa forma, incorporava os modelos anteriores propostos por Döbereiner, Chancortouis e Newlands, mesmo que a validade desses padrões só fosse verificada em determinados trechos da Tabela. Além disso, nela se encaixavam todos os elementos conhecidos na época. No entanto, Mendeleiev ainda percebia incoerências em seu modelo. 1. Uma delas eram os elementos que, embora estivessem no mesmo grupo que outros elementos de propriedades semelhantes, tinham massa atômica que não se encaixava na ordem crescente. Nesses casos, Mendeleiev desafiou a ciência ao defender que o problema não estava em seu sistema de classificação, e sim no cálculo da massa atômica do elemento, que estava errada. 2. Outra aparente falha da Tabela Periódica era a inexistência de elementos que apresentassem determinados valores de massas atômicas necessários à continuidade da sequência crescente. Para esse problema o cientista adotou uma solução simples, mas ousada: deixava lacunas correspondentes a eles e continuava a sequência com os elementos conhecidos. Ele tinha certeza de que os elementos correspondentes às lacunas existiam, apenas não tinham sido descobertos ainda. Sua segurança era tanta que o químico arriscou até mesmo prever as propriedades de alguns daqueles elementos Considerações nas descobertas de Mendeleev Ordem crescente de massa atômica Cálculo de massas atômicas errada de alguns elementos Espaços vazios na tabela para elementos ainda não descobertos Não se conhecia os gases nobres Era conhecidos cerca de 60 elementos na época. 4 “Um novo jeito de se aprender química” Helan Carlos e Lenine Mafra- Farmácia- 2014.2 desconhecidos, baseando seus palpites na massa atômica que eles deveriam ter e na posição que a lacuna ocupava na Tabela. CURIOSIDADE; Julius Meyer anos antes já havia elaborada uma tabela periódica semelhante com a que Mendeleev propôs, no entanto, Meyer duvidou muitos das suas conclusões e levou muito tempo revisando seus resultados, e só os publicou cerca de um ano após a publicação de Mendellev, ficando assim com sua pesquisa ofuscada. HENRY GWYNJEFFREYS MOSELEY No início do século XX o físico inglês Moseley examinou os espectros dos raiosX característicos de cerca de 40 elementos, neste estudo ele chegou à conclusão de que o número atômico podia ser usado como critério de organização dos elementos químicos, em vez da massa atômica. A aplicação desse padrão corrigiria as falhas existentes nas tabelas de Mendeleiev e de Meyer. As poucas lacunas que ainda persistiram na Tabela foram preenchidas mais tarde por alguns elementos descobertos e outros sintetizados em laboratório. Assim chegou-se a uma versão da Tabela Periódica muito parecida com a que temos atualmente, composta por linhas chamadas de períodos (ou níveis) e colunas chamadas de famílias (ou grupos). ORGANIZAÇÃO DA TABELA PERIÓDICA PERÍODOS DA TABELA PERÍODICA: Os períodos que também podem ser chamados de linhas, níveis ou série periódicos, é um total de sete, numerados de cima para baixo. Este número da ordem do período indica o número de níveis energéticos ou camadas eletrônicas do elemento. 5 “Um novo jeito de se aprender química” Helan Carlos e Lenine Mafra- Farmácia- 2014.2 Na tabela encontra-se: 1º período – 1 camada e 2 elementos 2º período – 2 camadas e 8 elementos 3º período – 3 camadas e 8 elementos 4º período – 4 camadas e 18 elementos 5º período – 5 camadas e 18 elementos 6º período – 6 camadas e 32 elementos 7º período – 7 camadas e até agora 30 elementos OBS: O sexto período possui 32 elementos, isso porque nele são contados os 14 elementos da série dos lantanídeos, embora essa série seja representada abaixo da tabela principal, como um bloco destacado. O mesmo acontece com o sétimo período, que tem 30 elementos, 14 deles representados à parte, na série dos actinídeos. FAMÍLIAS DA TABELA PERIÓDICA- Família, coluna ou grupos periódicos são as linhas verticais no qual os elementos possuem o mesmo número de elétrons na camada mais externa, ou seja, na camada de valência. Muitos elementos destes grupos também estão relacionados de acordo com suas propriedades químicas. Hoje a IUPAC recomenda que sejam numeradas de 1 a 18 de esquerda para direta, no entanto, para facilitar nosso entendimento vamos continuar designando as famílias pelas letras A e B. São dezoito Grupos (A e B), sendo que as famílias mais conhecidas são do Grupo A: 6 “Um novo jeito de se aprender química” Helan Carlos e Lenine Mafra- Farmácia- 2014.2 Família I A: Metais Alcalinos (lítio, sódio, potássio, rubídio, césio e frâncio). MACETE: Hoje Li Na Kama Robinson Crusoé Francês. H / Li / Na / K / Rb / Cs /Fr OBS: O Hidrogênio embora apareça na família IA, ele não é considerado um metal alcalino, pois ele possui características químicas totalmente diferentes dos elementos pertencentes a este grupo. Família II A: Metais Alcalino-Terrosos (berílio, magnésio, cálcio, estrôncio, bário e rádio). MACETE: Bela Margarida Casou com o Senhor BaRao. Be / Mg / Ca / Sr / Ba / Ra Família III A: família do Boro (boro, alumínio, gálio, índio e tálio). MACETE: Belas Alunas Gatas Indo Telefonar B / Al / Ga / In / Tl Família IV A: família do Carbono (carbono, silício, germânio, estanho e chumbo). MACETE: Comi Simone Gerusa Sen Problemas C / Si / Ge / Sn / Pb Família V A: família do Nitrogênio (nitrogênio, fósforo, arsênio, antimônio e bismuto). MACETE: Nossos Pais Asssam Saborosos Bifes N / P / As / Sb / Bi Família VI A: Calcogênios (oxigênio, enxofre, selênio, telúrio e polônio). MACETE: OS SeTe Porquinhos O / S / Se / Te / Po Família VII A: Halogênios (flúor, cloro, bromo, iodo e astato). MACETE: Ficou Claro que Brahma é Igual a Antartica F / Cl / Br / I / At Família VIII A: Gases Nobres (hélio, neônio, argônio, criptônio, xenônio e radônio). MACETE: Helio Nem Argumento Cravou a Xereca da Rainha He / Ne / Ar / Cr / Xe/ Ra 7 “Um novo jeito de se aprender química” Helan Carlos e Lenine Mafra- Farmácia- 2014.2 POSIÇÃO E CARACTERÍSITCAS DOS ELEMENTOS QUÍMICOS NA TABELA PERIÓDICA Elementos Representativos ou típicos: É os elementos do grupo A onde possui o último elétron em seu subnível energético s ou p. Elementos de transição: Elementos do grupo B, e seu subnível mais energético termina em d ( elementos de transição externa) ou f (Elementos de transição interna representados pelos lantanídeos e actinídeos. Metais: Características Apresenta elevados pontos de ebulição e fusão. São dúcteis (Capazes de fazer fios). Maleáveis (Tornam-se lâminas). São bons condutores de calor e eletricidade. São muitos eletropositivos (Tendem a formar cátions). São sólidos em condições ambientes com exceção do mercúrio. O tungstênio tem o maior ponto de fusão dos metais. Semi-metais: Características São elementos que apresentam propriedades intermediárias entre metais e ametais. Estes são sólidos em temperaturas ambientes e ao se combinar com outros elementos, podem se comportar como metal ou ametal. Ametais: Características São péssimos condutores de calor e eletricidade, com exceção do carbono grafite. Apresentam baixos pontos de ebulição e fusão. Formam compostos covalentes. São muitos eletronegativo ( Tendem a formar ânion) Gases nobres: Características São sete elementos que se encontram no estado gasoso e possuem uma grande estabilidade. Características gerais: 8 “Um novo jeito de se aprender química” Helan Carlos e Lenine Mafra- Farmácia- 2014.2 Quase todos os elementos da tabela periódica encontram-se no estado gasoso, salvo algumas exceções. No estado líquido encontra-se o mercúrio (metal) e o bromo (ametal). No estado gasoso temos F,O,N,Cl,H (Fui Ontem No Clube Hospedar) e os gases sobres. Todos os elementos químicos acima do número atômico do Urânio 92, são todos eles artificiais chamados de transurânicos. Abaixo dele, com exceção Tc e Pm, todos são naturais. Todos os elementos a partir do chumbo são considerados radioativos. RELAÇÃO ENTRE DISTRIBUIÇÃO ELETRÔNICA E A POSIÇÃO DOS ELEMENTOS NA TABELA PERIÓDICA Existe uma relação entre os períodos da tabela periódica e os níveis energéticos que os elementos apresentam e também uma relação da família com o número de elétrons na última camada. Note que a Tabela possui sete períodos, numerados de cima para baixo. O número de cada um deles corresponde à quantidade de níveis (ou camadas) que seus elementos apresentam. Assim, os elementos do primeiro período, hidrogênio e hélio, apresentam apenas um nível energético, enquanto os do segundo período possuem dois níveis, e assim por diante, até o sétimo período. Período I (Apresenta um total de 1 camadas e 2 elementos) H(Z=1) = 1s1 He(Z=2) = 1s2 Período II (Apresenta um total de 2 camadas e 8 elementos) Li(Z=3) = 1s2, 2s1 Be(Z=4) = 1s2, 2s2 B(Z=5) = 1s2, 2s2, 2p1 C(Z=6) =1s2, 2s2, 2p2 As famílias na tabela periódica são numeradas da esquerda para direta. O número de cada um corresponde à quantidade de elétrons na última camada, ou seja a cama de valência. Assim, os elementos da primeira família, Hidrogênio, lítio, sódio, 9 “Um novo jeito de se aprender química” Helan Carlos e Lenine Mafra- Farmácia- 2014.2 apresenta somente um elétron na sua última camada, enquanto os elementos da segunda família apresentam dois e assim por diante. OBS: Essa regra só se aplica aos elementos representativos (grupos A) e 1B e 2B. Família IA (Apresenta um total de 1 elétron em sua última camada) H(Z=1) = 1s1 Li(Z=3) = 1s2, 2s1 Na(Z=11) = 1s2, 2s2, 2p6, 3s1 K(Z=19) = 1s2, 2s2, 2p6, 3s2, 3p6, 4s1 Família IIA (Apresenta um total de 2 elétron em sua última camada) Be(Z=4) = 1s2, 2s2 Mg(Z=12) = 1s2, 2s2, 2p6, 3s2 Ca(Z=20) = 1s2, 2s2, 2p6, 3s2, 3p6, 4s2 10 “Um novo jeito de se aprender química” Helan Carlos e Lenine Mafra- Farmácia- 2014.2 REFERENCIAS BIBLIOGRÁFICAS: FELTRE, Ricardo - Fundamentos da Química (4ª edição), São Paulo - 2005 (Ed. Moderna). ATKINS, P ; JONES L.Princípios de química:questionando a vida moderna e o meio ambiente.1ed.Porto Alegre:Bookman,2001 RUSSEL, John B. Química Geral. 2. ed. São Paulo:Makron Books, 1994. BROWN, Theodore L.et al.Química: a ciência central. 9. ed.São Paulo:Pearson Prentice Hali,2007. SITES UTILIZADOS COMO FONTE: http://www.soq.com.br/ http://www.mundoeducacao.com/ http://www.brasilescola.com/quimica 11
Download