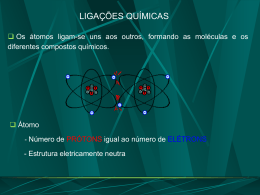
Estrutura Atômica e Ligações Interatômicas • Revisão sobre estrutura atômica • Ligação atômica em sólidos • Tabela periódica • Ligações interatômicas primárias Iônica Covalente Metálica • Ligações secundárias (forças de Van Der Waals) • Moléculas e sólidos moleculares Entender as ligações interatômicas é o primeiro passo em direção à compreensão/explicação das propriedades dos materiais. Revisão sobre estrutura atômica Átomos = núcleo (prótons e nêutrons) + elétrons Cargas: elétrons e prótons têm cargas negativa e positiva de mesma magnitude: 1,6 x 10-19 Coulombs. Nêutrons são eletricamente neutros. Massas: prótons e nêutrons têm a mesma massa: 1.67 x 10-27 kg. A massa de um elétron é muito menor, 9.11x10-31 kg e pode ser desprezada no cálculo de massas atômicas. Massa atômica (A) = massa de prótons + massa de elétrons # prótons fornecem a identificação química do elemento # número de prótons = número atômico do elemento (Z) # nêutrons define o número do isótopo do elemento Revisão sobre estrutura atômica Isótopos: várias formas de um mesmo elemento, que se diferenciam entre si pelo número de nêutrons presentes em seu núcleo (12C, 13C, etc); Peso atômico: média das massas atômicas dos isótopos do átomo; Unidade de massa atômica (uma): 1 uma = 1/12 da massa atômica do 12C; Mol: 6,023 x 1023 átomos ou moléculas equivale a um mol de substância. Este valor corresponde ao número de Avogadro (Nav); Nav = 1 g/ 1 uma uma mol = 1 (uma/átomo ou molécula) = 1 (g/mol). Elétrons nos Átomos orbital electrons: n = principal quantum number 1 2 n=3 Núcleo Modelo Atômico de Bohr: elétrons revoluem em torno do núcleo do átomo; a posição de qualquer elétron é bem definida em termos de sua orbital; um elétron pode se mover de um nível para outro, mas ele só deve se mover para um nível próximo se ceder ou adquirir energia suficiente para isso. Elétrons nos Átomos Modelo da Mecânico-Ondulatório: elétron exibe características tanto de onda quanto de partícula; criada a idéia de sub-orbitais para cada nível primário de energia; Dois elétrons por sub-orbital; Princípio de exclusão de Pauli: um elétron pode ser caracterizado por 4 números quânticos: n - número quântico principal l - segundo número quântico ml - terceiro número quântico ms - quarto número quântico Elétrons nos Átomos Elétrons: têm estados discretos de energia; tendem a ocupar o mais baixo estado de energia E n e r g i a Elétrons nos Átomos • Configurações estáveis observada quando a camada mais externa, ou camada de valência, está completamente preenchida com elétrons; tendem a ser não reativos. os elétrons que ocupam a camada de valência são responsáveis pelas ligações interatômicas; Elétrons nos Átomos Estável Eletronegativo Eletropositivo A Tabela Periódica Colunas: valência similar Elementos eletropositivos Metais são eletropositivos Elementos eletronegativos A Tabela Periódica Menor eletronegatividade Maior eletronegatividade Valores grandes de eletronegatividade indicam tendência de seqüestrar elétrons. Energias e Forças de Ligação Estado de equilíbrio: FA+FR = 0 Energia total: EN = ER+EA Energia de ligação: E0 r0 = distância interatômica Energia de atração: EA = -A/r Energia de repulsão: ER = B/rn n8 O que faz uma molécula ser diferente de outra? Diamante Grafite Ligações Interatômicas Ligações iônicas: Ocorre entre íons + e Requer transferência de elétrons Requer grande diferença de eletronegatividade entre os elementos Exemplo: NaCl Ligações Iônicas Ligações Iônicas Ocorre predominantemente nas cerâmicas NaCl MgO CaF2 CsCl H 2.1 Li 1.0 Be 1.5 Na 0.9 Mg 1.2 K 0.8 Ca 1.0 Sr 1.0 Rb 0.8 Cs 0.7 Fr 0.7 Ti 1.5 Ba 0.9 Cr 1.6 Fe 1.8 Ni 1.8 He O 3.5 Zn 1.8 As 2.0 F 4.0 Cl 3.0 Ne - Br 2.8 I 2.5 Kr Xe Rn - At 2.2 Ra 0.9 Cede elétrons Seqüestra elétrons Ar - Ligações Iônicas Números de coordenação e geometrias Ligações Covalentes Configuração estável devido ao compartilhamento de elétrons de átomos vizinhos; Átomos ligados convalentemente contribuem com ao menos um elétron, cada um, para a ligação; Os elétrons compartilhados pertencem a ambos os átomos; Ligações Covalentes Ex: CH4 C: tem valência 4 e precisa de mais quatro elétrons; H: tem valência 1 e precisa de mais um elétron; Eletronegatividades são equivalentes Ligações Covalentes Exemplos: Moléculas de metais e não metais; Moléculas com não metais; Sólidos elementares e compostos sólidos (IVA) H2 H 2.1 Li 1.0 Na 0.9 K 0.8 C(diamond) SiC Be 1.5 Mg 1.2 Ca 1.0 Rb 0.8 Cs 0.7 Sr 1.0 Ba 0.9 Fr 0.7 Ra 0.9 column IVA H2O Ti 1.5 Cr 1.6 Fe 1.8 F2 He O 2.0 C 2.5 Ni 1.8 Zn 1.8 Ga 1.6 Si 1.8 Ge 1.8 As 2.0 Sn 1.8 Pb 1.8 GaAs F 4.0 Cl 3.0 Ne - Br 2.8 Ar Kr - I 2.5 Xe - At 2.2 Rn - Cl2 Ligações Metálicas Uma ligação metálica se forma quando átomos cedem seus elétrons de valência, que então formam um mar de elétrons. O núcleo dos átomos, positivamente carregados se ligam, por atração mútua, aos elétrons carregados negativamente. Quando aplica-se uma voltagem elétrica a um metal, os elétrons no mar de elétrons podem se mover facilmente e transportar uma corrente. Ligações Secundárias ou de Van Der Waals Atração Repulsão Forças de Coulomb entre dipolos A ligação de Van Der Waals é formada como resultado da polarização de moléculas ou grupos de átomos. Na água, os elétrons de oxigênio tendem a se concentrar distantes dos elétros de hidrogênio. A diferença de carga resultante permite que uma molécula de água se ligue fracamente a outras moléculas de água. Ligações Secundárias ou de Van Der Waals * Iônica * Covalente * Metálica
Download