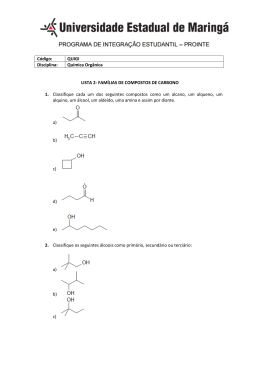
Código: Disciplina: Preceptores: Semana: QUIGI Química Geral e Inorgânica Ana Carolina Barizão e André 03/08/2015 LISTA 9 – GEOMETRIA MOLECULAR e CINÉTICA QUÍMICA (Cap. 14) 1. Determine se as seguintes moléculas são polares ou apolares: a) IF; b) CS2; c) SO3; d) PCl3; 2. Considere a seguinte reação hipotética em solução aquosa: A (aq) B (aq). Um frasco é carregado com 0,065 mol de A em um volume total de 100,0 mL. Os seguintes dados são coletados: Tempo 0 10 20 30 40 0,051 0,042 0,036 0,031 (min) Quant. De 0,065 Matéria a) Calcule a quantidade de matéria de B em cada tempo na tabela, supondo que não existem moléculas de B quando o tempo for zero. b) Calcule a velocidade média de desaparecimento de A para cada intervalo de 10 min, em unidade de mol L-1 s-1. 3. Se a reação seguinte ocorre em uma única etapa elementar, determine a lei de velocidade: H2(g)+Br2(g) 2HBr(g) 4. Uma reação A+B C obedece à seguinte lei de reação: velocidade= k[A]2 [B]. a) Se [A] é dobrada, como variará a velocidade? A constante de velocidade variará? b) Quais são as ordens de reação para A e B? Qual a ordem de reação total? 5. Calcule a fração de átomos em uma amostra de gás argônio a 400K que tem energia maior ou igual a 10,0 KJ. 6. A constante de velocidade de primeira ordem para a decomposição de determinado inseticida em água a 12 ° C é 1,45 ano-1. Certa quantidade desse inseticida é carregada pela água para um lago em 1º de Junho, levando a uma concentração de 5,0 x 10 -7 g/ cm3 de água. Suponha que a temperatura média do lago seja 12° C. a) Qual será a concentração de inseticida em 1º de Junho do ano seguinte? b) Quanto tempo levará para a concentração do inseticida cair para 3,0 x 10-7 g/cm3? 7. a) Para uma reação de segunda ordem, qual grandeza que, quando colocada em um gráfico versus tempo, produzirá uma reta? b) Como as meias- vidas de reação de primeira e segunda ordem se diferem? 8. Qual é a molecularidade de cada um dos seguintes processos elementares? Escreva a lei de velocidade para cada um. a) Cl2(g) 2Cl(g) b) OCl- (g) + H2O (g) HOCl (g) + OH- (g) 9. A energia de ativação de determinada reação é 65,7 KJ/mol. Quantas vezes mais rápido a reação ocorrerá a 50 °C do que a 0 °C? 10. Você determina que a lei de velocidade para uma reação A B + C tem a forma, velocidade= k [A]x. Qual é o valor de x se: a) A velocidade triplica quando [A] é triplicada; b) A velocidade aumenta oito vezes quando [A] é dobrada; 11. A decomposição de N2O5 acontece como segue: 2N2O5 4NO2 + O2 A lei de velocidade é de primeira ordem em N2O5. A 64 °C a constante de velocidade é 4,28x 10-23 s-1. a) Escreva a Lei de velocidade para a reação. Referências: Brown. L. B. Química, A ciência central. Vol 1. 9a.ed. São Paulo: Pearson, 2013. Páginas 283 à 530. Gabarito: 1. Velocidade= k[H2] [Br2] 2. Esta questão será respondida durante a preceptoria. 3. a e b) Esta questão será respondida durante a preceptoria. 4. f = 2,33 10–2. A 400 K, aproximadamente 1 em cada 43 moléculas tem essa energia cinética. 5. a) Unimolecular, velocidade = k[Cl2] b) bimolecular, velocidade = k[OCl-][H2O] 6. Esta questão será respondida durante a preceptoria. 7. Esta questão será respondida durante a preceptoria. 8. A reação irá ocorrer 88 vezes mais rapidamente a 50 °C, supondo concentrações iniciais iguais. 9. a) x = 1 b) x = 3 10. a) Velocidade = k[N2O5] 11. Esta questão será respondida durante a preceptoria.
Download