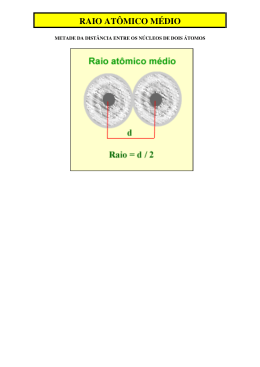
Lista de Química – P2 – 1°Ano Professora: Núbia de Andrade Aluno: ________________________________________________________ 1. Analise a representação a seguir. + 2+ Para descrever a seqüência de espécies Na, Na , K e Mg , a ordem correta das figuras deve ser escrita como a apresentada na alternativa: a) I, II, III e IV. b) II, I, III e IV. c) III, II, IV e I. d) IV, III, II e I. e) III, I, IV e II. 2+ 2. Um íon A apresenta configuração 1s, 2s, 2p, 3s, 3p, em que todos esses subníveis estão completos. Com base nestas informações, responda aos itens que seguem. a) Calcule o número atômico do elemento químico A. ___________________________________________________________________________________________ ___________________________________________________________________________________________ b) O raio atômico do íon será maior do que o do elemento A? Explique. _____________________________________________________________________________________________ _____________________________________________________________________________________________ _____________________________________________________________________________________________ ___________________________________________________________________________________ 3. Os átomos dos elementos X, Y e Z apresentam as seguintes configurações eletrônicas no seu estado fundamental: 2 2 5 X 1s 2s 2p 2 2 6 1 Y 1s 2s 2p 3s 2 2 6 2 6 10 2 5 Z 1s 2s 2p 3s 3p 3d 4s 4p É correto afirmar que: a) dentre os citados, o átomo do elemento X tem o maior raio atômico. b) o elemento Y é um metal alcalino e o elemento Z é um halogênio. c) dentre os citados, o átomo do elemento Z tem a maior afinidade eletrônica. d) o potencial de ionização do elemento X é menor do que o do átomo do elemento Z. e) o elemento Z pertence ao grupo 15 (VA) e está no quarto período da classificação periódica. 4. Dois ou mais íons ou, então, um átomo e um íon que apresentam o mesmo número de elétrons denominamse espécies isoeletrônicas. + 2+ 3+ Comparando-se as espécies isoeletrônicas F-, Na , Mg , e Al , conclui-se que: 2+ a) a espécie Mg apresenta o menor raio iônico. + b) a espécie Na apresenta o menor raio iônico. c) a espécie F apresenta o maior raio iônico. 3+ d) a espécie Al apresenta o maior raio iônico. + e) a espécie Na apresenta o maior raio iônico. 5. Os elementos que apresentam maiores energias de ionização são da família dos: a) metais alcalino-terrosos. b) gases nobres. c) halogênios. d) metais alcalinos. 6. Explique a diferença de raio atômico apresentado na figura abaixo: www.colegioanhanguera.com.br 1 7. Dê a definição para energia de ionização: 8. Dê a definição para eletronegatividade: 9. De acordo com as propriedades periódicas dos elementos químicos, analise as proposições abaixo. I. O tamanho do raio atômico dos elementos químicos cresce da direita para a esquerda nos periódicos e cresce de cima para baixo nos grupos. II.O tamanho do raio atômico dos elementos químicos cresce da esquerda para direita nos periódicos, assim como a eletropositividade. III. O iodo apresenta raio atômico menor do que o cloro. IV. O nitrogênio apresenta raio atômico maior do que o flúor. Analise a alternativa correta. a)Somente a afirmativa I é verdadeira. b)Somente as afirmativas II e III são verdadeiras. c)Somente as afirmativas I e III são verdadeiras. d)Somente as afirmativas I e IV são verdadeiras. e)Somente as afirmativas II e IV são verdadeiras. 10. O livro “A Tabela Periódica”, de Primo Levi, reúne relatos autobiográficos e contos que têm a química como denominador comum. Cada um de seus 21 capítulos recebeu o nome de um dos seguintes elementos da tabela periódica: Argônio, Hidrogênio, Zinco, Ferro, Potássio, Níquel, Chumbo, Mercúrio, Fósforo, Ouro, Cério, Cromo, Enxofre, Titânio, Arsênio, Nitrogênio, Estanho, Urânio, Prata, Vanádio, Carbono. Escreva o símbolo do elemento que dá nome a um capítulo e corresponde a cada uma das seis descrições a seguir. I – É metal alcalino. ________________________________________________________________________________________ II – É líquido na temperatura ambiente. ________________________________________________________________________________________ III – É o de menor potencial de ionização do grupo 15. ________________________________________________________________________________________ IV – É radioativo, usado em usinas nucleares. ________________________________________________________________________________________ 11. Os átomos dos elementos X, Y e Z apresentam as seguintes configurações eletrônicas no seu estado fundamental: 2 2 5 X 1s 2s 2p 2 2 6 1 Y 1s 2s 2p 3s 2 2 6 2 6 10 2 5 Z 1s 2s 2p 3s 3p 3d 4s 4p É correto afirmar que: www.colegioanhanguera.com.br 2 a) b) c) d) e) dentre os citados, o átomo do elemento X tem o maior raio atômico. o elemento Y é um metal alcalino e o elemento Z é um halogênio. dentre os citados, o átomo do elemento Z tem a maior afinidade eletrônica. o potencial de ionização do elemento X é menor do que o do átomo do elemento Z. o elemento Z pertence ao grupo 15 (VA) e está no quarto período da classificação periódica. www.colegioanhanguera.com.br 3
Download