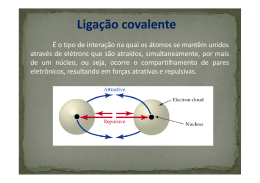
Aula 14 – 12/mai – Marcelo Ligação iônica versus ligação covalente Veja as ligações esquematizadas abaixo, cada qual acompanhada do respectivo valor de diferença (Δ, delta) entre as eletronegatividades de ambos os átomos. À medida em que a diferença de eletronegatividade aumenta, os elétrons passam a ser cada vez mais predominantemente atraídos por um dos átomos. http://www.mundodaquimica.com.br/2012/08/ligacao-ionica-x-ligacao-covalente/ Assim, a ligação iônica pode ser encarada como um caso extremo da ligação covalente polar, em que a diferença de eletronegatividade é tão grande que o elétron é transferido de um átomo para outro em vez de ser compartilhado por ambos. A fronteira entre a ligação covalente e a iônica não é algo extremamente claro e bemdefinido. De modo geral, pode-se considerar que valores de Δ acima de 2 indicam ligação com forte caráter iônico. E valores de Δ abaixo de 1,5 indicam ligação com caráter predominantemente covalente. Ligação Metálica: realizada entre átomos de metais. Os retículos cristalinos dos metais sólidos consistem em um agrupamento de cátion fixos unidos por elétrons livres da camada de valência (lembre-se que os metais possuem baixa eletronegatividade e elevada tendência de perder elétrons). A interação resultante entre os cátions fixos e os elétrons livres estabelece a ligação metálica. O modelo da ligação metálica é conhecido como “mar de elétrons” em que se tem um aglomerado de cátions fixos unidos por um verdadeiro “mar de elétrons”. Este tipo de estrutura é responsável pela forma cristalina dos metais e explica sua grande capacidade de conduzir corrente elétrica, tanto no estado sólido quanto no estado líquido. http://www.wonderwhizkids.com/conceptmaps/metallic_bond.html [acima, representação dos cátions Ag+ rodeados pelo mar de elétrons] Ligas metálicas: mistura de sólida de dois ou mais elementos sendo que a totalidade (ou pelo menos a maior parte) dos átomos presentes é de elementos metálicos. O uso de ligas metálicas se justifica uma vez que, na maioria das vezes, os metais puros não possuem as características adequadas para determinadas aplicações. Assim, adicionando-se certos elementos ao metal puro, pode-se alterar as seguintes propriedades: Ponto de fusão; Dureza; Resistência mecânica; Resistência à corrosão.. etc! Exemplos: Bronze: 90% cobre e 10% estanho. Latão: 67% cobre e 33% zinco. Aço: ferro e no máximo 2% de carbono. Aço inoxidável: adição de cromo e níquel ao aço comum. Chumbo para solda: 67% chumbo e 33% estanho. Ouro 18 quilates: 75% ouro, 12,5% de prata e 12,5% de cobre. Moeda comum: 75% cobre e 25% níquel. Propriedades características dos metais: Brilho; Alta condutividade térmica e elétrica; Elevados pontos de fusão e ebulição; Maleáveis; Dúcteis (fáceis de transformar em fios); Resistência à tração... Exercícios: 1) (FCMSC-SP) Na escala de eletronegatividade, tem-se: Esses dados permitem afirmar que, entre as substâncias a seguir, a mais polar é: a) O2(g) b) LiBr(g) c) NO(g) d) HBr(g) e) Li2(g) 2) (UEL-PR) O dissulfeto de hidrogênio H2S2, substância muito solúvel, tem estrutura semelhante à do peróxido de hidrogênio. Na molécula de dissulfeto, os átomos H e S e os átomos S e S estão unidos, respectivamente, por ligações: a) iônica e covalente polar. b) iônica e covalente coordenada. c) covalente polar e covalente polar. d) covalente polar e covalente apolar. e) covalente coordenada e covalente polar. 3) (Unesp-SP) Dentre as afirmativas abaixo, assinalar a que contém a afirmação incorreta. a) Ligação covalente é aquela que se dá pelo compartilhamento de elétrons entre dois átomos. b) O composto covalente HCℓ é polar, devido à diferença de eletronegatividade existente entre os átomos de hidrogênio e cloro. c) O composto formado entre um metal alcalino e halogênio é covalente. d) A substância da fórmula Br2 é apolar. e) A substância da fórmula CaI2 é iônica.
Download